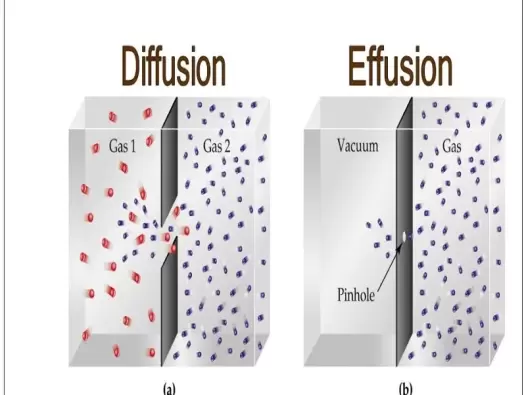
Khoa Học
Xem thêmHỏi Đáp
Xem Thêm
Nguyên tố Argon: Khái niệm, tính chất của khí hiếm
Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Argon, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn.

Nguyên tố Luteti: Định nghĩa, tính chất và phản ứng
Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Luteti, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn

Nguyên tố Mendelevi: Định nghĩa và bí ẩn của một nhà hóa học
Trong bài viết này, yeuhoahoc.edu.vn sẽ giới thiệu một cách toàn diện về nguyên tố Mendelevi, bao gồm khái niệm, lịch sử phát triển, các đặc tính, ứng dụng.

Nguyên tố Natri: Khám phá sức mạnh và ứng dụng đa dạng
Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Natri, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan.

Nguyên tố Niobi: Định nghĩa và vị trí trong bảng tuần hoàn
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn sâu sắc về nguyên tố Niobi, từ lịch sử hình thành đến tầm quan trọng của nó trong đời sống hiện đại.

Nguyên tố Zirconi: Khám phá ứng dụng và tính chất quan trọng
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp một cái nhìn sâu sắc về nguyên tố Zirconi, bao gồm định nghĩa, lịch sử và tầm quan trọng của nó trong đời sống

Nguyên tố Ytri: Đặc điểm, ứng dụng và tính chất hóa học
Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Ytri, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan.

Nguyên tố Stronti: Khái niệm, tính chất và phản ứng
Bài viết này, yeuhoahoc.edu.vn sẽ đưa ra cái nhìn tổng quan về nguyên tố Strontium, từ đặc điểm đến vai trò và ứng dụng của nó trong đời sống và công nghiệp.

Nguyên tố Rubiđi: Khái niệm, tính chất và ứng dụng
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Rubiđi, từ phát hiện lịch sử đến các ứng dụng trong cuộc sống hàng ngày.

Krypton: Nguyên tố hiếm và ứng dụng độc đáo trong khoa học
Bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá tính chất, ứng dụng và những điều thú vị về nguyên tố Krypton hấp dẫn này.