Kim loại và phi kim khác nhau ở điểm nào? Tính chất vật lý và hóa học
Trong hóa học, sự khác biệt giữa kim loại và phi kim thể hiện qua nhiều tính chất đặc trưng cả về mặt vật lý lẫn hóa học. Kim loại và phi kim nằm ở các phần khác nhau của bảng tuần hoàn và có những đặc điểm độc đáo về dẫn điện, dẫn nhiệt, độ cứng, và khả năng phản
Trong hóa học, sự khác biệt giữa kim loại và phi kim thể hiện qua nhiều tính chất đặc trưng cả về mặt vật lý lẫn hóa học. Kim loại và phi kim nằm ở các phần khác nhau của bảng tuần hoàn và có những đặc điểm độc đáo về dẫn điện, dẫn nhiệt, độ cứng, và khả năng phản ứng hóa học. Những khác biệt này không chỉ ảnh hưởng đến cách chúng tham gia vào các phản ứng hóa học mà còn tạo nên sự phong phú về ứng dụng trong các ngành công nghiệp, xây dựng, y học và nhiều lĩnh vực khác.
Tính chất vật lý của kim loại và phi kim
Tính chất vật lý của kim loại
Kim loại là nhóm nguyên tố có nhiều đặc điểm vật lý đặc trưng nhờ vào cấu trúc mạng tinh thể của chúng, bao gồm các đặc điểm sau:
Dẫn điện và dẫn nhiệt tốt: Kim loại có khả năng dẫn điện và nhiệt cao nhờ vào “biển electron” tự do. Trong cấu trúc mạng tinh thể của kim loại, các electron hóa trị có thể di chuyển tự do, tạo thành dòng điện khi có điện trường và dẫn nhiệt qua các va chạm giữa các electron.
Ánh kim đặc trưng: Kim loại thường có ánh kim sáng bóng do các electron tự do phản xạ ánh sáng. Ánh kim có thể thay đổi từ màu trắng bạc (như bạc, nhôm) đến màu xám (như chì) hoặc vàng (như vàng) dựa vào cấu trúc của chúng.
Độ dẻo và khả năng uốn cong, kéo dài: Kim loại dễ dàng thay đổi hình dạng mà không gãy nhờ các lớp nguyên tử trượt lên nhau khi có lực tác động. Tính chất này cho phép kim loại có độ dẻo và khả năng kéo dài tốt, như việc kéo đồng thành dây điện.
Điểm nóng chảy và điểm sôi cao: Phần lớn kim loại có điểm nóng chảy và điểm sôi cao do lực liên kết kim loại mạnh mẽ giữa các nguyên tử trong mạng tinh thể. Ví dụ, tungsten có điểm nóng chảy rất cao, thích hợp cho các ứng dụng chịu nhiệt.
Tính chất vật lý của phi kim
Phi kim có các đặc điểm khác biệt đáng kể với kim loại, thường không có cấu trúc mạng tinh thể như kim loại và có tính chất riêng:
Không dẫn điện, cách nhiệt: Khác với kim loại, phi kim không có các electron tự do và hầu như không dẫn điện hoặc dẫn nhiệt. Điều này làm cho phi kim thường được dùng làm vật liệu cách điện, như nhựa hoặc cao su.
Không có ánh kim, màu sắc đa dạng: Phi kim không có ánh kim do không có “biển electron” để phản xạ ánh sáng. Chúng có màu sắc đa dạng như khí clo màu vàng, lưu huỳnh màu vàng nhạt, và các phi kim không màu như hydro.
Giòn, dễ gãy, không có độ dẻo: Phi kim thường dễ gãy và không có độ dẻo. Chúng dễ dàng bị vỡ khi tác động lực mà không thể uốn cong hay kéo dài như kim loại. Ví dụ, lưu huỳnh dễ gãy và không thể biến đổi hình dạng khi áp dụng lực.
Điểm nóng chảy và điểm sôi thấp: Phần lớn phi kim có điểm nóng chảy và điểm sôi thấp hơn kim loại. Các phi kim như hydro, oxy, và nitơ tồn tại ở thể khí ở nhiệt độ phòng, và các phi kim rắn như lưu huỳnh cũng có nhiệt độ nóng chảy thấp hơn nhiều so với kim loại.
Tính chất hóa học của kim loại và phi kim
Tính chất hóa học của kim loại
Kim loại có nhiều đặc tính hóa học riêng biệt, thể hiện tính chất đặc trưng của nhóm nguyên tố này:
Thường là chất khử mạnh, dễ mất electron
Kim loại có xu hướng nhường electron để đạt cấu hình bền vững, khiến chúng trở thành chất khử mạnh. Quá trình này làm cho kim loại có tính chất dễ bị oxy hóa. Ví dụ, trong phản ứng hóa học, natri (Na) sẽ nhường một electron để trở thành ion Na⁺, trong khi sắt (Fe) nhường ba electron để tạo thành ion Fe³⁺. Tính chất này giúp kim loại phản ứng mạnh với nhiều phi kim, đặc biệt là trong các phản ứng oxi hóa khử.
Phản ứng với axit, tạo ra muối và khí hydro
Một trong những phản ứng phổ biến của kim loại là phản ứng với các axit mạnh như axit hydrochloric (HCl) và axit sulfuric (H₂SO₄). Trong phản ứng này, kim loại sẽ thay thế hydro trong axit và tạo thành muối cùng khí hydro. Ví dụ, phản ứng của kẽm (Zn) với HCl sẽ tạo ra kẽm clorua (ZnCl₂) và khí hydro (H₂):
Zn + 2HCl → ZnCl₂ + H₂↑
Phản ứng này thể hiện tính chất hóa học cơ bản của kim loại là khả năng khử ion H⁺ thành H₂.
Phản ứng với oxy, tạo thành oxit kim loại
Kim loại có xu hướng phản ứng với oxy trong không khí, đặc biệt ở nhiệt độ cao, để tạo thành oxit kim loại. Oxit kim loại thường là hợp chất ion với cấu trúc tinh thể bền vững. Ví dụ, sắt phản ứng với oxy để tạo thành oxit sắt (Fe₂O₃), đồng tạo ra oxit đồng (CuO). Các phản ứng này thường đi kèm với việc giải phóng năng lượng dưới dạng nhiệt:
4Fe + 3O₂ → 2Fe₂O₃
Tính chất này cho thấy xu hướng của kim loại trong việc mất electron và tạo liên kết ion với oxy.
Tính chất hóa học của phi kim
Phi kim thể hiện những tính chất hóa học khác biệt so với kim loại, nổi bật trong vai trò của chúng trong các phản ứng hóa học:
Thường là chất oxy hóa, dễ nhận electron
Phi kim có xu hướng nhận electron để đạt cấu hình bền vững, khiến chúng trở thành chất oxy hóa. Các phi kim như clo (Cl₂) và oxy (O₂) có khả năng nhận electron từ kim loại, tạo thành các hợp chất ion. Ví dụ, clo khi phản ứng với natri sẽ nhận electron để tạo thành ion Cl⁻, hình thành muối natri clorua (NaCl):
2Na + Cl₂ → 2NaCl
Khả năng nhận electron của phi kim tạo nên tính chất oxy hóa mạnh, giúp chúng phản ứng mạnh với kim loại.
Phản ứng với kim loại tạo thành muối
Khi phi kim phản ứng với kim loại, quá trình này thường tạo ra muối. Các phi kim như clo, lưu huỳnh và iốt khi phản ứng với kim loại sẽ hình thành các hợp chất muối ion. Ví dụ, phản ứng giữa kim loại kali (K) và phi kim clo (Cl₂) tạo ra muối kali clorua (KCl):
2K + Cl₂ → 2KCl
Điều này cho thấy tính chất cơ bản của phi kim trong vai trò là chất oxy hóa khi kết hợp với các kim loại để tạo thành hợp chất bền vững.
Tạo thành oxit axit khi phản ứng với oxy
Khi phi kim phản ứng với oxy, các sản phẩm tạo ra thường là oxit axit. Những oxit này có tính axit khi hòa tan trong nước, tạo ra các axit tương ứng. Ví dụ, khi lưu huỳnh (S) phản ứng với oxy, nó tạo thành lưu huỳnh điôxit (SO₂), và khi hòa tan trong nước, SO₂ tạo ra axit sunfurơ (H₂SO₃):
S+O2→SO2 SO2+H2O→H2SO3
Tính chất này của phi kim nhấn mạnh vai trò của chúng trong việc tạo ra các hợp chất axit qua phản ứng với oxy.
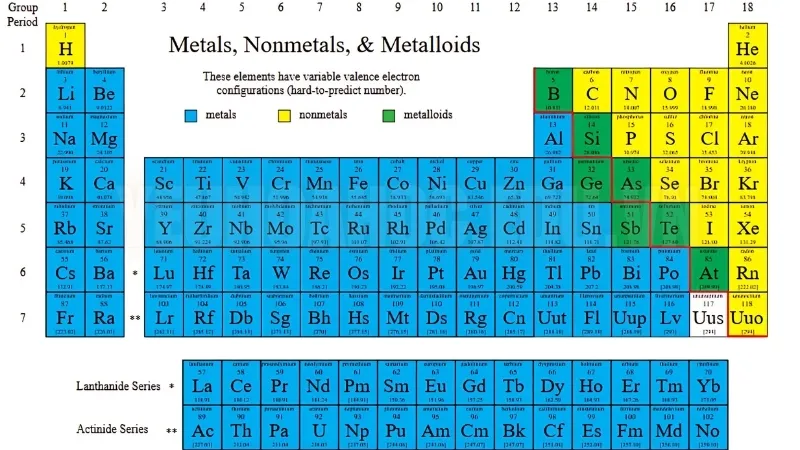
Vị trí trong bảng tuần hoàn của kim loại và phi kim
Trong bảng tuần hoàn, vị trí của kim loại và phi kim phản ánh tính chất hóa học và vai trò của chúng trong các phản ứng hóa học:
Kim loại
Phần lớn các kim loại nằm ở bên trái và trung tâm bảng tuần hoàn, chiếm nhiều nhóm khác nhau từ nhóm s, d và f, thể hiện tính chất hóa học đặc trưng của mỗi nhóm.
Các nhóm nguyên tố
- Nhóm s: Gồm các kim loại kiềm (nhóm I) và kiềm thổ (nhóm II). Kim loại ở nhóm s thường có tính khử mạnh và dễ mất electron để tạo thành ion dương.
- Nhóm d: Gồm các kim loại chuyển tiếp, như sắt (Fe), đồng (Cu) và kẽm (Zn). Những kim loại này thường có tính chất dẫn điện tốt, phản ứng linh hoạt, và có vai trò trong nhiều hợp chất phức.
- Nhóm f: Gồm các nguyên tố thuộc hai dãy lantanide và actinide. Các nguyên tố này thường có khả năng tạo thành hợp chất phức tạp và thể hiện tính phóng xạ.
Phi kim
Các phi kim nằm ở phía trên bên phải của bảng tuần hoàn, nơi các nguyên tố có độ âm điện cao và có xu hướng nhận electron, giúp chúng thể hiện tính chất oxy hóa mạnh.
Các nhóm nguyên tố
- Nhóm VIIA (halogen): Bao gồm các nguyên tố như flo (F), clo (Cl), brom (Br), iốt (I), là những phi kim hoạt động mạnh, thường tồn tại dưới dạng phân tử đôi và có tính chất oxy hóa mạnh.
- Nhóm VIA (chalcogen): Gồm các nguyên tố như oxy (O) và lưu huỳnh (S), thường đóng vai trò quan trọng trong các hợp chất hữu cơ và vô cơ nhờ khả năng tạo liên kết bền vững.
- Nhóm VIIIA (khí hiếm): Bao gồm heli (He), neon (Ne), argon (Ar), và các nguyên tố khác, là các phi kim không phản ứng vì có cấu hình electron bền vững, ít khi tham gia vào phản ứng hóa học.
Đặc điểm liên kết hóa học của kim loại và phi kim
Xem thêm: Kiến thức về liên kết hóa học
Kim loại
Kim loại chủ yếu tham gia vào liên kết kim loại, một dạng liên kết đặc trưng bởi “biển electron” – các electron hóa trị di chuyển tự do giữa các ion kim loại dương trong mạng tinh thể. Điều này giúp kim loại dẫn điện, dẫn nhiệt tốt và có độ dẻo dai.
Khi phản ứng với phi kim, kim loại thường dễ mất electron, tạo thành ion dương và hình thành liên kết ion. Đây là loại liên kết bền vững, giúp tạo nên nhiều hợp chất ion có cấu trúc tinh thể vững chắc, như NaCl (muối ăn).
Phi kim
Phi kim có xu hướng chia sẻ electron khi kết hợp với phi kim khác, dẫn đến sự hình thành liên kết cộng hóa trị. Ví dụ, khí oxy (O₂) và khí hydro (H₂) đều được hình thành từ liên kết cộng hóa trị, giúp các phân tử phi kim bền vững.
Khi phi kim phản ứng với kim loại, phi kim dễ dàng nhận electron từ kim loại để tạo thành ion âm, hình thành liên kết ion. Điều này giúp tạo nên các hợp chất ion như NaCl và MgO có tính chất điện ly cao khi tan trong nước.
Ứng dụng của kim loại và phi kim trong đời sống
Kim loại
Xây dựng và sản xuất: Kim loại như sắt, nhôm và đồng là vật liệu chủ yếu trong xây dựng, chế tạo máy móc và ngành công nghiệp sản xuất nhờ tính chất bền bỉ, dễ uốn và khả năng dẫn điện tốt.
Điện tử và cơ khí: Đồng và nhôm là hai kim loại quan trọng trong ngành điện tử do dẫn điện tốt và khả năng chống ăn mòn cao. Ngoài ra, titan và thép không gỉ thường dùng trong lĩnh vực hàng không, y tế và cơ khí.
Kim loại quý: Kim loại như vàng, bạc, và bạch kim được sử dụng rộng rãi trong ngành trang sức nhờ tính thẩm mỹ cao và độ bền. Ngoài ra, chúng còn có vai trò quan trọng trong các linh kiện công nghệ cao như vi mạch điện tử.
Phi kim
Sản xuất nhựa và hóa chất: Phi kim như lưu huỳnh, oxy, và clo được sử dụng rộng rãi trong ngành công nghiệp hóa chất, tạo nên các sản phẩm như nhựa, thuốc tẩy và hóa chất công nghiệp khác.
Dược phẩm và hóa học hữu cơ: Nhiều phi kim, đặc biệt là carbon, đóng vai trò quan trọng trong các hợp chất hữu cơ và là nền tảng của hóa học hữu cơ. Carbon là nguyên tố chính trong nhiều dược phẩm, nhiên liệu và vật liệu tổng hợp như than hoạt tính.
Phân loại các nhóm kim loại và phi kim
Việc phân loại kim loại và phi kim giúp chúng ta dễ dàng xác định tính chất hóa học, ứng dụng, cũng như các đặc điểm vật lý của từng nhóm trong bảng tuần hoàn. Dưới đây là cách phân loại các nhóm kim loại và phi kim phổ biến.
Các nhóm kim loại
Kim loại kiềm (nhóm I)
- Bao gồm: Liti (Li), Natri (Na), Kali (K), Rubidi (Rb), Xesi (Cs), Franxi (Fr).
- Đặc điểm: Tính khử mạnh, dễ dàng mất electron và phản ứng mãnh liệt với nước, tạo ra dung dịch kiềm và giải phóng khí hydro.
- Ứng dụng: Các kim loại kiềm thường được dùng trong sản xuất hóa chất, trong pin kiềm và trong chế tạo hợp kim.
Kim loại kiềm thổ (nhóm II)
- Bao gồm: Beri (Be), Magie (Mg), Canxi (Ca), Stronti (Sr), Bari (Ba), Radi (Ra).
- Đặc điểm: Tính khử mạnh, tuy nhiên yếu hơn kim loại kiềm. Các kim loại kiềm thổ phản ứng với nước chậm hơn và tạo ra dung dịch kiềm.
- Ứng dụng: Sử dụng rộng rãi trong xây dựng (vôi tôi CaO), sản xuất pháo hoa, và trong các hợp kim nhẹ.
Kim loại chuyển tiếp
- Bao gồm các nhóm từ 3 đến 12 trong bảng tuần hoàn.
- Đặc điểm: Có tính chất vật lý và hóa học đa dạng, thường có nhiều trạng thái oxy hóa khác nhau và tạo thành nhiều hợp chất màu sắc.
- Ứng dụng: Được sử dụng trong công nghệ luyện kim, điện tử và trong sản xuất trang sức (như bạch kim, vàng, bạc).

Kim loại quý
- Bao gồm: Vàng (Au), Bạc (Ag), Bạch kim (Pt) và một số kim loại nhóm platin.
- Đặc điểm: Ít bị oxy hóa, không dễ bị ăn mòn và thường có độ bóng cao.
- Ứng dụng: Chủ yếu dùng trong ngành trang sức, y học và công nghệ điện tử.
Các nhóm phi kim
Halogen (nhóm VII)
- Bao gồm: Flo (F), Clo (Cl), Brom (Br), Iot (I), Astatin (At).
- Đặc điểm: Tính chất oxy hóa mạnh, có khả năng nhận thêm một electron để đạt cấu hình bền vững. Các halogen phản ứng mạnh với kim loại để tạo thành muối halogenua.
- Ứng dụng: Sử dụng trong khử trùng, xử lý nước, và trong công nghiệp hóa học.
Khí hiếm (nhóm VIII hay nhóm 18)
- Bao gồm: Heli (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe), Radon (Rn).
- Đặc điểm: Tính trơ cao, không phản ứng dễ dàng với các nguyên tố khác. Các khí này thường tồn tại dưới dạng đơn nguyên tử.
- Ứng dụng: Thường được dùng trong đèn chiếu sáng, y học và trong các thiết bị khoa học.
Phi kim cơ bản
- Bao gồm: Carbon (C), Oxy (O), Lưu huỳnh (S), Photpho (P), Nitơ (N), Hydro (H).
- Đặc điểm: Có tính chất hóa học và vật lý phong phú, thường không dẫn điện, cách nhiệt và tạo thành hợp chất hữu cơ và vô cơ quan trọng.
- Ứng dụng: Sử dụng rộng rãi trong hóa học hữu cơ, công nghiệp thực phẩm, và nhiều lĩnh vực khác.

Bảng so sánh sự khác biệt giữa kim loại và phi kim
| Tiêu chí | Kim loại | Phi kim |
| Tính dẫn điện | Dẫn điện tốt (ví dụ: đồng, nhôm) | Không dẫn điện (ngoại trừ than chì) |
| Tính dẫn nhiệt | Dẫn nhiệt tốt | Không dẫn nhiệt |
| Màu sắc | Thường có màu trắng, xám, hoặc vàng | Thường có nhiều màu sắc đa dạng |
| Độ dẻo | Có độ dẻo, dễ kéo dài hoặc uốn cong | Giòn, dễ gãy |
| Độ bóng | Có ánh kim sáng | Không có ánh kim |
| Phản ứng hóa học | Thường là chất khử mạnh, dễ mất electron | Thường là chất oxy hóa, dễ nhận electron |
| Vị trí trong bảng tuần hoàn | Ở bên trái và trung tâm | Ở phía trên bên phải |
| Liên kết hóa học | Tham gia liên kết kim loại và ion | Tham gia liên kết cộng hóa trị và ion |
Việc phân biệt rõ kim loại và phi kim dựa trên tính chất hóa học và vật lý giúp chúng ta không chỉ hiểu sâu hơn về bảng tuần hoàn mà còn ứng dụng hiệu quả chúng trong đời sống. Từ khả năng dẫn điện của kim loại cho đến sự đa dạng màu sắc của phi kim, mỗi nguyên tố mang những đặc điểm riêng biệt để đóng góp vào sự đa dạng của tự nhiên. Với kiến thức này, chúng ta có thể khai thác, xử lý và sử dụng kim loại và phi kim một cách tối ưu trong các lĩnh vực khoa học và công nghiệp.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.







