Tại sao phải cân bằng hóa học? Cách cân bằng nhanh nhất
Trong lĩnh vực hóa học, cân bằng phương trình hóa học là một kỹ năng cơ bản cho phép bạn mô tả chính xác các phản ứng hóa học và hiểu các nguyên tắc cơ bản chi phối chúng.
Trong lĩnh vực hóa học, cân bằng phương trình hóa học là một kỹ năng cơ bản cho phép bạn mô tả chính xác các phản ứng hóa học và hiểu các nguyên tắc cơ bản chi phối chúng. Về bản chất, phương trình hóa học mô tả quá trình biến đổi chất phản ứng thành sản phẩm và điều quan trọng là phải đảm bảo số nguyên tử của mỗi nguyên tố không đổi trong suốt phản ứng. Khái niệm này, được gọi là định luật bảo toàn khối lượng, tạo thành nền tảng của việc cân bằng phương trình hóa học.
Phương trình hóa học là gì?
Phương trình hóa học là cách giải thích phản ứng hóa học bằng cách sử dụng các ký hiệu và phương trình cho các hóa chất tham gia vào quá trình. Một phương trình hóa học cân bằng có số lượng bằng nhau các nguyên tố khác nhau trong chất phản ứng và sản phẩm, trong khi một phương trình hóa học không cân bằng có số lượng không bằng nhau của một hoặc nhiều nguyên tố trong chất phản ứng và sản phẩm.
Các phương trình hóa học không cân bằng là không thể. Lý do cân bằng phương trình hóa học, cũng như phương pháp cân bằng phương trình hóa học, được thảo luận thêm bên dưới.
Cân bằng phương trình hóa học là như thế nào?
Cân bằng phương trình hóa học có nghĩa là đảm bảo số nguyên tử của mỗi nguyên tố là như nhau ở cả hai phía của phương trình, nghĩa là trước và sau phản ứng. Điều này giúp phản ánh chính xác sự bảo toàn khối lượng và năng lượng trong phản ứng hóa học.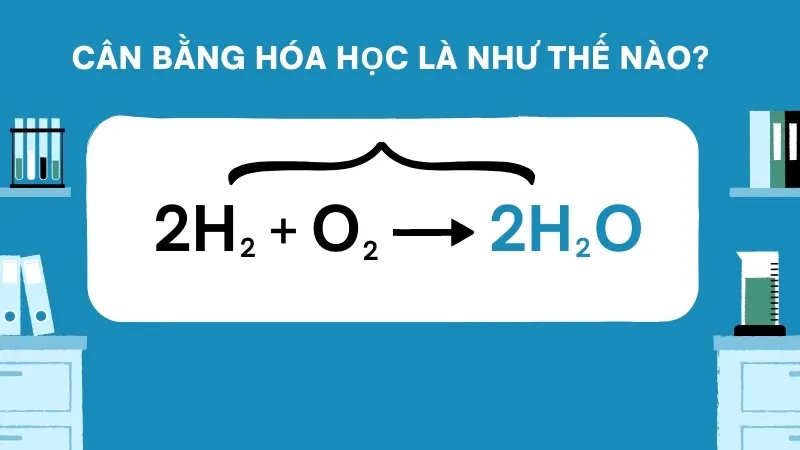
Hãy xem một ví dụ đơn giản:
2H₂ + O₂ → 2H₂O
Trong phương trình trên:
– H₂ là một phân tử hydro, trong đó mỗi phân tử có 2 nguyên tử hydro.
– O₂ là một phân tử oxy, cũng gồm 2 nguyên tử oxy.
– Khi hydro và oxy phản ứng, chúng tạo ra nước, được biểu diễn là H₂O.
Bây giờ, vì chúng ta có 2 phân tử H₂ ở vế trái, mỗi phân tử chứa 2 nguyên tử H, tổng cộng là 4 nguyên tử H tham gia phản ứng:
– 2 × H₂ = 4H (4 nguyên tử hydro)
Ở vế phải, 2 phân tử H₂O cũng chứa 4 nguyên tử H và 2 nguyên tử O. Kết quả là số lượng nguyên tử H và O đều bằng nhau ở cả hai phía của phương trình:
– (2 × 2) H + 2 O = 2 H₂O
Điều này giúp phản ứng được cân bằng và tuân theo nguyên tắc bảo toàn khối lượng.
Vì sao cần cân bằng phương trình hóa học?
Việc cân bằng phương trình hóa học giúp chúng ta biết chính xác tỷ lệ các nguyên tử và phân tử tham gia phản ứng và những gì tạo ra, điều này rất quan trọng để tính toán chính xác các chất cần thiết cho phản ứng.
Tại sao cần phải cân bằng phản ứng hóa học?
Theo định luật bảo toàn khối lượng , vật chất có thể chuyển từ dạng này sang dạng khác, hỗn hợp có thể được tách ra hoặc tạo ra, và các chất tinh khiết có thể bị phân hủy, nhưng tổng khối lượng vẫn không đổi.
Định luật quan trọng này cũng có thể được phát biểu theo cách khác rằng, trong những giới hạn có thể định lượng được, tổng khối lượng của vũ trụ là hằng số, bất cứ khi nào vật chất trải qua sự thay đổi, tổng khối lượng của các sản phẩm của sự thay đổi đó bằng tổng khối lượng của các chất phản ứng. Khối lượng của các sản phẩm trong phản ứng phải bằng khối lượng của các chất phản ứng, theo định luật bảo toàn khối lượng, do đó các phương trình phải được cân bằng để tuân thủ định luật này.
Vì định luật bảo toàn khối lượng nêu rằng vật chất không thể được tạo ra hoặc bị phá hủy, nên phương trình hóa học phải luôn được cân bằng . Điều này có nghĩa là tổng khối lượng của các chất phản ứng phải bằng khối lượng của các sản phẩm được tạo thành, tức là tổng số nguyên tử của mỗi nguyên tố phải bằng nhau ở cả hai vế của phương trình. Do đó, để thỏa mãn định luật bảo toàn khối lượng, các phản ứng hóa học phải được cân bằng.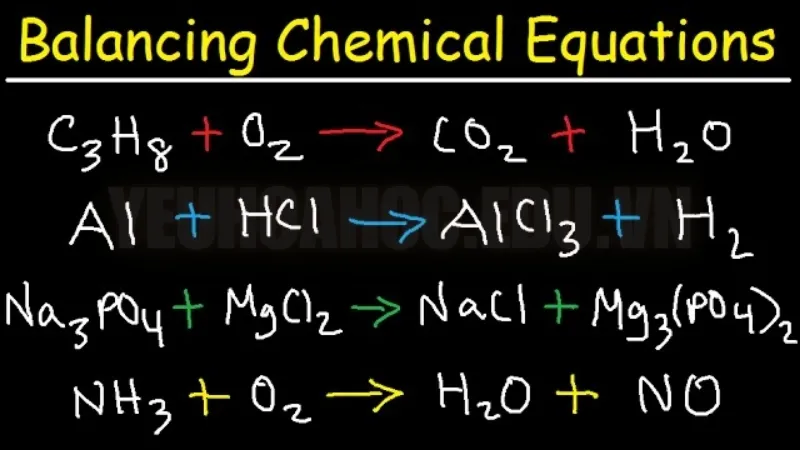
Cách cân bằng phương trình hóa học
Cân bằng phương trình hóa học là một bước quan trọng giúp xác định số lượng nguyên tử của mỗi nguyên tố trên cả hai vế của phương trình (phía chất phản ứng và phía sản phẩm) là như nhau. Dưới đây là các bước dễ hiểu để giúp bạn cân bằng một phương trình hóa học:
Xác định chất phản ứng và sản phẩm
– Chất phản ứng là các chất ban đầu tham gia vào phản ứng và thường nằm bên trái dấu mũi tên (→).
– Sản phẩm là các chất mới được tạo ra và nằm bên phải dấu mũi tên.
Ví dụ:
– Trong phương trình \( 2H_2 + O_2 → 2H_2O \), \( H_2 \) và \( O_2 \) là chất phản ứng, và \( H_2O \) là sản phẩm.
Đếm số nguyên tử của mỗi nguyên tố
Sau khi xác định chất phản ứng và sản phẩm, đếm số nguyên tử của mỗi nguyên tố ở cả hai phía của phương trình.
– Nhìn vào công thức hóa học của từng chất để biết số lượng nguyên tử.
– Các chỉ số nhỏ ở dưới trong công thức (ví dụ: số 2 trong \( H_2 \)) cho biết số nguyên tử của mỗi nguyên tố trong một phân tử.
Ví dụ:
– Trong \( CH_4 + 2O_2 → CO_2 + 2H_2O \):
– Bên trái: 1 nguyên tử C, 4 nguyên tử H, và 4 nguyên tử O.
– Bên phải: 1 nguyên tử C, 4 nguyên tử H, và 4 nguyên tử O.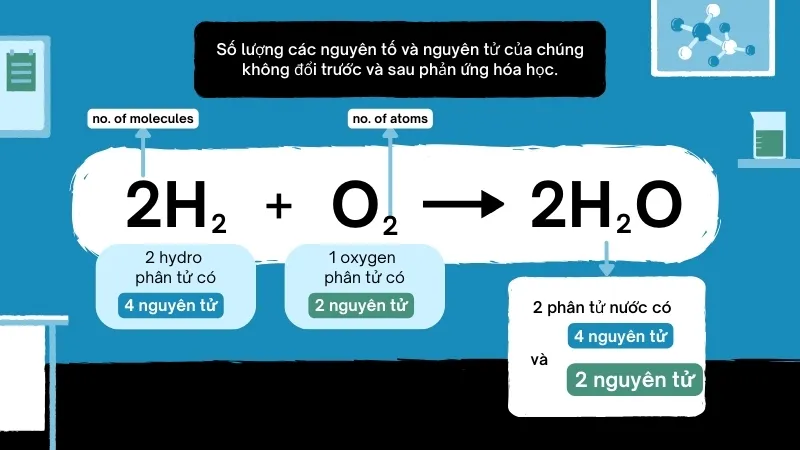
Điều chỉnh hệ số để cân bằng nguyên tử
Để cân bằng phương trình, hãy điều chỉnh các hệ số (số đứng trước công thức hóa học) để số nguyên tử của mỗi nguyên tố bằng nhau ở cả hai vế.
– Bắt đầu với các nguyên tố chỉ xuất hiện trong một hợp chất ở mỗi vế.
– Điều chỉnh từng nguyên tố cho đến khi cân bằng.
Ví dụ:
– Trong phương trình \( CH_4 + 2O_2 → CO_2 + 2H_2O \):
– Đặt hệ số \( 2 \) trước \( O_2 \) và \( H_2O \) để cân bằng số nguyên tử O và H.
Kiểm tra lại phương trình đã cân bằng
Sau khi điều chỉnh, hãy kiểm tra lại để chắc chắn rằng số nguyên tử của mỗi nguyên tố là như nhau ở cả hai phía.
Một số ví dụ cụ thể
– Ví dụ 1: Phương trình \( 2H_2 + O_2 → 2H_2O \)
– Bên trái: 4 nguyên tử H và 2 nguyên tử O.
– Bên phải: 4 nguyên tử H và 2 nguyên tử O.
– Phương trình này đã cân bằng.
– Ví dụ 2: Phương trình \( CH_4 + 2O_2 → CO_2 + 2H_2O \)
– Bên trái: 1 nguyên tử C, 4 nguyên tử H, và 4 nguyên tử O.
– Bên phải: 1 nguyên tử C, 4 nguyên tử H, và 4 nguyên tử O.
– Phương trình này đã cân bằng.
– Ví dụ 3: Phương trình \( 2Al + 3Cl_2 → 2AlCl_3 \)
– Bên trái: 2 nguyên tử Al và 6 nguyên tử Cl.
– Bên phải: 2 nguyên tử Al và 6 nguyên tử Cl.
– Phương trình này đã cân bằng.
Một số mẹo để cân bằng phương trình hóa học
– Bắt đầu với các nguyên tố xuất hiện ít hơn trong phương trình.
– Sử dụng hệ số nguyên nhỏ nhất để đảm bảo phương trình đơn giản nhất có thể.
– Luyện tập thường xuyên để tăng kỹ năng và sự thành thạo trong cân bằng phương trình.
Khi đã quen với các bước này, việc cân bằng phương trình hóa học sẽ trở nên dễ dàng và giúp bạn hiểu sâu hơn về phản ứng hóa học.
Cân bằng phản ứng oxy hóa khử (oxi hóa – khử)
Phản ứng oxy hóa khử là loại phản ứng hóa học trong đó các electron được chuyển giữa các nguyên tử hoặc ion. Do đó, để cân bằng phản ứng này, cần lưu ý đến sự chuyển đổi electron.
Xác định các phản ứng oxi hóa và khử
- Phản ứng oxi hóa là khi một nguyên tử hoặc ion mất electron.
- Phản ứng khử là khi một nguyên tử hoặc ion nhận electron.
Cân bằng riêng phản ứng oxi hóa và phản ứng khử
- Dùng phương pháp bán phản ứng (phân chia thành hai phần nhỏ hơn – một phần oxi hóa, một phần khử).
Kết hợp hai phản ứng
- Sau khi đã cân bằng các phản ứng oxi hóa và khử, kết hợp chúng lại để tạo thành phản ứng tổng thể
Ví dụ: Cân bằng phản ứng Zn + HCl → ZnCl₂ + H₂
- Xác định phản ứng oxi hóa và khử:
– Phản ứng oxi hóa: \( \text{Zn} \rightarrow \text{Zn}^{2+} + 2\text{e}^- \)
– Phản ứng khử: \( 2\text{H}^+ + 2\text{e}^- \rightarrow \text{H}_2 \)
- Cân bằng từng phản ứng:
– Phản ứng oxi hóa: \( \text{Zn} \rightarrow \text{Zn}^{2+} + 2\text{e}^- \)
– Phản ứng khử: \( 2\text{H}^+ + 2\text{e}^- \rightarrow \text{H}_2 \)
- Kết hợp lại để tạo thành phản ứng tổng thể:
– Phản ứng cân bằng: \( \text{Zn} + 2\text{HCl} \rightarrow \text{ZnCl}_2 + \text{H}_2 \)
Bằng cách làm theo các bước này và chú ý đến sự chuyển electron trong phản ứng oxi hóa khử, bạn có thể dễ dàng cân bằng phản ứng một cách chính xác.
Cân bằng phương trình ion
Các ion là các nguyên tử hoặc phân tử mang điện tích do có sự thừa hoặc thiếu electron. Khi cân bằng phương trình ion, quy tắc cân bằng vẫn áp dụng như với phương trình phân tử, nhưng chúng ta cần chú ý đến các ion có mặt trong phản ứng.
Mọi phản ứng hóa học đều liên quan đến sự trao đổi electron, làm cho các nguyên tử và phân tử trở thành ion để phản ứng và tạo ra hợp chất mới. Cần nhớ rằng, phản ứng hóa học chỉ tạo ra các hợp chất mới bằng cách thay đổi cấu trúc của các nguyên tử có sẵn, chứ không tạo ra nguyên tử mới.
Ví dụ về cân bằng phương trình ion
Giả sử trộn hai dung dịch nước gồm canxi clorua (CaCl₂) và bạc nitrat (AgNO₃). Phương trình hóa học phân tử cho phản ứng này là:
\(\text{CaCl₂ (aq) + 2 AgNO₃ (aq) → Ca(NO₃)₂ (aq) + 2 AgCl (s)}\)
Phương trình này mô tả các chất ban đầu và sản phẩm cuối, nhưng thực tế trong dung dịch nước, các hợp chất tan ra thành ion như sau:
– CaCl₂ (aq) → Ca²⁺ (aq) + 2 Cl⁻ (aq)
– 2 AgNO₃ (aq) → 2 Ag⁺ (aq) + 2 NO₃⁻ (aq)
– Ca(NO₃)₂ (aq) → Ca²⁺ (aq) + 2 NO₃⁻ (aq)
Khi viết phương trình ion hoàn chỉnh, chúng ta có:
\(\text{Ca²⁺ (aq) + 2 Cl⁻ (aq) + 2 Ag⁺ (aq) + 2 NO₃⁻ (aq) → Ca²⁺ (aq) + 2 NO₃⁻ (aq) + 2 AgCl (s)}\)
Ở đây, ion Ca²⁺ và NO₃⁻ không thay đổi và được gọi là các ion khán giả vì chúng không tham gia trực tiếp vào phản ứng. Các ion Ag⁺ và Cl⁻ kết hợp để tạo ra bạc clorua (AgCl), là sản phẩm không tan trong nước và xuất hiện dưới dạng kết tủa.
Phản ứng axit-bazơ và cân bằng ion
Phản ứng axit-bazơ là một trong những loại phản ứng hóa học phổ biến, trong đó axit giải phóng các ion hydro dương (H⁺) và bazơ giải phóng các ion hydroxide âm (OH⁻). Khi axit và bazơ phản ứng với nhau, chúng trung hòa lẫn nhau, tạo ra muối và nước.
Ví dụ: khi canxi hydroxit (Mg(OH)₂) phản ứng với axit clohydric (HCl) trong dạ dày:
\(\text{Mg(OH)₂ + 2HCl → MgCl₂ + 2H₂O}\)
Phản ứng này tạo ra muối MgCl₂ và nước, giúp giảm nồng độ axit trong dạ dày. Đây là cách hoạt động của thuốc kháng axit.
Luyện tập cân bằng phương trình ion
Việc luyện tập cân bằng phương trình ion là rất quan trọng để làm quen với việc xử lý các phản ứng phức tạp như oxy hóa-khử và axit-bazơ. Thực hành cân bằng các phương trình này thường xuyên sẽ giúp bạn hiểu rõ hơn về các phản ứng hóa học và ý nghĩa của chúng trong tự nhiên và cuộc sống hàng ngày.
Cân bằng phương trình hóa học là một kỹ năng cơ bản trong hóa học cho phép chúng ta biểu diễn chính xác các phản ứng hóa học và hiểu các nguyên tắc cơ bản chi phối chúng. Bằng cách tuân theo phương pháp tiếp cận có hệ thống và chú ý đến số nguyên tử của mỗi nguyên tố và điện tích tổng thể, chúng ta có thể cân bằng phương trình hóa học và có được những hiểu biết có giá trị về thành phần hóa học và năng lượng của các phản ứng hóa học.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.