Lực nội phân tử là gì? Hiểu về liên kết bền vững trong hóa học
Lực nội phân tử là những lực giúp kết nối các nguyên tử trong một phân tử lại với nhau, đóng vai trò quan trọng trong việc quyết định tính chất và cách thức hoạt động của các hợp chất hóa học.
Lực nội phân tử là những lực giúp kết nối các nguyên tử trong một phân tử lại với nhau, đóng vai trò quan trọng trong việc quyết định tính chất và cách thức hoạt động của các hợp chất hóa học. Đây là các liên kết cộng hóa trị, ion hoặc kim loại, tùy thuộc vào cách các electron được chia sẻ hay trao đổi giữa các nguyên tử. Lực nội phân tử không chỉ đảm bảo cấu trúc bền vững cho phân tử mà còn ảnh hưởng trực tiếp đến khả năng phản ứng và ứng dụng của nó trong các ngành công nghiệp, y học và nghiên cứu khoa học.
Lực nội phân tử là gì
Lực nội phân tử, còn được gọi là tương tác nội phân tử, là lực phát sinh bên trong một phân tử. Đây là lực chịu trách nhiệm giữ các nguyên tử lại với nhau trong một phân tử.
Độ dẫn điện và độ hòa tan của các chất khi có dung môi và các tính chất vật lý của kim loại phụ thuộc vào lực nội phân tử. Sự khác biệt giữa lực nội phân tử và lực liên phân tử là lực trước xảy ra giữa các nguyên tử trong một phân tử, và lực sau xảy ra giữa hai phân tử.
Liên kết hóa học là lực nội phân tử. Nó giữ cho phân tử ổn định bằng cách giữ các nguyên tử lại với nhau. Ví dụ, nước (H2O) có hai nguyên tử hydro liên kết với một nguyên tử oxy bằng hai liên kết cộng hóa trị đơn. Do đó, lực hấp dẫn xảy ra giữa mỗi nguyên tử hydro với oxy.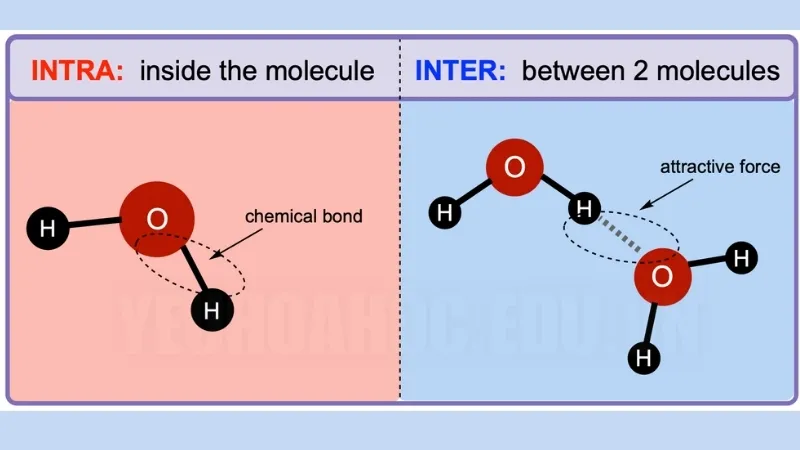
Các loại lực nội phân tử
Các lực nội phân tử bao gồm
Liên kết ion: Là do lực hút giữa các ion. Các ion được hình thành khi một nguyên tử mất hoặc nhận thêm electron. Liên kết ion được hình thành giữa một kim loại và một phi kim, trong đó kim loại mất electron và phi kim nhận thêm electron.
Ví dụ: Natri clorua (NaCl), kali iodua (KI) và magie oxit (MgO)
Liên kết cộng hóa trị: Là do sự chia sẻ electron giữa hai nguyên tử. Các nguyên tử chia sẻ electron ngoài cùng hoặc electron hóa trị của chúng để thực hiện quy tắc octet và tạo thành liên kết. Một loại liên kết như vậy xảy ra giữa hai phi kim. Liên kết cộng hóa trị là lực mạnh nhất trong tất cả các lực nội phân tử và là liên kết hóa học phổ biến nhất trong các sinh vật sống.
Ví dụ: Nước (H2O), carbon dioxide (CO2 ) và amoniac (NH3 )
Liên kết kim loại: Một lực giữ các nguyên tử lại với nhau trong kim loại. Các lớp electron ngoài cùng (orbital nguyên tử) của mỗi nguyên tử kim loại chồng lên nhiều nguyên tử lân cận. Kết quả là, các electron hóa trị di chuyển tự do từ nguyên tử này sang nguyên tử khác, dẫn đến lực hút giữa đám mây electron và hạt nhân tích điện dương.
Ví dụ: Natri (Na), kali (K) và vàng (Au)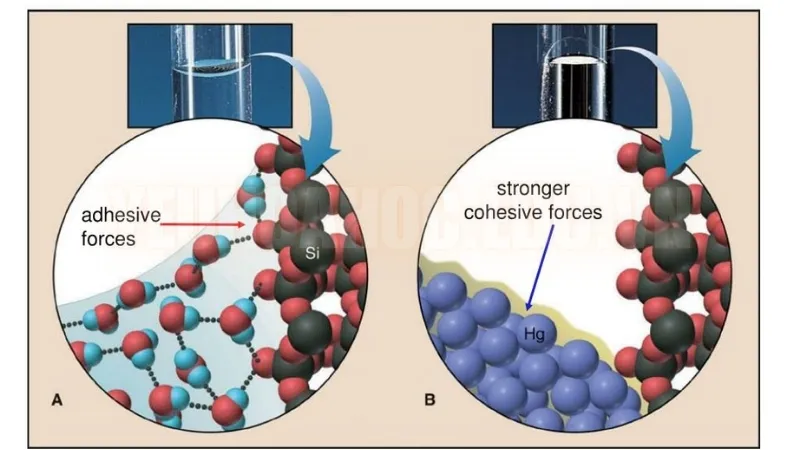
Tác động của lực nội phân tử lên phản ứng hóa học
Lực nội phân tử là những lực giúp giữ các nguyên tử trong một phân tử lại với nhau và có vai trò quan trọng trong việc ảnh hưởng đến tính chất và phản ứng của phân tử đó. Có ba loại chính của các liên kết nội phân tử, gồm liên kết cộng hóa trị, liên kết ion, và liên kết kim loại. Mỗi loại liên kết này khác nhau về cách các nguyên tử hoặc ion chia sẻ hoặc chuyển electron giữa chúng để duy trì sự ổn định của phân tử.
Ảnh hưởng đến khả năng phản ứng
Các lực nội phân tử quyết định khả năng phản ứng của một phân tử, tức là phân tử đó có dễ phản ứng hay không. Ví dụ, những phân tử có liên kết cộng hóa trị mạnh thường ổn định hơn và khó phản ứng hơn, vì phá vỡ các liên kết này đòi hỏi một lượng lớn năng lượng. Ngược lại, các phân tử có liên kết yếu hơn dễ dàng tham gia vào các phản ứng, vì chúng cần ít năng lượng hơn để phá vỡ liên kết.
Vai trò trong cơ chế phản ứng
Các lực nội phân tử ảnh hưởng đến cách các phản ứng diễn ra, hay cơ chế phản ứng. Đặc biệt trong hóa học hữu cơ, cách mà các nhóm nguyên tử chức năng trong một phân tử tương tác với nhau có thể giúp các nhà hóa học dự đoán cách phản ứng xảy ra và lên kế hoạch tổng hợp các hợp chất mới.
Cấu trúc lập thể
Lực nội phân tử quyết định sự sắp xếp không gian của các nguyên tử trong phân tử, gọi là cấu trúc lập thể. Cấu trúc này ảnh hưởng lớn đến tính chất và hoạt tính của phân tử, đặc biệt là trong thiết kế thuốc. Sự sắp xếp của các nguyên tử có thể quyết định cách phân tử tương tác với các mục tiêu trong cơ thể.
Thay đổi cấu hình
Lực nội phân tử cũng ảnh hưởng đến khả năng thay đổi cấu hình, ví dụ như sự quay hay uốn cong của các liên kết trong một phân tử mà không làm mất đi sự liên kết giữa các nguyên tử. Điều này giúp các phân tử có tính linh hoạt, thích ứng với các môi trường khác nhau, đặc biệt là khi tham gia vào các phản ứng hóa học.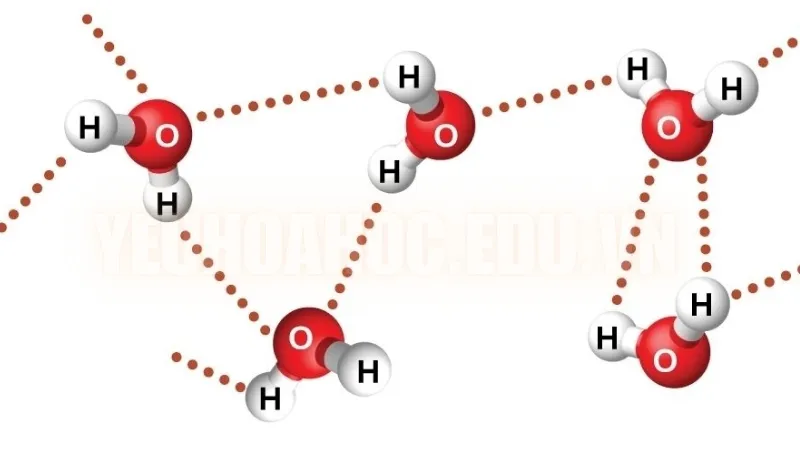
Ứng dụng và tầm quan trọng của lực nội phân tử
Lực nội phân tử, còn được gọi là liên kết hóa học, đóng vai trò quan trọng trong việc định hình thế giới xung quanh chúng ta. Các lực này chịu trách nhiệm giữ các nguyên tử lại với nhau trong phân tử, xác định cấu trúc và tính chất của chúng. Từ không khí chúng ta hít thở đến thức ăn chúng ta ăn, các lực nội phân tử hoạt động theo vô số cách, khiến chúng trở thành một khía cạnh thiết yếu trong cuộc sống hàng ngày của chúng ta.
Tính ổn định và cấu trúc
Các lực nội phân tử cung cấp tính ổn định cho các phân tử bằng cách giữ các nguyên tử cấu thành của chúng lại với nhau.
Ví dụ, liên kết cộng hóa trị liên quan đến việc chia sẻ electron giữa các nguyên tử, tạo ra một liên kết mạnh giúp giữ cho phân tử nguyên vẹn. Tính ổn định này rất quan trọng đối với sự hình thành các cấu trúc phức tạp có trong tự nhiên, chẳng hạn như chuỗi xoắn kép DNA hoặc protein có các mẫu gấp phức tạp.
Tính chất vật lý
Loại và cường độ của các lực trong phân tử ảnh hưởng rất lớn đến tính chất vật lý của các chất. Ví dụ, liên kết ion dẫn đến sự hình thành các tinh thể có điểm nóng chảy cao do lực hút tĩnh điện mạnh giữa các ion tích điện trái dấu. Mặt khác, các lực liên phân tử yếu hơn như lực phân tán London góp phần làm cho điểm sôi thấp của các phân tử không phân cực như mêtan.
Độ hòa tan và hòa tan
Các lực nội phân tử cũng tác động đến quá trình hòa tan và hòa tan. Các phân tử phân cực có xu hướng hòa tan trong dung môi phân cực do lực hấp dẫn giữa các đầu dương và âm của chúng. Khả năng hòa tan nhiều chất của nước là do khả năng liên kết hydro mạnh, cho phép nó tương tác với nhiều hợp chất.
Phản ứng sinh học
Trong các sinh vật sống, các lực nội phân tử là cơ bản cho nhiều quá trình sinh học khác nhau. Enzym dựa vào các tương tác cụ thể giữa các vị trí hoạt động và chất nền của chúng thông qua liên kết hydro hoặc các loại liên kết hóa học khác. Những tương tác này tạo điều kiện cho các phản ứng sinh hóa cần thiết cho quá trình trao đổi chất, tiêu hóa và các chức năng quan trọng khác.
Thiết kế thuốc và hóa học dược phẩm
Hiểu được các lực nội phân tử là rất quan trọng trong thiết kế thuốc và hóa học dược phẩm. Các nhà khoa học phân tích cách thuốc tương tác với các phân tử mục tiêu trong cơ thể, xem xét các yếu tố như liên kết hydro, lực van der Waals và tương tác tĩnh điện.
Bằng cách điều khiển các lực này, các nhà nghiên cứu có thể tối ưu hóa hiệu quả của thuốc và giảm thiểu tác dụng phụ.
Khoa học vật liệu và kỹ thuật
Các lực nội phân tử rất cần thiết trong các ứng dụng khoa học vật liệu và kỹ thuật. Ví dụ, việc phát triển các loại polyme mới dựa trên việc kiểm soát độ bền và sự sắp xếp của các liên kết hóa học trong các chuỗi polyme.
Điều này cho phép các kỹ sư tùy chỉnh các vật liệu có các đặc tính cụ thể như độ mềm dẻo, độ bền hoặc khả năng chịu nhiệt cho nhiều ứng dụng khác nhau, từ vật liệu đóng gói đến các thành phần hàng không vũ trụ.
Nhìn chung, lực nội phân tử là yếu tố thiết yếu tạo nên đặc điểm và hành vi của các phân tử trong các phản ứng hóa học và sinh học. Sự hiểu biết sâu sắc về lực này giúp các nhà khoa học và kỹ sư phát triển những ứng dụng mới từ việc tổng hợp hợp chất đến thiết kế thuốc và vật liệu tiên tiến, đóng góp vào nhiều lĩnh vực từ công nghệ đến chăm sóc sức khỏe.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.