Nhiệt động lực hóa học là gì? Định luật nhiệt động lực học
Nhiệt động lực học hóa học đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ, bao gồm khoa học vật liệu, hóa sinh, khoa học môi trường và dược phẩm.
Nhiệt động lực học hóa học đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ, bao gồm khoa học vật liệu, hóa sinh, khoa học môi trường và dược phẩm. Các nguyên lý của nó được sử dụng để thiết kế và tối ưu hóa các quy trình hóa học, phát triển vật liệu mới có các đặc tính mong muốn và hiểu được hành vi của các hệ thống sinh học.
Nhiệt động lực học hóa học là gì?
Nhiệt động lực học hóa học là lĩnh vực nghiên cứu sự chuyển đổi năng lượng trong các phản ứng hóa học và các quá trình vật lý. Không chỉ giới hạn ở các phản ứng trong phòng thí nghiệm, nhiệt động lực học hóa học còn giải thích cách năng lượng biến đổi trong các sự kiện hàng ngày, như băng tan thành nước.
Phần lớn nghiên cứu nhiệt động lực học này tập trung vào năng lượng nhiệt – năng lượng chuyển động của các hạt – và cách nó ảnh hưởng đến cấu trúc và hành vi của các chất hóa học.
Năng lượng trong Nhiệt động lực học
Năng lượng, khái niệm cốt lõi trong nhiệt động lực học, là khả năng thực hiện công việc hoặc truyền nhiệt. Nó bao gồm:
- Động năng: Là năng lượng của các hạt chuyển động, như các phân tử nước trong nước sôi.
- Thế năng: Là năng lượng lưu trữ của một vật thể, thường dựa trên vị trí hoặc cấu trúc của nó, chẳng hạn như năng lượng tiềm tàng trong một phân tử trước khi xảy ra phản ứng.
Mỗi phản ứng hóa học đều liên quan đến sự thay đổi năng lượng. Ví dụ, năng lượng hóa học được lưu trữ trong các liên kết của phân tử, và khi những liên kết này bị phá vỡ hoặc hình thành, năng lượng sẽ được giải phóng hoặc hấp thụ. Một trong những mục tiêu của nhiệt động lực học hóa học là hiểu được những thay đổi năng lượng này và cách chúng ảnh hưởng đến tốc độ phản ứng hoặc sự ổn định của các chất trong phản ứng.
Khái niệm về Hệ thống
Trong nghiên cứu nhiệt động lực học, “hệ thống” là thuật ngữ chỉ tập hợp các chất hoặc năng lượng mà chúng ta quan sát. Một hệ thống có thể là bất cứ thứ gì từ một phản ứng hóa học trong ống nghiệm đến một cái cây thực hiện quá trình quang hợp. Dựa trên khả năng trao đổi năng lượng và vật chất với môi trường xung quanh, hệ thống được phân loại thành:
- Hệ thống mở: Có thể trao đổi cả năng lượng và vật chất với môi trường. Ví dụ, một cốc nước có thể trao đổi hơi nước với không khí xung quanh.
- Hệ thống đóng: Chỉ trao đổi năng lượng nhưng không trao đổi vật chất với môi trường. Một bình kín chứa chất lỏng có thể là hệ thống đóng nếu nó trao đổi nhiệt nhưng không để chất lỏng thoát ra ngoài.
- Hệ thống cô lập: Không trao đổi bất kỳ thứ gì với môi trường xung quanh. Một cái bình giữ nhiệt kín là một ví dụ của hệ thống cô lập, vì nó ngăn cả nhiệt và vật chất thoát ra.

Tại sao nhiệt động lực học hóa học quan trọng?
Hiểu về nhiệt động lực học giúp các nhà hóa học dự đoán xem một phản ứng có xảy ra không, nó sẽ diễn ra nhanh như thế nào và năng lượng sẽ được tiêu hao hay giải phóng. Ví dụ, dựa trên nhiệt động lực học, chúng ta biết rằng quá trình hòa tan đường trong nước ấm sẽ xảy ra nhanh hơn so với trong nước lạnh vì năng lượng nhiệt cao hơn giúp phá vỡ liên kết trong phân tử đường nhanh chóng hơn.
Nhờ nhiệt động lực học hóa học, các nhà khoa học và kỹ sư có thể tính toán chính xác lượng năng lượng cần thiết cho các quy trình công nghiệp, điều chỉnh các phản ứng hóa học để sản xuất sản phẩm mong muốn, và thậm chí hiểu được các hiện tượng tự nhiên.
Định luật nhiệt động lực học
Định luật thứ nhất
Đây là định luật bảo toàn năng lượng, nói rằng năng lượng không thể được tạo ra hay phá hủy mà chỉ có thể chuyển đổi từ dạng này sang dạng khác. Trong các hệ thống hóa học, định luật này cho thấy rằng năng lượng nhiệt trong một phản ứng có thể chuyển thành các dạng năng lượng khác, chẳng hạn như năng lượng liên kết hoặc năng lượng điện. Để đo lượng nhiệt này, chúng ta dùng enthalpy, thường biểu thị bằng đơn vị kJ/mol.
Định luật thứ hai
Định luật này cho biết các hệ thống có xu hướng tăng mức độ hỗn loạn (entropy). Nghĩa là, năng lượng không được chuyển đổi hoàn toàn thành năng lượng “hữu ích” – luôn có một phần bị phân tán. Trong các hệ thống hóa học, entropy biểu thị mức độ hỗn loạn của các phân tử, đo bằng J/(mol·K). Khi một phản ứng có entropy cao, nó có xu hướng xảy ra tự nhiên vì sự hỗn loạn hoặc phân tán năng lượng được tăng cường.
Định luật thứ ba
Định luật thứ ba của nhiệt động lực học nêu rằng khi nhiệt độ của một hệ thống tiến tới độ không tuyệt đối (0 Kelvin hoặc -273,15 độ C), entropy của hệ thống cũng tiến tới độ không. Định luật này cung cấp một điểm tham chiếu để đo entropy tuyệt đối của các chất.
Độ không tuyệt đối là nhiệt độ thấp nhất có thể, tại đó mọi chuyển động phân tử đều dừng lại. Ở nhiệt độ này, entropy của một chất tinh thể hoàn toàn có trật tự sẽ bằng không. Tuy nhiên, không thể đạt được độ không tuyệt đối trong thực tế, vì điều này đòi hỏi phải loại bỏ toàn bộ năng lượng khỏi hệ thống.
Định luật thứ ba của nhiệt động lực học đặc biệt quan trọng trong nghiên cứu vật liệu ở nhiệt độ rất thấp, chẳng hạn như siêu dẫn và siêu lỏng. Nó cho phép các nhà khoa học xác định entropy tuyệt đối của các chất và hiểu được hành vi của chúng ở điều kiện khắc nghiệt.
Quá trình cân bằng và không cân bằng
Khi một hệ thống hóa học thay đổi, nó có thể làm như vậy theo các điều kiện cân bằng hoặc không cân bằng:
Quá trình cân bằng (hay bán tĩnh)
Đây là những quá trình diễn ra rất chậm, đủ để mỗi trạng thái nhỏ của hệ thống có thể đạt đến cân bằng trước khi chuyển sang trạng thái tiếp theo. Điều này đảm bảo rằng các thay đổi về nhiệt độ, áp suất, và các yếu tố khác xảy ra rất từ từ, cho phép hệ thống thích nghi hoàn toàn.
Các đặc điểm của quá trình cân bằng bao gồm:
- Sự khác biệt rất nhỏ giữa các lực bên trong và bên ngoài (ví dụ, áp suất hoặc nhiệt độ).
- Diễn ra chậm đến mức có thể kiểm soát.
- Cho phép công thực hiện tối đa, đồng thời hướng ngược của quá trình có thể dễ dàng đảo ngược chỉ bằng một thay đổi nhỏ của lực.
Vì vậy, trong quá trình thuận và ngược, công suất thực hiện là như nhau.
Quá trình không cân bằng
Quá trình không cân bằng là khi hệ thống không đạt đến một trạng thái cân bằng trước khi thay đổi sang trạng thái mới. Quá trình này diễn ra nhanh và không tạo điều kiện để hệ thống ổn định giữa các giai đoạn chuyển tiếp.
Sự thư giãn là quá trình đưa hệ thống từ trạng thái không cân bằng về cân bằng, và “thời gian thư giãn” là khoảng thời gian để đạt đến cân bằng. Trong các hệ thống phức tạp, sự thư giãn có thể bị ảnh hưởng bởi nhiều yếu tố và năng lượng mới liên tục có thể làm cho hệ thống không cân bằng kéo dài.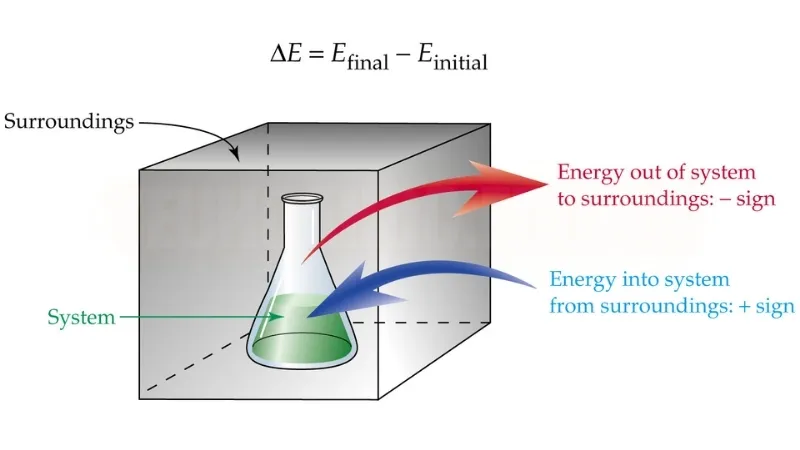
Quá trình thuận nghịch và không thuận nghịch
Quá trình thuận nghịch là quá trình chuyển đổi có thể diễn ra theo cả hai hướng – thuận và ngược – mà không làm thay đổi môi trường xung quanh. Trong các quá trình thuận nghịch, hệ thống có thể quay lại trạng thái ban đầu mà không cần thực hiện thêm công hay tạo thêm năng lượng, tức là có thể đảo ngược hoàn toàn. Điều này thường xảy ra trong các điều kiện rất kiểm soát, như khi hai hệ thống có cùng nhiệt độ trao đổi nhiệt với nhau.
Quá trình không thuận nghịch là quá trình một chiều, không thể đảo ngược mà không gây ra thay đổi cho môi trường. Những thay đổi này thường tạo ra các biến đổi hoặc tổn thất năng lượng trong hệ thống. Các ví dụ phổ biến về quá trình không thuận nghịch bao gồm:
- Truyền nhiệt qua sự chênh lệch nhiệt độ lớn: Khi nhiệt chuyển từ một vật nóng sang một vật lạnh, không có cách nào để chuyển ngược lại mà không cần bổ sung năng lượng.
- Sự giãn nở của khí vào chân không: Nếu một khí giãn nở vào một không gian trống, nó không thực hiện công và không thể tự quay trở lại trạng thái ban đầu.
- Sự khuếch tán: Khi hai khí trộn lẫn nhau, chúng sẽ không thể tự tách ra nếu không có năng lượng hoặc công bên ngoài.

Ứng dụng của nhiệt động lực học hóa học
Nhiệt động lực học hóa học có nhiều ứng dụng thực tế trong nhiều lĩnh vực, bao gồm
Phản ứng hóa học
Bằng cách hiểu nhiệt động lực học của các phản ứng hóa học, chúng ta có thể dự đoán tính khả thi và tính tự phát của các phản ứng. Kiến thức này rất quan trọng để thiết kế và tối ưu hóa các quy trình hóa học trong các ngành công nghiệp như dược phẩm, hóa dầu và khoa học vật liệu.
Ví dụ, trong ngành dược phẩm, nhiệt động lực học giúp xác định các điều kiện tối ưu để tổng hợp thuốc, đảm bảo năng suất và độ tinh khiết cao. Nó cũng hỗ trợ trong việc phát triển các chất xúc tác có thể làm tăng tốc độ phản ứng và giảm mức tiêu thụ năng lượng.
Chuyển pha
Nhiệt động lực học hóa học cũng đóng vai trò quan trọng trong việc nghiên cứu các quá trình chuyển pha, chẳng hạn như nóng chảy, sôi và ngưng tụ. Bằng cách phân tích các thay đổi về enthalpy, entropy và năng lượng tự do Gibbs, chúng ta có thể xác định các điều kiện mà quá trình chuyển pha xảy ra và dự đoán tính ổn định của các pha khác nhau. Kiến thức này rất cần thiết trong các lĩnh vực như khoa học vật liệu và kỹ thuật, nơi mà việc hiểu được hành vi của vật liệu ở các nhiệt độ và áp suất khác nhau là rất quan trọng.
Ví dụ, trong ngành hàng không vũ trụ, nhiệt động lực học giúp thiết kế và thử nghiệm các vật liệu có thể chịu được các điều kiện khắc nghiệt, chẳng hạn như nhiệt độ cao trong quá trình tái xâm nhập vào khí quyển Trái đất.
Lưu trữ và chuyển đổi năng lượng
Nhiệt động lực học hóa học cung cấp thông tin chi tiết về các hệ thống lưu trữ và chuyển đổi năng lượng, chẳng hạn như pin và pin nhiên liệu. Bằng cách hiểu nhiệt động lực học của các phản ứng điện hóa, chúng ta có thể cải thiện hiệu suất và hiệu suất của các thiết bị này.
Ví dụ, trong lĩnh vực năng lượng tái tạo, nhiệt động lực học giúp phát triển các pin mặt trời hiệu quả hơn bằng cách tối ưu hóa các quy trình chuyển đổi năng lượng. Nó cũng hỗ trợ trong việc thiết kế các loại pin tiên tiến với mật độ năng lượng cao hơn và tuổi thọ dài hơn, giải quyết nhu cầu ngày càng tăng đối với các giải pháp lưu trữ năng lượng bền vững.
Hóa học môi trường
Nhiệt động lực học hóa học giúp chúng ta hiểu được hành vi của các chất ô nhiễm trong môi trường và tác động của chúng lên hệ sinh thái. Bằng cách phân tích các đặc tính nhiệt động lực học, chúng ta có thể dự đoán số phận và quá trình vận chuyển của các chất ô nhiễm và phát triển các chiến lược phục hồi môi trường.
Ví dụ, trong lĩnh vực xử lý nước, nhiệt động lực học được sử dụng để nghiên cứu việc loại bỏ các chất ô nhiễm khỏi nước thải, đảm bảo nguồn cung cấp nước sạch và an toàn. Nó cũng giúp đánh giá các rủi ro môi trường liên quan đến việc giải phóng các chất ô nhiễm, hướng dẫn các quyết định và chính sách quản lý nhằm bảo vệ môi trường.
Tóm lại, nhiệt động lực học hóa học là một ngành học cơ bản với nhiều ứng dụng. Những hiểu biết sâu sắc và nguyên lý của nó rất cần thiết để thúc đẩy nhiều lĩnh vực khác nhau, từ các quy trình công nghiệp đến công nghệ năng lượng và bảo vệ môi trường.
Bằng cách khai thác sức mạnh của nhiệt động lực học, các nhà khoa học và kỹ sư có thể phát triển các giải pháp sáng tạo cho những thách thức phức tạp và đóng góp vào sự phát triển bền vững của xã hội chúng ta.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.