Nguyên tố Rubiđi: Khái niệm, tính chất và ứng dụng
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Rubiđi, từ phát hiện lịch sử đến các ứng dụng trong cuộc sống hàng ngày.
Rubiđi là một nguyên tố kim loại mềm trong nhóm kim loại kiềm. Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố hấp dẫn này, từ phát hiện lịch sử đến các ứng dụng thú vị trong cuộc sống hàng ngày và công nghệ.
Giới thiệu về nguyên tố Rubiđi
Định nghĩa
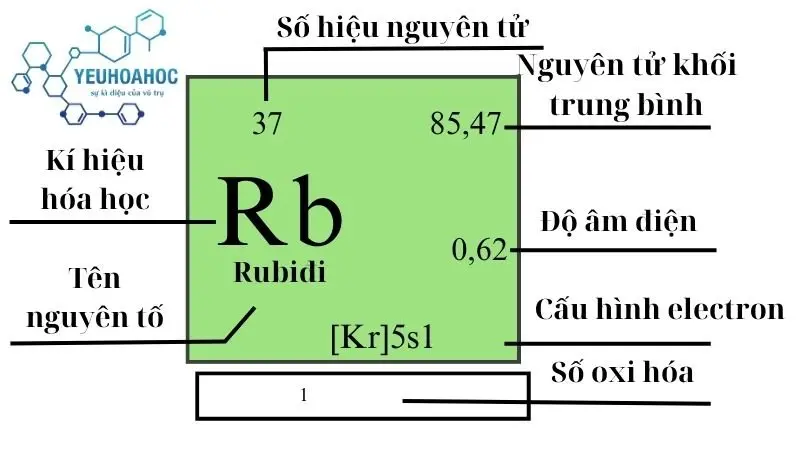
Rubiđi, với tên tiếng Anh là “Rubidium” và ký hiệu hóa học là Rb, là nguyên tố hóa học có số nguyên tử là 37. Thuộc nhóm kim loại kiềm trong bảng tuần hoàn, Rubiđi được biết đến với tính chất mềm, dễ uốn và có màu trắng bạc.
Lịch sử hình thành nguyên tố
- Phát hiện: Rubiđi được phát hiện vào năm 1861 bởi nhà khoa học người Đức Robert Bunsen và Gustav Kirchhoff thông qua kỹ thuật phổ phân tích mới được phát triển. Sự phát hiện này là kết quả của việc quan sát các dải màu đặc trưng trong phổ phát xạ của nó.
- Nguồn gốc tên gọi: Tên “Rubidium” bắt nguồn từ từ Latinh “rubidus”, có nghĩa là “đậm màu nhất”, ám chỉ dải màu đỏ tươi trong phổ phát xạ của nó.
Một số mốc quan trọng trong lịch sử phát hiện
1861: Robert Bunsen và Gustav Kirchhoff phát hiện ra Rubiđi bằng phương pháp quang phổ.
1928: Lithium rubidi được sử dụng lần đầu tiên trong pin.
1950: Rubiđi được sử dụng trong các đồng hồ nguyên tử.
1960: Rubiđi được sử dụng trong các thiết bị laser.
Tầm quan trọng của nguyên tố Rubiđi trong đời sống
- Dùng trong pin rubiđi-chlorine, cung cấp năng lượng cho các thiết bị như máy tạo nhịp tim và máy trợ thính.
- Dùng trong đồng hồ nguyên tử, là tiêu chuẩn thời gian quốc tế.
- Dùng trong các thiết bị laser, có ứng dụng trong y học, công nghiệp và khoa học.
- Dùng trong nghiên cứu khoa học, ví dụ như nghiên cứu về cấu tạo nguyên tử và phân tử.
Nguyên tố Rubiđi trong bảng tuần hoàn hóa học
- Thuộc nhóm IA (kim loại kiềm)
- Chu kỳ 5
- Khối lượng nguyên tử: 85,4678
- Tính chất: mềm, màu trắng bạc, dễ phản ứng
- Tồn tại trong tự nhiên: dạng khoáng chất
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/gK | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 1 | 5 | 85,4678(3) | 1.532 | 312,46 | 961 | 0,363 | 0,82 | 90 |
Tính chất của nguyên tố Rubiđi
Tính chất vật lý
- Trạng thái: Kim loại mềm, màu trắng bạc.
- Nhiệt độ nóng chảy: 39,3 °C.
- Nhiệt độ sôi: 688 °C.
- Khối lượng riêng: 1,53 g/cm³.
- Tính dẫn điện: Dẫn điện tốt.
- Tính dẫn nhiệt: Dẫn nhiệt tốt.
- Dễ phản ứng: Dễ phản ứng với nước, axit và halogen.
Tính chất hóa học

- Hóa trị: +1.
- Tính oxi hóa: Khó bị oxi hóa.
- Tính khử: Dễ bị khử.
- Tác dụng với nước: Tác dụng mạnh với nước, tạo ra dung dịch kiềm và khí hydro.
- Tác dụng với axit: Tác dụng với axit tạo ra muối.
- Tác dụng với halogen: Tác dụng với halogen tạo ra muối halogenua.
Lưu ý:
- Rubiđi là một kim loại kiềm rất hoạt động.
- Cần cẩn thận khi tiếp xúc với Rubiđi vì nó có thể gây bỏng.
Ứng dụng của nguyên tố Rubiđi
Ứng dụng của nguyên tố Rubiđi
Ghim
- Rubiđi được sử dụng trong pin rubiđi-chlorine, cung cấp năng lượng cho các thiết bị như máy tạo nhịp tim và máy trợ thính.
- Loại pin này có mật độ năng lượng cao hơn pin lithium-ion và có thể hoạt động trong môi trường nhiệt độ cao.
Đồng hồ nguyên tử
- Rubiđi được sử dụng trong các đồng hồ nguyên tử, là tiêu chuẩn thời gian quốc tế.
- Đồng hồ nguyên tử dựa trên tần số cộng hưởng của nguyên tử Rubiđi, có độ chính xác cao hơn nhiều so với đồng hồ thạch anh.
Tia laze
- Rubiđi được sử dụng trong các thiết bị laser, có ứng dụng trong y học, công nghiệp và khoa học.
- Laser rubiđi có bước sóng 780 nm, có thể được sử dụng để cắt, hàn và khắc các vật liệu.
Nghiên cứu khoa học
- Rubiđi được sử dụng trong nghiên cứu khoa học, ví dụ như nghiên cứu về cấu tạo nguyên tử và phân tử.
- Rubiđi có thể được sử dụng để làm lạnh các nguyên tử khác đến nhiệt độ gần bằng độ không tuyệt đối.
Y học
- Rubiđi-82 được sử dụng trong chẩn đoán và điều trị ung thư.
- Rubiđi-82 có thể được sử dụng để theo dõi dòng chảy của máu trong cơ thể.
Ngoài ra, Rubiđi còn có một số ứng dụng khác như:
- Sử dụng trong quá trình sản xuất các dạng thủy tinh độc đáo.
- Dùng trong các bộ cảm biến khí.
- Dùng trong các thiết bị dò tìm kim loại
Điều chế và sản xuất nguyên tố Rubiđi
Điều chế
Trong phòng thí nghiệm

- Phương pháp điện phân:
Điện phân dung dịch RbCl nóng chảy để thu được Rb.
Phương trình: 2RbCl → 2Rb + Cl₂
- Phương pháp khử:
Khử RbCl bằng Mg hoặc Ca để thu được Rb.
Phương trình:
- Mg + 2RbCl → 2Rb + MgCl₂
- Ca + 2RbCl → 2Rb + CaCl₂
Trong công nghiệp:
Trên quy mô công nghiệp, Rubiđi thường được thu hồi từ quá trình xử lý khoáng vật lepidolit, một nguồn của nhiều kim loại kiềm, bao gồm Lithium và Rubiđi. Một phương pháp phổ biến bao gồm:
Chưng cất khoáng lepidolit:
- Khoáng vật được nghiền nhỏ, sau đó được xử lý nhiệt và hóa học để chuyển đổi thành hợp chất dễ xử lý hơn như Rubiđi sulfate (Rb₂SO₄).
Tách Rubiđi:
- Rubiđi sulfate sau đó có thể được tách ra và chuyển đổi thành các hợp chất của Rubiđi như Rubiđi chloride (RbCl), sau đó được giảm bằng cách sử dụng các phương pháp điện hóa hoặc hóa học để sản xuất kim loại Rubiđi.
Sản xuất
- Rubiđi được sản xuất bằng phương pháp điện phân dung dịch RbCl nóng chảy.
- Quá trình điện phân được thực hiện trong một bình điện phân có catôt làm bằng thép và anotôt làm bằng than chì.
- Dung dịch RbCl được nung nóng đến nhiệt độ khoảng 700 °C để làm tan chảy.
- Dòng điện được đi qua dung dịch nóng chảy, khiến cho RbCl bị phân hủy thành Rb và Cl₂.
- Rb được thu thập ở catôt và Cl₂ được thu thập ở anotôt.
Phản ứng của nguyên tố Rubiđi
Rubiđi là một kim loại kiềm rất hoạt động.
Nước
- Rubiđi phản ứng mạnh với nước, tạo ra dung dịch bazơ mạnh và khí hydro.
Phương trình: 2Rb + 2H₂O → 2RbOH + H₂
Axit
- Rubiđi phản ứng với axit tạo ra muối.
Ví dụ:
- Rb + HCl → RbCl + H₂
- 2Rb + H₂SO₄ → Rb₂SO₄ + H₂
halogen
- Rubiđi phản ứng với halogen tạo ra muối halogenua.
Ví dụ:
- 2Rb + Cl₂ → 2RbCl
- 2Rb + Br₂ → 2RbBr
Oxy
- Rubiđi phản ứng với oxy khi nung nóng, tạo ra oxit.
Phương trình: 4Rb + O₂ → 2Rb₂O
Kim loại khác
- Rubiđi có thể khử một số kim loại khác từ dung dịch muối của chúng.
Ví dụ:
- Rb + CuSO₄ → RbSO₄ + Cu
Ví dụ cụ thể
Khi cho Rubiđi vào nước:
Hiện tượng: Rubiđi tan nhanh trong nước, tạo ra dung dịch bazơ mạnh và khí hydro. Dung dịch có màu hồng nhạt do có khí hydro bốc lên.
Phương trình: 2Rb + 2H₂O → 2RbOH + H₂
Khi cho Rubiđi vào dung dịch axit clohydric:
Hiện tượng: Rubiđi tan nhanh trong dung dịch axit clohydric, tạo ra muối rubiđi clorua và khí hydro.
Phương trình: Rb + HCl → RbCl + H₂
Tồn tại và khai thác nguyên tố Rubiđi
Tồn tại
- Rubiđi là một nguyên tố tương đối hiếm, với hàm lượng trong vỏ Trái đất chỉ khoảng 70 ppm.
- Nó thường được tìm thấy trong khoáng chất lepidolite, petalite và pollucite.
Khai thác
- Rubiđi được khai thác từ các mỏ lepidolite, petalite và pollucite.
- Quá trình khai thác bao gồm nghiền quặng, tuyển nổi và nung nóng để chiết xuất Rubiđi.
Vấn đề an toàn khi sử dụng nguyên tố Rubiđi
- Rubiđi là một kim loại kiềm rất hoạt động.
- Nó có thể gây bỏng da và mắt.
- Khi tiếp xúc với nước, Rubiđi tạo ra dung dịch bazơ mạnh có thể gây bỏng.
- Cần cẩn thận khi tiếp xúc với Rubiđi và phải tuân thủ các biện pháp an toàn sau:
- Đeo găng tay, kính bảo hộ và quần áo bảo hộ khi tiếp xúc với Rubiđi.
- Làm việc trong khu vực thông gió tốt.
- Bảo quản Rubiđi trong bình kín, tránh tiếp xúc với nước và không khí.
- Rửa sạch tay sau khi tiếp xúc với Rubiđi.
Chất lượng và phương thức cung cấp nguyên tố Rubiđi
Chất lượng
- Rubiđi có thể được cung cấp ở nhiều độ tinh khiết khác nhau, từ 99,9% đến 99,999%.
- Độ tinh khiết của Rubiđi ảnh hưởng đến giá cả và hiệu suất của nó trong các ứng dụng khác nhau.
Phương thức cung cấp
- Rubiđi được cung cấp dưới dạng kim loại, hợp kim, muối và dung dịch.
- Các nhà cung cấp Rubiđi thường là các công ty hóa chất và các nhà cung cấp kim loại.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Rubiđi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Rubiđi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







