Nguyên tố Argon: Khái niệm, tính chất của khí hiếm
Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Argon, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn.
Được phát hiện vào cuối thế kỷ 19, Argon được sử dụng trong nhiều ứng dụng khác nhau, bao gồm ngành công nghiệp, y học và nghiên cứu khoa học. Mặc dù nó tồn tại ở dạng khí trong tự nhiên, Argon cũng được sử dụng trong các hợp chất hóa học và trong quá trình làm lạnh và đông lạnh. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Argon, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Agron
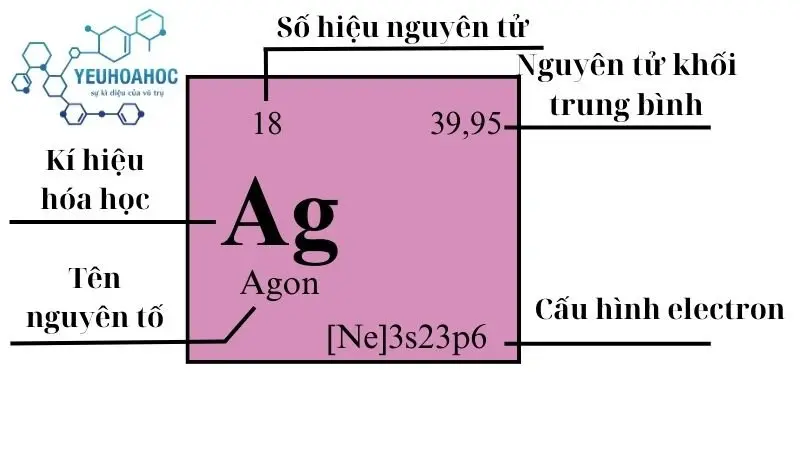
Định Nghĩa
Argon là nguyên tố thứ ba phổ biến nhất trong khí quyển Trái Đất, sau nitơ và oxy, chiếm khoảng 0.93% thể tích của không khí. Do có lớp vỏ electron đầy đủ, Argon rất ổn định và hầu như không tham gia vào các phản ứng hóa học, làm cho nó trở thành lựa chọn lý tưởng cho nhiều ứng dụng đòi hỏi một môi trường trơ, không phản ứng.
Lịch sử hình thành nguyên tố Argon
- Năm 1894: Henry Cavendish lần đầu tiên thu được argon bằng cách loại bỏ các khí khác khỏi khí quyển.
- Năm 1895: William Ramsay và Lord Rayleigh xác định argon là một nguyên tố mới.
- Tên “argon” có nguồn gốc từ tiếng Hy Lạp “argos”, có nghĩa là “lười biếng” hoặc “trơ”.
Mốc thời gian quan trọng trong lịch sử phát hiện:
- 1869: Mendeleev dự đoán sự tồn tại của một nguyên tố trơ trong nhóm 18 của bảng tuần hoàn.
- 1894: Henry Cavendish thu được argon bằng cách loại bỏ các khí khác khỏi khí quyển.
- 1895: William Ramsay và Lord Rayleigh xác định argon là một nguyên tố mới.
- 1904: William Ramsay và Morris Travers phát hiện ra các khí hiếm khác: helium, neon, krypton, xenon và radon.
Tầm quan trọng của nguyên tố Argon trong đời sống
Khí trơ: Argon là một khí trơ, nghĩa là nó không phản ứng với các nguyên tố khác. Tính chất này làm cho nó hữu ích trong nhiều ứng dụng.
Argon được sử dụng rộng rãi trong công nghiệp do tính chất không phản ứng và khả năng bảo vệ các vật liệu khỏi oxy hóa khi tiếp xúc với không khí.
Nguyên tố Argon trong bảng tuần hoàn hóa học
- Argon nằm trong nhóm 18 (nhóm khí hiếm) của bảng tuần hoàn hóa học.
- Các nguyên tố khác trong nhóm 18 là helium, neon, krypton, xenon và radon.
- Các nguyên tố trong nhóm 18 có cấu hình electron lớp ngoài cùng là 8 electron (trừ helium có 2 electron).
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/gK | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 18 | 3 | 39,948(1)2 | 0,0017837 | 83,80 | 87,30 | 0,52 | – | 3,5 |
Tính chất của nguyên tố Argon
Tính chất vật lý
- Trạng thái: Khí không màu, không mùi, không vị.
- Khối lượng mol: 39,948 g/mol.
- Tỷ khối: 1,784 g/L (ở 0°C và 1 atm).
- Nhiệt độ nóng chảy: -189,4°C.
- Nhiệt độ sôi: -185,9°C.
- Độ tan trong nước: 2,5 ml/L (ở 0°C).
Tính chất hóa học
- Tính trơ: Argon là khí trơ, nghĩa là nó không phản ứng với các nguyên tố khác trong điều kiện bình thường.
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p⁶.
- Điện hóa trị: 0.
- Độ âm điện: 0.
Lý do tính trơ:
- Argon có cấu hình electron lớp ngoài cùng bền vững (8 electron)
- Lực hút giữa hạt nhân và electron ngoài cùng của argon rất mạnh.
Ứng dụng của nguyên tố Argon

Khí trơ trong bóng đèn: Argon được sử dụng để thay thế cho nitơ trong bóng đèn vì nó không phản ứng với dây tóc. Nhờ vậy, dây tóc có thể sáng hơn và bền hơn.
Khí bảo vệ trong hàn: Argon được sử dụng để bảo vệ kim loại khỏi bị oxy hóa trong quá trình hàn. Argon tạo ra một lớp khí trơ xung quanh mối hàn, ngăn không cho oxy và các khí khác tiếp xúc với kim loại nóng chảy.
Khí nén: Argon được sử dụng trong các bình khí nén để cung cấp áp suất. Argon là khí trơ nên không phản ứng với các chất khác trong bình khí nén, giúp đảm bảo an toàn và hiệu quả sử dụng.
Y tế: Argon được sử dụng trong y tế để điều trị các bệnh như phổi tắc nghẽn mãn tính (COPD). Argon được sử dụng để pha loãng oxy trong hỗn hợp khí thở cho bệnh nhân COPD.
Các ứng dụng khác:
Sản xuất thép: Argon được sử dụng để loại bỏ các tạp chất trong quá trình sản xuất thép.
Sản xuất bia: Argon được sử dụng để đẩy oxy ra khỏi thùng chứa bia trước khi đóng chai.
Ngành công nghiệp điện tử: Argon được sử dụng để bảo vệ các linh kiện điện tử khỏi bị oxy hóa.
Ngành công nghiệp thực phẩm: Argon được sử dụng để bảo quản thực phẩm bằng cách ngăn chặn sự phát triển của vi khuẩn.
Điều chế và sản xuất nguyên tố Argon
Điều chế
Điều chế trong phòng thí nghiệm:
Phương pháp 1: Phân hủy hợp chất của Argon
-
- Argon có thể được điều chế trong phòng thí nghiệm bằng cách phân hủy hợp chất của nó, chẳng hạn như kali nitrat (KNO₃). Khi KNO₃ được nung nóng, nó sẽ phân hủy thành kali nitrit (KNO₂) và khí oxy (O₂). Argon có thể được thu thập bằng cách dẫn khí qua dung dịch nước để loại bỏ O₂.
Phản ứng: 2KNO₃ → 2KNO₂ + O₂↑ + Ar↑
Phương pháp 2: Điện phân nước
-
- Argon cũng có thể được điều chế bằng cách điện phân nước. Nước được điện phân sẽ tạo ra khí oxy (O₂) và khí hydro (H₂). Argon có thể được thu thập bằng cách dẫn khí qua dung dịch axit để loại bỏ H₂.
Phản ứng: 2H₂O → 2H₂↑ + O₂↑
Điều chế trong công nghiệp:
Phương pháp 1: Ngưng tụ và tách khí
-
- Argon được điều chế trong công nghiệp bằng phương pháp ngưng tụ và tách khí. Khí quyển được hóa lỏng và sau đó được tách thành các thành phần khác nhau dựa trên điểm sôi của chúng. Argon có điểm sôi thấp hơn so với nitơ và oxy, do đó nó có thể được thu thập bằng cách bay hơi.
Phương pháp 2: Lọc màng
-
- Argon cũng có thể được điều chế bằng phương pháp lọc màng. Khí quyển được nén và sau đó được đưa qua một màng lọc. Màng lọc sẽ cho phép các phân tử khí nhỏ hơn như argon đi qua, nhưng sẽ giữ lại các phân tử khí lớn hơn như nitơ và oxy.
Sản xuất
- Argon được sản xuất trên quy mô lớn bởi các nhà máy sản xuất khí công nghiệp.
- Argon được sản xuất bằng phương pháp ngưng tụ và tách khí.
- Argon được vận chuyển trong các bình thép hoặc bồn chứa dưới áp suất cao.
Phản ứng của nguyên tố Argon
Argon là một khí trơ, tức là nó không tác động hoặc phản ứng với các nguyên tố khác trong điều kiện thông thường. Do cấu hình electron lớp ngoài cùng bền vững (8 electron) và lực hút mạnh giữa hạt nhân và electron ngoài cùng, Argon rất khó tham gia vào các phản ứng hóa học.
Dưới đây là một số trường hợp đặc thù
Phản ứng với florua:
-
- Khi Argon được nung nóng đến nhiệt độ cao, nó có thể phản ứng với florua để tạo thành hợp chất argon florua (ArF). Tuy nhiên, phản ứng này diễn ra rất chậm và cần có điều kiện đặc biệt.
Phản ứng với các nguyên tử khác:
-
- Argon có thể phản ứng với các nguyên tử khác trong môi trường plasma, nơi các nguyên tử bị ion hóa và có năng lượng cao.
Phản ứng với các hợp chất kim loại:
-
- Argon có thể tạo thành các hợp chất với một số hợp chất kim loại, chẳng hạn như ferrocene (Fe(C₅H₅)₂). Tuy nhiên, các hợp chất này rất không bền và dễ dàng bị phân hủy.
Nhìn chung, Argon là một nguyên tố rất ít phản ứng và được coi là khí trơ trong hầu hết các trường hợp.
Tồn tại và khai thác nguyên tố Argon
Tồn tại
- Argon là nguyên tố phổ biến thứ ba trong khí quyển Trái đất, chiếm 0,934%.
- Nó có trong không khí dưới dạng khí tự do và không kết hợp với các nguyên tố khác.
- Argon cũng có thể được tìm thấy trong một số khoáng chất, chẳng hạn như cryolite (Na₃AlF₆).
Khai thác
- Argon được chiết xuất thông qua quá trình lỏng hóa không khí
- Khí quyển được nén và sau đó được làm lạnh đến nhiệt độ rất thấp (-194°C).
- Tại nhiệt độ này, các khí khác trong khí quyển sẽ hóa lỏng, nhưng argon vẫn ở dạng khí.
- Argon sau đó được thu thập và vận chuyển trong các bình thép hoặc bồn chứa dưới áp suất cao.
Vấn đề an toàn khi sử dụng nguyên tố Argon
Mặc dù Argon là khí trơ và không độc hại, nhưng vẫn có một số vấn đề an toàn cần lưu ý khi sử dụng:
Ngạt thở:
- Argon nặng hơn không khí và có thể tích tụ ở những nơi thấp.
- Nếu hít phải lượng argon lớn, có thể dẫn đến thiếu oxy và ngạt thở.
- Cần đảm bảo thông gió tốt khi sử dụng argon trong không gian kín.
Áp suất cao:
- Argon thường được lưu trữ trong các bình thép hoặc bồn chứa dưới áp suất cao.
- Nếu bình argon bị hư hỏng hoặc rò rỉ, có thể gây ra nguy hiểm do áp suất cao.
- Cần cẩn thận khi sử dụng và vận chuyển bình argon.
Nhiệt độ thấp:
- Argon hóa lỏng có nhiệt độ rất thấp (-189,4°C).
- Tiếp xúc trực tiếp với argon lỏng có thể gây bỏng lạnh.
- Cần cẩn thận khi sử dụng argon lỏng và sử dụng các biện pháp bảo hộ thích hợp.
Khí hóa lỏng:
- Argon có thể hóa lỏng dưới áp suất cao.
- Nếu argon lỏng rò rỉ ra ngoài môi trường, nó có thể tạo thành sương mù dày đặc.
- Sương mù argon có thể làm giảm tầm nhìn và gây nguy hiểm cho người đi lại.
Để đảm bảo an toàn khi sử dụng argon, cần lưu ý:
- Tuân thủ các hướng dẫn an toàn của nhà sản xuất.
- Sử dụng argon trong khu vực thông gió tốt.
- Mang thiết bị bảo hộ thích hợp khi sử dụng argon lỏng.
- Cẩn thận khi vận chuyển và sử dụng bình argon.
Chất lượng và phương thức cung cấp nguyên tố Argon
Chất lượng
- Argon được cung cấp với nhiều cấp độ chất lượng khác nhau, tùy thuộc vào mục đích sử dụng.
- Cấp độ chất lượng cao nhất được sử dụng cho các ứng dụng trong ngành công nghiệp điện tử và y tế.
- Cấp độ chất lượng thấp hơn được sử dụng cho các ứng dụng thông thường như hàn và bảo quản thực phẩm.
Phương thức cung cấp
- Argon được cung cấp dưới dạng khí nén trong các bình thép hoặc bồn chứa.
- Các bình argon có thể được mua từ các nhà cung cấp khí công nghiệp hoặc các đại lý bán hóa chất.
- Argon cũng có thể được cung cấp dưới dạng lỏng trong các thùng chứa đặc biệt.
Dưới đây là một số yếu tố cần lưu ý khi lựa chọn argon:
- Cấp độ chất lượng: Cần chọn cấp độ chất lượng phù hợp với mục đích sử dụng.
- Kích cỡ bình: Cần chọn kích cỡ bình phù hợp với nhu cầu sử dụng.
- Nhà cung cấp: Cần chọn nhà cung cấp uy tín và có kinh nghiệm.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Agron mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Agron. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







