So sánh chi tiết giữa liên kết ion và liên kết cộng hóa trị
Liên kết ion và liên kết cộng hóa trị là hai loại liên kết hóa học chủ yếu, giúp các nguyên tử kết hợp để tạo thành hợp chất ổn định. Dù cả hai loại liên kết đều nhằm đạt được cấu hình electron bền vững
Liên kết ion và liên kết cộng hóa trị là hai loại liên kết hóa học chủ yếu, giúp các nguyên tử kết hợp để tạo thành hợp chất ổn định. Dù cả hai loại liên kết đều nhằm đạt được cấu hình electron bền vững, chúng khác nhau cơ bản về cách các nguyên tử chia sẻ hoặc chuyển giao electron. Hiểu rõ sự khác nhau giữa liên kết ion và liên kết cộng hóa trị không chỉ quan trọng trong hóa học mà còn trong nhiều lĩnh vực ứng dụng như hóa học vật liệu, y học, và công nghiệp hóa chất.
Liên kết ion
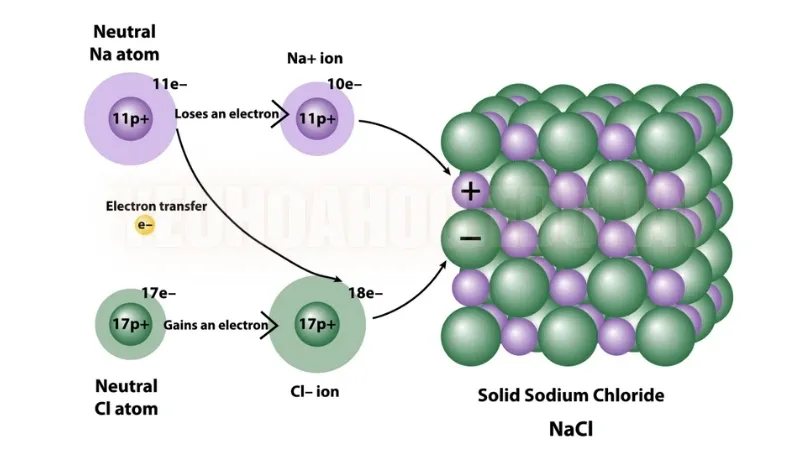
Liên kết ion là một loại liên kết hóa học phát sinh từ lực hút tĩnh điện giữa các ion tích điện dương và âm. Liên kết này hình thành khi các nguyên tử mất hoặc nhận electron, dẫn đến sự hình thành các cation (ion tích điện dương) và anion (ion tích điện âm). Thông thường, liên kết ion xảy ra giữa các kim loại, có xu hướng mất electron, và phi kim loại, có xu hướng nhận electron.
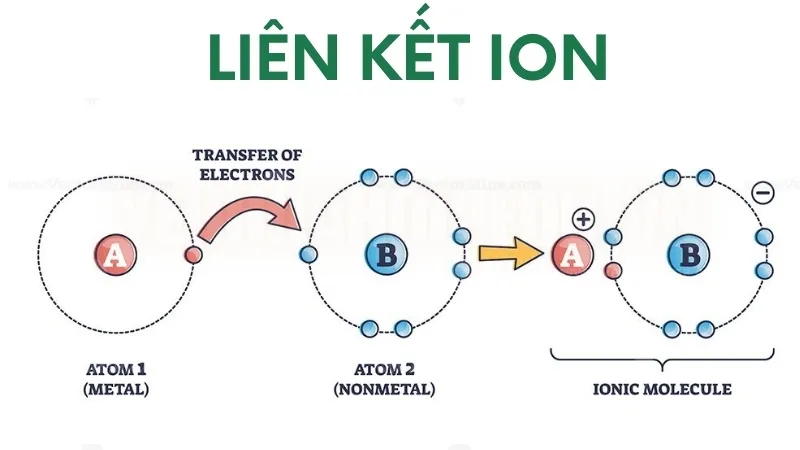
Sự hình thành liên kết ion
Natri clorua (NaCl)
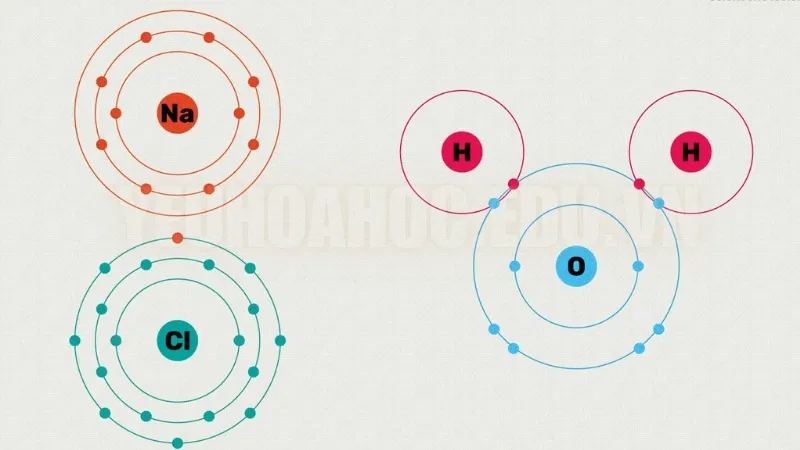
Natri (Na) có một electron ở lớp ngoài cùng. Để đạt được cấu hình electron ổn định tương tự như khí hiếm, nó mất electron này.
Ngược lại, Clo (Cl) có bảy electron ở lớp vỏ ngoài cùng và cần thêm một electron nữa để đạt được sự ổn định.
Do đó, natri nhường electron của nó cho clo, dẫn đến sự hình thành ion natri Na + và ion clorua Cl −
Lực hấp dẫn giữa hai ion mang điện tích trái dấu này hình thành nên liên kết ion, tạo ra natri clorua.
Magie Oxit (MgO)
- Magiê (Mg) có hai electron ở lớp ngoài cùng. Nó mất các electron này để đạt được cấu hình electron của khí hiếm.
- Oxy (O) có sáu electron ở lớp vỏ ngoài cùng và cần thêm hai electron nữa để ổn định.
- Magiê nhường hai electron của nó cho oxy, dẫn đến sự hình thành ion magie Mg 2+ và ion oxit O 2−
- Lực hút tĩnh điện giữa chúng tạo ra liên kết ion, tạo ra magie oxit.
Hợp chất ion phổ biến
Natri clorua (NaCl) – Thường được gọi là muối ăn, được dùng trong nấu ăn và bảo quản thực phẩm.
Kali Bromide (KBr) – Được sử dụng trong phim ảnh và chế phẩm thuốc.
Canxi cacbonat (CaCO3 ) – Có trong thuốc kháng axit, phấn, đá vôi và vỏ của các sinh vật biển.
Magie sulfat (MgSO4 ) – Còn gọi là muối Epsom, được sử dụng trong muối tắm và làm chất làm khô trong tổng hợp hữu cơ.
Các yếu tố ảnh hưởng đến độ bền của liên kết ion
Xem thêm: Phản ứng nhiệt hạch
Điện tích của ion: Các ion có điện tích cao hơn có xu hướng hình thành liên kết ion mạnh hơn.
Kích thước của các ion: Các ion nhỏ hơn có xu hướng tạo thành liên kết ion mạnh hơn vì chúng có thể gần nhau hơn, dẫn đến lực hút tĩnh điện mạnh hơn. Ví dụ, LiF có liên kết ion mạnh hơn NaF vì các ion liti và florua nhỏ hơn các ion natri và florua.
Năng lượng mạng tinh thể: Đây là năng lượng cần thiết để tách một mol hợp chất ion thành các ion riêng lẻ. Năng lượng mạng tinh thể cao hơn cho thấy liên kết ion mạnh hơn. Độ lớn của năng lượng mạng tinh thể bị ảnh hưởng bởi điện tích và kích thước của các ion.
Hằng số điện môi của dung môi: Độ mạnh của liên kết ion cũng có thể bị ảnh hưởng bởi môi trường mà các ion có mặt. Một dung môi có hằng số điện môi cao có thể làm yếu độ mạnh của liên kết ion bằng cách giảm lực hút giữa các ion.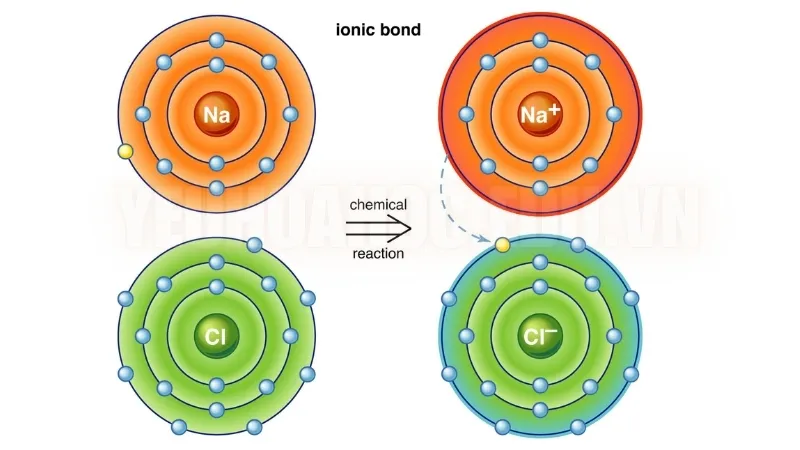
Liên kết cộng hóa trị
Liên kết cộng hóa trị là một dạng liên kết hóa học hình thành khi hai nguyên tử chia sẻ một hoặc nhiều cặp electron để đạt được cấu hình electron ổn định. Sự chia sẻ này giúp mỗi nguyên tử có số electron giống với khí hiếm gần nhất, đạt trạng thái bền vững. Liên kết cộng hóa trị thường xảy ra giữa các nguyên tử phi kim, vì chúng có xu hướng muốn nhận thêm electron để hoàn thành lớp vỏ ngoài cùng.
Xem thêm:
Sự hình thành liên kết cộng hóa trị
Phân tử Hydro (H₂)
- Mỗi nguyên tử hydro có một electron ở lớp vỏ ngoài cùng và cần thêm một electron nữa để có được cấu hình bền vững như heli.
- Khi hai nguyên tử hydro chia sẻ electron với nhau, chúng tạo thành một liên kết cộng hóa trị đơn, giúp cả hai đạt cấu hình electron ổn định. Kết quả là một phân tử hydro (H₂) được hình thành.
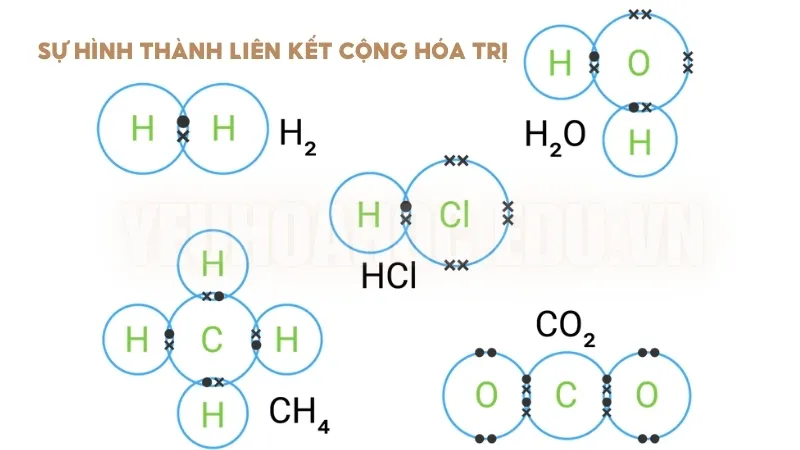
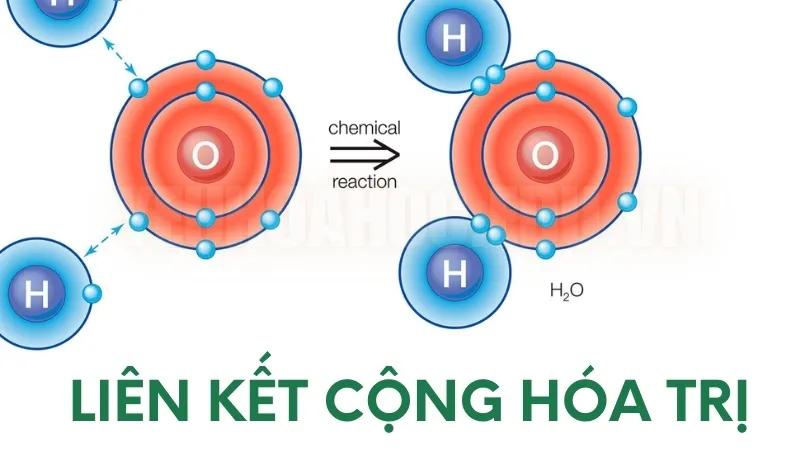
Phân tử Nước (H₂O)
- Nguyên tử oxy có sáu electron ở lớp vỏ ngoài cùng và cần thêm hai electron để hoàn thành lớp vỏ.
- Hai nguyên tử hydro sẽ chia sẻ mỗi nguyên tử một electron với oxy. Bằng cách này, mỗi nguyên tử hydro và oxy đều đạt được cấu hình ổn định. Hai liên kết cộng hóa trị được hình thành giữa oxy và hai nguyên tử hydro, tạo ra phân tử nước.
Một số hợp chất có liên kết cộng hóa trị phổ biến
- Mêtan (CH₄): Thành phần chính của khí thiên nhiên, được sử dụng làm nhiên liệu và trong tổng hợp hữu cơ.
- Cacbon Dioxide (CO₂): Sản phẩm của quá trình hô hấp và đốt cháy, đóng vai trò là khí nhà kính trong khí quyển.
- Amoniac (NH₃): Dùng trong sản xuất phân bón và làm chất làm lạnh.
- Etanol (C₂H₅OH): Thường được gọi là rượu, có trong đồ uống có cồn và được dùng làm dung môi.
Các yếu tố ảnh hưởng đến độ bền của liên kết cộng hóa trị
Chênh lệch độ âm điện
- Độ bền của liên kết cộng hóa trị bị ảnh hưởng bởi sự chênh lệch độ âm điện giữa hai nguyên tử.
- Nếu chênh lệch độ âm điện giữa hai nguyên tử lớn, liên kết sẽ phân cực (như trong nước H₂O), với sự chia sẻ electron không đều. Ngược lại, nếu chênh lệch nhỏ, liên kết sẽ ít phân cực hơn hoặc không phân cực (như trong H₂), tạo sự ổn định cao hơn.
Chiều dài liên kết
Khoảng cách giữa hạt nhân của hai nguyên tử liên kết ảnh hưởng đến độ bền của liên kết. Chiều dài liên kết ngắn hơn đồng nghĩa với lực hút giữa hạt nhân và electron mạnh hơn, dẫn đến liên kết bền hơn. Ví dụ, liên kết trong phân tử hydro (H₂) ngắn hơn và bền hơn nhiều liên kết dài khác.
Độ bội liên kết
Số lượng cặp electron được chia sẻ giữa hai nguyên tử ảnh hưởng đến độ bền của liên kết. Liên kết đơn yếu hơn so với liên kết đôi, và liên kết đôi yếu hơn liên kết ba. Ví dụ:
- Liên kết đơn trong mêtan (CH₄) yếu hơn liên kết đôi trong phân tử oxy (O₂).
- Liên kết ba trong phân tử nitơ (N₂) là một trong những liên kết mạnh nhất, rất khó phá vỡ.
Cộng hưởng
- Một số phân tử có cấu trúc cộng hưởng, nghĩa là electron có thể di chuyển giữa các vị trí khác nhau trong phân tử, tạo ra nhiều cấu trúc ổn định. Cộng hưởng giúp phân tử ổn định hơn.
- Ví dụ, benzen (C₆H₆) có cấu trúc cộng hưởng, giúp ổn định các liên kết cộng hóa trị và tạo nên tính chất đặc trưng của hợp chất này.
Sự chồng chéo của các orbital
Mức độ chồng chéo và loại orbital chồng chéo ảnh hưởng đến độ bền của liên kết. Có hai loại chồng chéo chính
- Liên kết sigma (σ): Hình thành do sự chồng chéo trực tiếp của các orbital nguyên tử. Đây là loại liên kết mạnh, bền và phổ biến trong các liên kết đơn.
- Liên kết pi (π): Hình thành do sự chồng chéo ngang của các orbital p. Liên kết pi yếu hơn so với liên kết sigma và thường xuất hiện trong các liên kết đôi hoặc ba.
 Sự khác biệt của liên kết cộng hóa trị và liên kết ion
Sự khác biệt của liên kết cộng hóa trị và liên kết ion
| Liên kết ion | Liên kết cộng hóa trị |
| Liên kết ion được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. | Liên kết cộng hóa trị được hình thành bởi sự chia sẻ lẫn nhau các cặp electron giữa các nguyên tử. |
| Trong liên kết ion, electron được chuyển từ nguyên tử này (thường là kim loại) sang nguyên tử khác (thường là phi kim). | Trong liên kết cộng hóa trị, các electron được chia đều giữa các nguyên tử, theo cách bình đẳng hoặc không bình đẳng. |
| Liên kết ion được hình thành khi một nguyên tử mất electron để trở thành cation, và một nguyên tử khác nhận được electron để trở thành anion. | Liên kết cộng hóa trị được hình thành khi hai nguyên tử kết hợp với nhau và chia sẻ electron để đạt được sự ổn định. |
| Trong liên kết ion, độ chênh lệch độ âm điện giữa các nguyên tử thường lớn hơn 1,7. | Trong liên kết cộng hóa trị, độ chênh lệch độ âm điện thường nhỏ hơn 1,7. Độ chênh lệch gần bằng không biểu thị liên kết không phân cực. |
| Liên kết ion thường bền hơn ở dạng tinh thể do cấu trúc mạng lưới của các ion, nhưng những liên kết này có thể bị phá vỡ khi hòa tan trong dung dịch nước. | Độ bền của liên kết cộng hóa trị có thể thay đổi, từ liên kết đơn yếu hơn đến liên kết ba rất mạnh, dựa trên số cặp electron chung. |
| Hầu hết các hợp chất ion, chẳng hạn như muối, đều ở trạng thái rắn ở nhiệt độ phòng. | Hợp chất cộng hóa trị có thể tồn tại ở dạng rắn, lỏng hoặc khí ở nhiệt độ phòng, tùy thuộc vào cấu trúc phân tử và kích thước của chúng. |
| Hợp chất ion thường tan trong nước vì chúng có thể phân ly thành các ion cấu thành nên chúng. | Độ hòa tan của các hợp chất cộng hóa trị trong nước thay đổi; các phân tử phân cực có xu hướng hòa tan, trong khi các phân tử không phân cực thường không hòa tan. |
| Hợp chất ion là chất dẫn điện tốt khi ở dạng nóng chảy hoặc trong dung dịch nước do sự chuyển động của các ion tự do. | Hợp chất cộng hóa trị thường dẫn điện kém ở mọi trạng thái vì chúng không có các hạt tích điện chuyển động tự do. |
| Ví dụ về liên kết ion bao gồm Natri clorua (NaCl) và Magie oxit (MgO). | Ví dụ về liên kết cộng hóa trị bao gồm Nước (H₂O), Mêtan (CH₄) và Cacbon đioxit (CO₂). |
Điểm giống nhau giữa liên kết ion và liên kết cộng hóa trị
Liên kết ion và liên kết cộng hóa trị đều có các đặc điểm chung đáng chú ý, bất kể cách mà chúng hình thành. Dưới đây là những điểm tương đồng chính giúp hiểu sâu hơn về cách thức hai loại liên kết này hoạt động và ảnh hưởng đến sự ổn định của các hợp chất.
Đặc điểm hoàn thiện lớp vỏ electron ngoài cùng
Cả liên kết ion và liên kết cộng hóa trị đều giúp các nguyên tử đạt được trạng thái bền vững bằng cách hoàn thiện lớp vỏ electron ngoài cùng với tám electron, tuân theo quy tắc bát tử. Dù là mất, nhận hay chia sẻ electron, hai loại liên kết này đều hướng đến việc giúp các nguyên tử có lớp vỏ ngoài bền vững, mang lại trạng thái ổn định.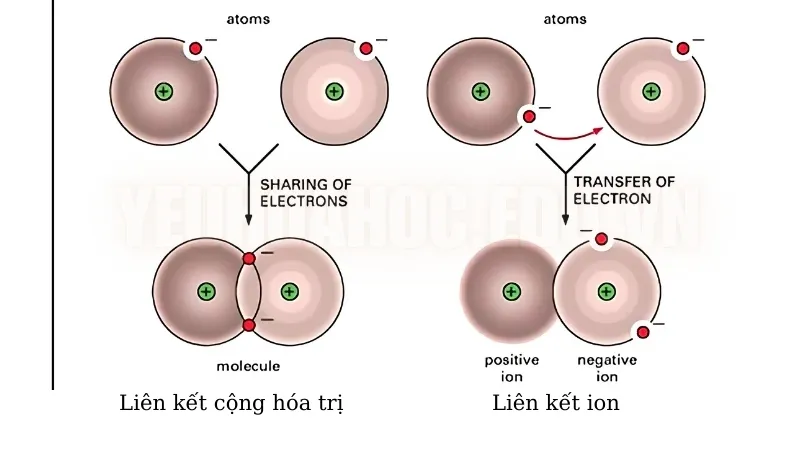
Kỹ thuật liên kết tương tự
Cả hai liên kết đều hình thành nhờ sự hút lẫn nhau giữa các hạt nhân và electron của các nguyên tử đến gần nhau. Trong trường hợp liên kết cộng hóa trị, nếu lực hút của các hạt nhân và electron ở mức tương đương, liên kết sẽ không phân cực. Ngược lại, khi lực hút trở nên khác biệt, liên kết có xu hướng trở thành liên kết ion, phân cực và dẫn đến sự trao đổi electron.
Hình thành ion qua lực hút tĩnh điện
Lực hút tĩnh điện đóng vai trò quan trọng trong việc giữ chặt các nguyên tử trong cả liên kết ion và cộng hóa trị. Trong liên kết ion, các điện tích trái dấu (cation và anion) được hình thành qua việc chuyển giao electron, còn trong liên kết cộng hóa trị, các electron trong lớp hóa trị được chia sẻ trực tiếp giữa các nguyên tử để ổn định lẫn nhau.
Cung cấp sự ổn định cho các nguyên tử
Cả liên kết ion và liên kết cộng hóa trị đều giúp các nguyên tử trở nên ổn định hơn so với khi chúng đứng riêng lẻ. Điều này là do lớp vỏ electron hóa trị ở cả hai loại liên kết đều tham gia vào quá trình tạo thành liên kết, giúp các nguyên tử đạt đến trạng thái năng lượng thấp hơn và ổn định hơn.
Sự trung hòa trong hợp chất
Các hợp chất được hình thành từ liên kết ion và cộng hóa trị đều là trung tính về mặt điện tích. Trong liên kết ion, điện tích dương của cation và điện tích âm của anion triệt tiêu lẫn nhau. Đối với liên kết cộng hóa trị, các nguyên tử trung tính chia sẻ electron, tạo thành hợp chất trung tính mà không có sự phân cực điện tích.
Quá trình tỏa nhiệt
Cả hai loại liên kết này đều là quá trình tỏa nhiệt. Khi các nguyên tử hình thành liên kết (dù là ion hay cộng hóa trị), năng lượng tiềm tàng của chúng giảm xuống, và năng lượng dư thừa được giải phóng dưới dạng nhiệt. Điều này xảy ra khi liên kết mới được hình thành và giúp hợp chất ổn định.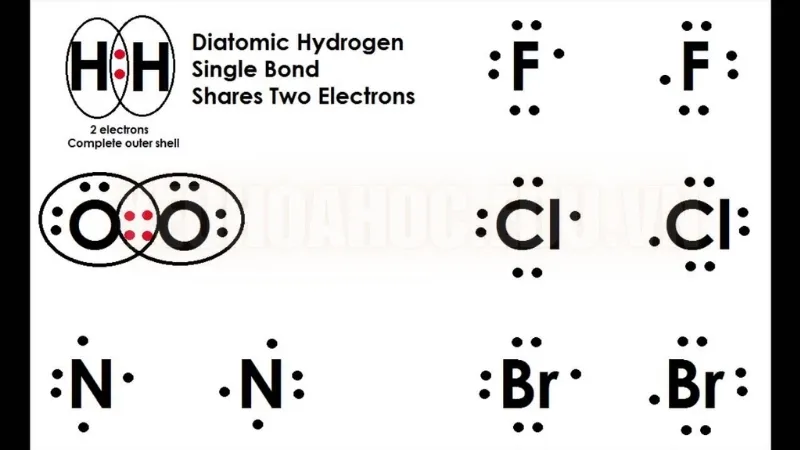
Số lượng electron cố định được chia sẻ
Trong quá trình hình thành, cả hai loại liên kết đều dựa trên số lượng electron cố định. Đối với liên kết ion, các nguyên tử mất hoặc nhận một số lượng electron cố định để đạt trạng thái ổn định. Trong liên kết cộng hóa trị, các nguyên tử chia sẻ một số lượng electron nhất định để hoàn thành lớp vỏ hóa trị của chúng.
Xem thêm: phản ứng oxi hóa khử
Mô hình cấu trúc ổn định
Cả hai loại liên kết đều tạo ra các mô hình cấu trúc ổn định khi ở trạng thái rắn hoặc tinh thể. Trong trạng thái này, các nguyên tử sắp xếp theo một trật tự cụ thể để tối ưu hóa sự ổn định, tạo ra các cấu trúc đồng nhất như tinh thể muối hoặc cấu trúc phân tử bền vững.
Biến đổi theo nhiệt độ và áp suất
Các hợp chất ion và cộng hóa trị đều có thể thay đổi trạng thái vật lý khi gặp điều kiện nhiệt độ và áp suất thích hợp. Sự thay đổi này có thể dẫn đến biến đổi về hình dạng, từ thể rắn sang thể lỏng, hoặc thậm chí thành thể khí, tùy thuộc vào mức độ tương tác giữa các nguyên tử trong cấu trúc.
Sự khác nhau giữa liên kết ion và liên kết cộng hóa trị thể hiện qua cách mỗi liên kết hình thành, tính chất điện và khả năng hòa tan trong dung môi. Bằng cách hiểu rõ đặc điểm của từng loại liên kết, chúng ta có thể ứng dụng hiệu quả hơn trong các lĩnh vực nghiên cứu và phát triển các sản phẩm mới trong đời sống và công nghệ.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.







