Nguyên tử khối là gì? Cách xác định nguyên tử khối dễ hiểu nhất
Nguyên tử khối là một khái niệm quan trọng trong hóa học, giúp chúng ta hiểu về khối lượng và cấu trúc của các nguyên tố. Cách xác định nguyên tử khối của một nguyên tố có vai trò then chốt trong việc phân tích và tính toán các phản ứng hóa học.
Nguyên tử khối là một khái niệm quan trọng trong hóa học, giúp chúng ta hiểu về khối lượng và cấu trúc của các nguyên tố. Cách xác định nguyên tử khối của một nguyên tố có vai trò then chốt trong việc phân tích và tính toán các phản ứng hóa học. Việc hiểu rõ nguyên tử khối không chỉ giúp phân biệt các nguyên tố mà còn đóng góp vào các phép tính quan trọng trong phòng thí nghiệm và nghiên cứu hóa học.
Nguyên tử khối là gì?
Nguyên tử khối là khối lượng của một nguyên tử được tính bằng đơn vị khối lượng nguyên tử (amu). Nó thường được biểu thị bằng số gần với khối lượng của hạt nhân nguyên tử, là tổng của proton và neutron, vì electron có khối lượng rất nhỏ nên ít ảnh hưởng.
Nguyên tử khối giúp phân biệt các nguyên tố và là yếu tố cơ bản trong tính toán hóa học. Việc xác định chính xác nguyên tử khối của các nguyên tố có vai trò quan trọng trong việc tính toán khối lượng mol, dự đoán đặc điểm của nguyên tố trong phản ứng hóa học, và xây dựng công thức phân tử của các hợp chất.
Tại sao cần xác định nguyên tử khối của một nguyên tố?
Xác định nguyên tử khối của một nguyên tố là yếu tố cốt lõi để hiểu về tính chất hóa học của nó. Nguyên tử khối giúp tính toán chính xác khối lượng của các nguyên tố trong phản ứng, xác định tỉ lệ hợp chất trong phản ứng và xây dựng công thức hóa học của các phân tử. Ví dụ, nếu biết nguyên tử khối của carbon (C) là 12 amu và của oxy (O) là 16 amu, ta có thể dễ dàng xác định khối lượng của các hợp chất như CO₂, từ đó tính toán lượng chất tham gia và sản phẩm của phản ứng.
Phương pháp xác định nguyên tử khối của một nguyên tố
Sử dụng bảng tuần hoàn hóa học
Xem thêm: Bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn hóa học là một công cụ tiện lợi để tra cứu nguyên tử khối của các nguyên tố. Mỗi nguyên tố trên bảng tuần hoàn đều được gán một giá trị nguyên tử khối trung bình dựa trên các đồng vị tự nhiên của nó. Nguyên tử khối của một nguyên tố là số gần với giá trị trung bình của các đồng vị có trong tự nhiên. Khi sử dụng bảng tuần hoàn, chúng ta có thể tra cứu nhanh giá trị này để phục vụ các tính toán trong hóa học.
Ví dụ: Khi tra cứu nguyên tử khối của hydro (H) trên bảng tuần hoàn, chúng ta sẽ thấy giá trị trung bình là 1,008 amu, phản ánh trung bình của các đồng vị phổ biến của hydro (H-1, H-2, và H-3).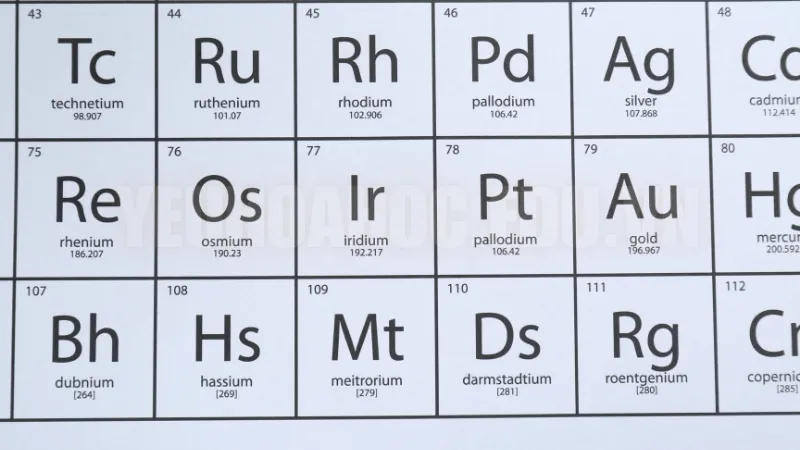
Phương pháp tính toán nguyên tử khối trung bình của đồng vị
Các nguyên tố trong tự nhiên thường tồn tại dưới nhiều dạng đồng vị khác nhau, mỗi đồng vị có một khối lượng nguyên tử riêng. Để xác định nguyên tử khối trung bình của nguyên tố, ta cần tính giá trị trung bình của các khối lượng đồng vị, có tính đến tỉ lệ phần trăm của mỗi đồng vị trong tự nhiên.
Khái niệm đồng vị
Đồng vị là các dạng khác nhau của cùng một nguyên tố, có cùng số proton nhưng khác số neutron. Do đó, mỗi đồng vị có khối lượng khác nhau. Ví dụ, carbon có hai đồng vị phổ biến là C-12 và C-13. Cả hai đồng vị đều có 6 proton nhưng khác nhau về số neutron, dẫn đến khối lượng khác nhau.
Công thức tính nguyên tử khối trung bình
Nguyên tử khối trung bình của một nguyên tố có thể được tính theo công thức sau:
\( \text{Nguyên tử khối trung bình} = \sum \left( \text{khối lượng của đồng vị} \times \text{phần trăm tự nhiên của đồng vị} \right)\)
Trong đó, khối lượng của từng đồng vị được nhân với tỉ lệ phần trăm tự nhiên của đồng vị đó. Kết quả tính toán cho ra nguyên tử khối trung bình, giúp xác định chính xác hơn về khối lượng của nguyên tố.
Ví dụ tính toán nguyên tử khối trung bình của Clo (Cl)
- Clo có hai đồng vị chính: Cl-35 (chiếm 75,78%) và Cl-37 (chiếm 24,22%).
- Tính nguyên tử khối trung bình của clo:
\(\text{Nguyên tử khối trung bình của Cl} = (35 \times 0,7578) + (37 \times 0,2422) = 35,48 \text{ amu} \)
Vì vậy, giá trị nguyên tử khối trung bình của clo là 35,48 amu.
Ví dụ về cách xác định nguyên tử khối của một số nguyên tố
Việc xác định nguyên tử khối của các nguyên tố dựa vào khối lượng và tỉ lệ phần trăm của các đồng vị trong tự nhiên. Đây là cách tính toán nguyên tử khối trung bình của một số nguyên tố phổ biến.
Carbon (C)
– Carbon có hai đồng vị chính là C-12 và C-13.
– C-12 chiếm 98,93% trong tự nhiên với khối lượng là 12 amu.
– C-13 chiếm 1,07% với khối lượng là 13,003 amu.
– Nguyên tử khối trung bình của carbon được tính như sau:
\( \text{Nguyên tử khối trung bình của C} = (12 \times 0,9893) + (13,003 \times 0,0107) = 12,011 \text{ amu} \)
Oxy (O)
– Oxy có ba đồng vị phổ biến là O-16, O-17 và O-18.
– O-16 chiếm 99,76% với khối lượng là 15,995 amu.
– O-17 chiếm 0,04% với khối lượng là 16,999 amu.
– O-18 chiếm 0,20% với khối lượng là 17,999 amu.
– Nguyên tử khối trung bình của oxy:
\(\text{Nguyên tử khối trung bình của O} = (15,995 \times 0,9976) + (16,999 \times 0,0004) + (17,999 \times 0,0020) = 15,999 \text{ amu} \)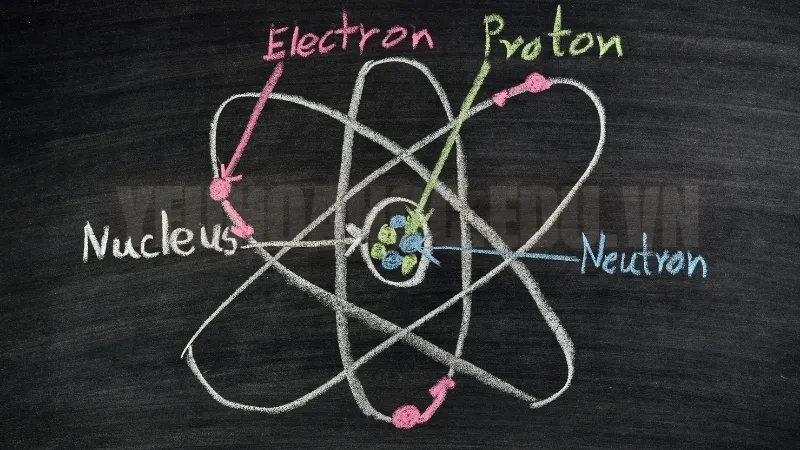
Clo (Cl)
– Clo có hai đồng vị là Cl-35 và Cl-37.
– Cl-35 chiếm 75,78% với khối lượng là 34,969 amu.
Cl-37 chiếm 24,22% với khối lượng là 36,966 amu.
– Nguyên tử khối trung bình của clo:
\(\text{Nguyên tử khối trung bình của Cl} = (34,969 \times 0,7578) + (36,966 \times 0,2422) = 35,453 \text{ amu} \)
Các ví dụ này giúp ta hiểu cách xác định nguyên tử khối trung bình của một nguyên tố dựa vào tỉ lệ phần trăm và khối lượng của các đồng vị.
Vai trò của nguyên tử khối trong hóa học
Xem thêm: Bảng nguyên tử khối
Nguyên tử khối là một yếu tố quan trọng trong tính toán hóa học và có nhiều ứng dụng thực tiễn trong nghiên cứu và thực nghiệm.
Ứng dụng của nguyên tử khối trong tính toán hóa học
Nguyên tử khối giúp xác định khối lượng mol (số gam của một mol nguyên tử hoặc phân tử) của các chất. Việc biết khối lượng mol giúp chúng ta dễ dàng tính toán lượng chất tham gia và sản phẩm của phản ứng hóa học.
Tính toán khối lượng mol
Ví dụ, với carbon có nguyên tử khối trung bình là 12 amu, ta biết rằng một mol carbon có khối lượng khoảng 12g/mol. Điều này được áp dụng tương tự với các nguyên tố khác, cho phép tính toán chính xác khối lượng các chất trong phản ứng.
Ứng dụng trong tính toán hóa học
Ví dụ: Trong phản ứng tạo ra CO₂, chúng ta có thể tính toán lượng carbon cần thiết để tạo thành một lượng CO₂ nhất định bằng cách dựa vào nguyên tử khối của C và O. Nguyên tử khối của C là 12 amu và của O là 16 amu, giúp chúng ta xác định rằng khối lượng mol của CO₂ là 44g/mol (12 + 162).
Tầm quan trọng trong xác định công thức hóa học
Nguyên tử khối cũng giúp xác định công thức hóa học của các hợp chất. Bằng cách sử dụng nguyên tử khối của từng nguyên tố, chúng ta có thể xác định được công thức phân tử của hợp chất và từ đó phân tích định lượng các thành phần của chất trong phản ứng.
Ví dụ, với hợp chất H₂O, chúng ta biết rằng nguyên tử khối của hydro (H) là 1 amu và oxy (O) là 16 amu. Do đó, khối lượng phân tử của H₂O là 18 amu (12 + 16), và công thức hóa học của nước có thể được xác định rõ ràng là H₂O.
Việc hiểu và sử dụng nguyên tử khối một cách chính xác là chìa khóa để thực hiện các phép tính và xác định các đặc điểm hóa học của nguyên tố, giúp đảm bảo độ chính xác trong nghiên cứu và ứng dụng hóa học.
Xác định nguyên tử khối của một nguyên tố là bước đầu tiên để hiểu rõ về các đặc tính hóa học của nó, cũng như để tiến hành các tính toán phức tạp trong hóa học. Từ việc sử dụng bảng tuần hoàn đến phương pháp tính toán đồng vị, mỗi cách đều mang lại sự chính xác và hỗ trợ cho các ứng dụng hóa học. Việc nắm vững cách xác định nguyên tử khối của một nguyên tố là nền tảng quan trọng, không chỉ giúp chúng ta hiểu sâu hơn về từng nguyên tố mà còn mở ra nhiều khả năng trong nghiên cứu khoa học và công nghiệp hóa học.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.







