Nguyên tố Zirconi: Khám phá ứng dụng và tính chất quan trọng
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp một cái nhìn sâu sắc về nguyên tố Zirconi, bao gồm định nghĩa, lịch sử và tầm quan trọng của nó trong đời sống
Nguyên tố Zirconi, một thành phần không thể thiếu trong nhiều ứng dụng công nghiệp và khoa học hiện đại, từ việc sản xuất thép không gỉ đến việc sử dụng trong các lò phản ứng hạt nhân. Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp một cái nhìn sâu sắc về nguyên tố Zirconi, bao gồm định nghĩa, lịch sử hình thành và tầm quan trọng của nó trong đời sống và khoa học.
Giới thiệu về nguyên tố Zirconi:
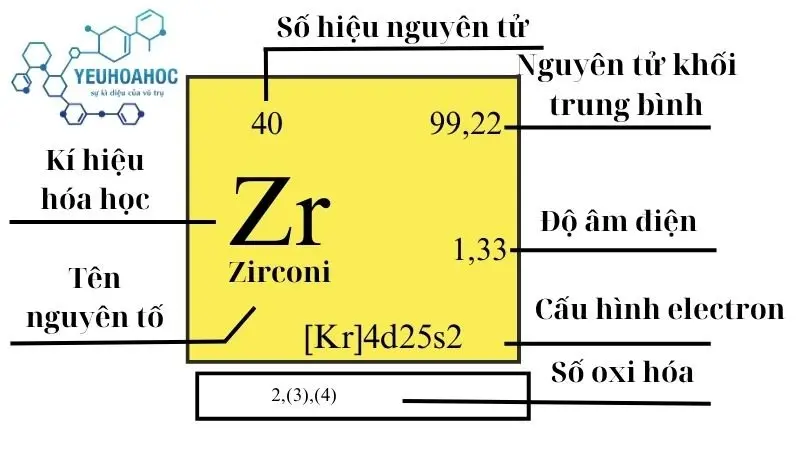
Định nghĩa: Zirconi là gì?
Zirconi là một nguyên tố hóa học có ký hiệu là Zr và số nguyên tử là 40. Nó nằm trong nhóm 4 của bảng tuần hoàn và được biết đến với tính chất vật lý và hóa học đặc biệt như khả năng chống ăn mòn và độ bền cao ở nhiệt độ và áp suất lớn.
Lịch sử hình thành nguyên tố Zirconi
- Năm 1789: Martin Heinrich Klaproth phát hiện ra Zirconi trong khoáng vật zircon.
- Năm 1824: Jöns Jacob Berzelius lần đầu tiên cô lập Zirconi.
- Năm 1914: Zirconi được sử dụng trong đèn flash chụp ảnh.
- Năm 1925: Zirconi được sử dụng trong lò phản ứng hạt nhân.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1789: Martin Heinrich Klaproth phát hiện ra Zirconi trong khoáng vật zircon.
- 1824: Jöns Jacob Berzelius lần đầu tiên cô lập Zirconi.
- 1914: Zirconi được sử dụng trong đèn flash chụp ảnh.
- 1925: Zirconi được sử dụng trong lò phản ứng hạt nhân.
- 1945: Zirconi được sử dụng trong vỏ bọc nhiên liệu hạt nhân.
- 1950: Zirconi được sử dụng trong các hợp kim y tế.
- 1960: Zirconi được sử dụng trong các thiết bị điện tử.
Tầm quan trọng của nguyên tố Zirconi trong đời sống
- Zirconi được sử dụng trong lò phản ứng hạt nhân vì khả năng chống ăn mòn cao của nó.
- Zirconi được sử dụng trong các hợp kim y tế vì nó tương thích sinh học và không độc hại.
- Zirconi được sử dụng trong các thiết bị điện tử vì nó dẫn điện tốt.
- Zirconi được sử dụng trong các lớp phủ gốm sứ vì độ bền và khả năng chống ăn mòn cao.
- Zirconi được sử dụng trong trang sức vì vẻ ngoài sáng bóng và bền.
Nguyên tố Zirconi trong bảng tuần hoàn hóa học
- Zirconi là kim loại chuyển tiếp nhóm 4, chu kỳ 5 trong bảng tuần hoàn hóa học.
- Nó có cấu hình electron 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d2 5s2
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 4 | 5 | 91,224(2) | 6,506 | 2128 | 4682 | 0,278 | 1,33 | 165 |
Tính chất của nguyên tố Zirconi (Zr)
Tính chất vật lý
- Màu: Trắng xám bóng loáng
- Trạng thái: Rắn
- Cấu trúc tinh thể: Lục phương
- Khối lượng riêng: 6,51 g/cm³
- Điểm nóng chảy: 1855 °C
- Điểm sôi: 4409 °C
- Độ dẫn điện: 4,17 × 10^6 S/m
- Độ dẫn nhiệt: 22,6 W/m·K
- Tính dẻo: Dẻo dai
- Khả năng chống ăn mòn: Cao
Tính chất hóa học

- Số hiệu nguyên tử: 40
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁶ 4d² 5s²
- Độ âm điện: 1,33
- Trạng thái oxy hóa: +4, +3, +2, +1
- Tính khử: Yếu
- Tính oxi hóa: Yếu
Một số tính chất hóa học cụ thể
- Chống ăn mòn: Zirconi có khả năng chống ăn mòn cao do có lớp oxit bảo vệ hoạt động trên bề mặt. Nó có thể chống lại axit, kiềm, nước biển và nhiều hóa chất khác.
- Khả năng chịu nhiệt: Zirconi có khả năng chịu nhiệt cao, có thể chịu được nhiệt độ lên đến 1855 °C mà không bị nóng chảy.
- Tính dẫn điện: Zirconi là một kim loại dẫn điện tốt.
- Tính dẻo: Zirconi có tính dẻo, có thể dát mỏng và kéo thành sợi.
Phản ứng với Oxi: Khi tiếp xúc với không khí, Zirconium tạo ra một lớp oxit bề mặt mỏng nhưng vững chắc giúp bảo vệ kim loại khỏi sự ăn mòn. Lớp oxit này là ZrO2, còn được gọi là zirconia.
Phản ứng với Axit: Zirconium kháng lại sự ăn mòn của hầu hết các axit, nhưng có thể bị hòa tan bởi axit hydrofluoric (HF).
Tương tác với Nước: Ở nhiệt độ cao, Zirconium có thể phản ứng chậm với nước, tạo ra hydro và oxit zirconium.
Hợp chất: Zirconium tạo ra nhiều hợp chất, trong đó zirconia (ZrO2) là quan trọng nhất với các ứng dụng rộng rãi từ chất xúc tác đến sứ kỹ thuật.
Ứng dụng của nguyên tố Zirconi (Zr)
Hợp kim
- Zirconi được sử dụng để làm hợp kim với các kim loại khác như thép, đồng, nhôm để cải thiện độ bền, khả năng chống ăn mòn và chịu nhiệt.
- Ví dụ:Trong các lò phản ứng hạt nhân, người ta sử dụng hợp kim Zirconi với thép; trong khi đó, hợp kim kết hợp Zirconi và đồng được ứng dụng trong thiết bị điện, và sự kết hợp giữa Zirconi và nhôm được áp dụng rộng rãi trong ngành hàng không vũ trụ.
Năng lượng hạt nhân
- Zirconi được sử dụng để làm vỏ bọc cho thanh nhiên liệu trong lò phản ứng hạt nhân.
- Zirconi có khả năng chống ăn mòn cao và hấp thụ neutron thấp, giúp nó trở thành vật liệu lý tưởng cho ứng dụng này.
Y tế
- Zirconi được sử dụng để chế tạo các dụng cụ y tế như kim cấy ghép, khớp nhân tạo và dụng cụ nha khoa.
- Zirconi có khả năng tương thích sinh học tốt, nghĩa là nó không bị cơ thể đào thải.
Ngành gốm sứ
- Zirconi được sử dụng để chế tạo các loại gốm sứ có độ bền cao và chịu nhiệt tốt.
- Ví dụ: Zirconia được sử dụng để chế tạo mão răng, dao kéo và các dụng cụ nấu nướng.
Các ứng dụng khác
- Zirconi được sử dụng trong các lĩnh vực khác như:
- Chế tạo các vật liệu chịu lửa
- Chế tạo các chất xúc tác
- Lọc khí thải
- Sản xuất đá quý nhân tạo
Điều chế và sản xuất nguyên tố Zirconi
Điều chế Zirconi
Điều chế trong phòng thí nghiệm:
Trong phòng thí nghiệm, Zirconium thường được điều chế bằng phương pháp giảm hóa học từ các hợp chất của nó, như Zirconium tetrachloride (ZrCl₄) hoặc Zirconium dioxide (ZrO₂).
- Phản ứng từ ZrCl₄:
ZrCl₄ 2Mg → Zr + 2MgCl₂
- Trong phản ứng này, Zirconium tetrachloride (ZrCl₄) được khử bởi Magie (Mg) trong môi trường khí Argon ở nhiệt độ cao để tạo ra Zirconium kim loại và Magie chloride (MgCl₂) là sản phẩm phụ.
- Phản ứng từ ZrO₂:
ZrO₂ + 2Cl₂ + 2C → ZrCl₄ + 2CO
ZrCl₄ + 2Mg → Zr + 2MgCl₂
- Zirconium dioxide (ZrO₂) trước tiên được chuyển đổi thành ZrCl₄ bằng cách tác dụng với Clo (Cl₂) và Carbon (C) ở nhiệt độ cao. Sau đó, ZrCl₄ được giảm bởi Magie như đã mô tả ở trên.
Điều chế trong công nghiệp:
Trong công nghiệp, Zirconium thường được sản xuất từ quặng Zircon (ZrSiO₄) thông qua một số bước xử lý hóa học và nhiệt hóa học.
- Từ Zircon (ZrSiO₄):
ZrSiO₄ + 4Cl₂ + 2C → ZrCl₄ + SiCl₄ + 2CO
- Zircon được phản ứng với Clo và Carbon ở nhiệt độ cao để tạo ra Zirconium tetrachloride (ZrCl₄) và Silicon tetrachloride (SiCl₄). Sau đó, ZrCl₄ được tinh chế và chuyển thành Zirconium kim loại thông qua quá trình giảm hóa học tương tự như trong phòng thí nghiệm.
Sản xuất Zirconium
Sản xuất Zirconium trong công nghiệp bao gồm các bước chính sau:
Khởi đầu từ quặng Zircon: Quặng Zircon được khai thác và tinh chế để thu được Zirconium silicate (ZrSiO₄).
Chuyển đổi thành ZrCl₄: ZrSiO₄ được chuyển đổi thành ZrCl₄ thông qua phản ứng với Clo và Carbon ở nhiệt độ cao.
Tinh chế ZrCl₄: ZrCl₄ thu được từ bước trước được tinh chế để loại bỏ tạp chất.
Giảm hóa học ZrCl₄: ZrCl₄ tinh khiết được giảm bằng kim loại như Magie trong quá trình gọi là Kroll để sản xuất Zirconium kim loại.
Xử lý nhiệt và cán mỏng: Zirconium kim loại sau đó được xử lý nhiệt và cán thành các dạng sản phẩm cần thiết cho các ứng dụng cụ thể.
Phản ứng của nguyên tố Zirconi (Zr)
Zirconi là một kim loại tương đối trơ, ít phản ứng với các chất khác. Tuy nhiên, nó vẫn có thể tham gia một số phản ứng hóa học trong điều kiện nhất định
Phản ứng với axit
Zirconi tác dụng với axit mạnh như axit nitric và axit sunfuric để tạo thành muối Zirconi:
Zr + 4HNO3 → Zr(NO3)4 + 2H2
Ví dụ: Cho Zirconi vào dung dịch axit nitric loãng, ta sẽ quan sát thấy:
- Zirconi tan dần, dung dịch sủi bọt khí.
- Khí thoát ra là khí hydro.
- Muối Zirconi nitrat được tạo thành trong dung dịch.
Phản ứng với oxy
Zirconi tác dụng với oxy khi nung nóng để tạo thành oxit Zirconi:
Zr + O2 → ZrO2
Ví dụ: Nung Zirconi trong không khí, ta sẽ thấy:
- Zirconi cháy sáng, có màu trắng.
- Chất rắn thu được sau khi nung là oxit Zirconi.
Phản ứng với halogen
Zirconi tác dụng với halogen (như Cl2, Br2) khi nung nóng để tạo thành muối halogenua:
Zr + 2Cl2 → ZrCl4
Phản ứng với dung dịch kiềm

Zirconi không tác dụng với dung dịch kiềm.
Ngoài ra, Zirconi còn có một số phản ứng khác như:
- Phản ứng với nước: Zr + 2H2O → ZrO2 + 2H2
- Phản ứng với CO2: Zr + CO2 → ZrO2 + C
Lưu ý:
- Zirconi là một kim loại tương đối trơ, cần nung nóng hoặc sử dụng chất xúc tác để đẩy nhanh phản ứng.
- Zirconi và các hợp chất của nó có thể gây hại cho sức khỏe, cần bảo quản và sử dụng cẩn thận.
Tồn tại và khai thác nguyên tố Zirconi
Tồn tại
- Zirconi là nguyên tố phổ biến thứ 14 trong vỏ Trái Đất, với hàm lượng khoảng 130 mg/kg.
- Nó tồn tại chủ yếu trong khoáng vật zircon ((Zr,Hf)SiO4).
- Zircon được tìm thấy trong các loại đá lửa, đá biến chất và trầm tích.
Khai thác
- Zircon được khai thác bằng phương pháp khai thác lộ thiên và khai thác hầm lò.
- Úc, Nam Phi, Trung Quốc và Brazil là những nhà sản xuất zircon lớn nhất.
Vấn đề an toàn khi sử dụng nguyên tố Zirconi
- Zirconi là kim loại hoạt động mạnh, do đó cần cẩn thận khi sử dụng và bảo quản.
- Bụi Zirconi có thể gây kích ứng da, mắt và hệ hô hấp.
- Zirconi và các hợp chất của nó có thể gây hại cho sức khỏe nếu tiếp xúc trực tiếp trong thời gian dài.
Chất lượng và phương thức cung cấp nguyên tố Zirconi
Chất lượng Zirconium
- Tính tinh khiết:
- Chất lượng Zirconium thường được đánh giá dựa trên mức độ tinh khiết của nó. Zirconium công nghiệp có thể chứa từ 90% đến 99,9% Zirconium, trong khi Zirconium dùng cho ứng dụng hạt nhân thường yêu cầu mức độ tinh khiết cao hơn, ít chứa tạp chất hafnium (Hf).
- Chứa tạp chất:
- Các tạp chất như hafnium (Hf), sắt (Fe), silic (Si), và niobium (Nb) có thể ảnh hưởng đến tính chất của Zirconium, do đó việc kiểm soát chúng là rất quan trọng.
- Chất lượng cấu trúc:
- Đối với một số ứng dụng, cấu trúc vi mô và độ tinh khiết của Zirconium cũng rất quan trọng, bao gồm độ tinh khiết của dạng tinh thể và sự đồng nhất của cấu trúc.
Phương thức cung cấp Zirconi
Zirconi có thể được cung cấp dưới dạng bột, hạt, thanh, tấm và ống. Các phương thức cung cấp phổ biến nhất bao gồm:
- Bột Zirconi: Dạng bột thường được sử dụng cho các ứng dụng gốm sứ và luyện kim.
- Hạt Zirconi: Dạng hạt thường được sử dụng cho các ứng dụng đúc và tạo khuôn.
- Thanh Zirconi: Dạng thanh thường được sử dụng cho các ứng dụng trong lò phản ứng hạt nhân.
- Tấm Zirconi: Dạng tấm thường được sử dụng cho các ứng dụng chống ăn mòn.
- Ống Zirconi: Dạng ống thường được sử dụng cho các ứng dụng trong trao đổi nhiệt.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Zirconi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Zirconi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







