Nguyên tố Xenon: Định nghĩa, tính chất, điều chế và ứng dụng
Trong bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá những tính chất độc đáo của nguyên tố Xenon, cũng như vai trò và ứng dụng
Xenon, nguyên tố hóa học với số nguyên tử 54, là một khí quý hiếm nổi tiếng với khả năng phát sáng đặc biệt và ứng dụng rộng rãi từ đèn pha ô tô đến lĩnh vực y tế. Trong bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá những tính chất độc đáo của Xenon, cũng như vai trò và ứng dụng của nó trong đời sống và công nghệ hiện đại.
Giới thiệu về nguyên tố Xenon
Định nghĩa
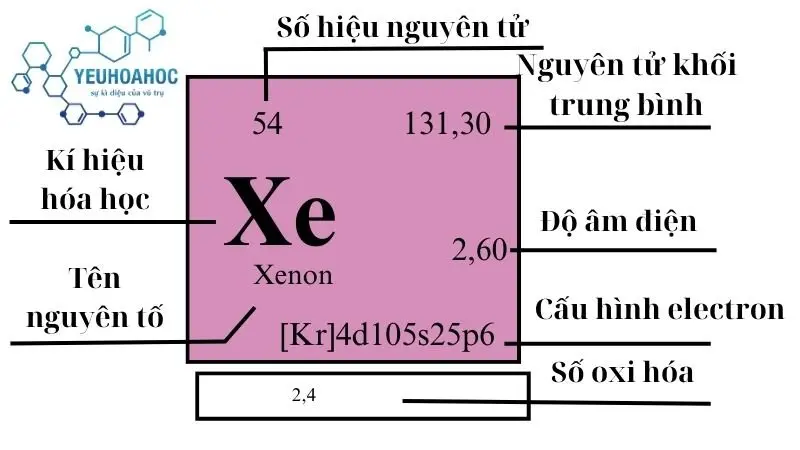
Nguyên tố Xenon, với tên tiếng Anh là “Xenon” và kí hiệu hóa học là Xe, là một nguyên tố hóa học thuộc nhóm các khí hiếm trong bảng tuần hoàn. Xenon nổi bật với đặc tính không màu, không mùi và cực kỳ trơ về mặt hóa học, khiến nó trở thành một trong những nguyên tố ít phản ứng nhất.
Lịch sử hình thành nguyên tố Xenon
- Năm 1898: William Ramsay và Morris Travers đã phát hiện ra Xenon trong phần khí còn lại sau khi hóa lỏng không khí.
- Tên gọi “Xenon” bắt nguồn từ tiếng Hy Lạp “xenos”, có nghĩa là “người lạ”, do tính trơ của nguyên tố này.
Một Số Mốc Thời Gian Quan Trọng
- 1898: Phát hiện nguyên tố Xenon bởi Ramsay và Travers.
- 1902: William Ramsay và Morris Travers xác định cấu trúc phân tử của Xenon (Xe).
- 1930: Harold Urey sử dụng Xenon để xác định độ tuổi của Trái Đất.
- 1962: Neil Bartlett tổng hợp hợp chất Xenon đầu tiên (XePtF6).
Nguyên tố Xenon trong bảng tuần hoàn hóa học
- Thuộc nhóm VIIIA (Khí hiếm)
- Chu kỳ 5
- Ô 54
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 18 | 5 | 131,293(6) | 0,005887 | 161,4 | 165,03 | 0,158 | 2,6 | <0,001 |
Tính chất của nguyên tố Xenon
Tính chất vật lý
- Dạng tồn tại: Khí, không màu, không mùi
- Nhiệt độ nóng chảy: -111,9 °C
- Nhiệt độ sôi: -108,5 °C
- Tỉ trọng: 5,89 g/L
- Độ tan:
- Rất ít tan trong nước
- Tan nhiều hơn trong dung môi hữu cơ
Tính chất hóa học
- Tính trơ: Xenon là một khí hiếm, do đó nó có tính trơ cao.
- Khó tác dụng với các chất khác: Xenon rất khó tác dụng với các chất khác.
- Có thể tạo thành một số hợp chất: Xenon có thể tạo thành một số hợp chất với các nguyên tố có tính oxi hóa mạnh, ví dụ như PtF6.
Lưu ý:
- Xenon là một khí trơ, do đó nó không gây nguy hiểm cho con người.
- Tuy nhiên, việc tiếp xúc với Xenon ở nồng độ cao có thể gây ra một số tác dụng phụ, ví dụ như buồn ngủ và chóng mặt.
Ứng dụng của nguyên tố Xenon

Chiếu sáng
Đèn pha ô tô: Xenon được sử dụng trong đèn pha ô tô vì nó có cường độ sáng cao và tuổi thọ dài.
Đèn flash chụp ảnh: Xenon được sử dụng trong đèn flash chụp ảnh vì nó có thể tạo ra ánh sáng mạnh, đồng đều.
Đèn soi: Xenon được sử dụng trong đèn soi để chiếu sáng các khu vực nhỏ, ví dụ như trong nha khoa và phẫu thuật.
Y tế
Máy gây mê: Xenon được sử dụng như một loại thuốc gây mê vì nó có tác dụng nhanh và ít gây tác dụng phụ.
Chụp MRI: Xenon được sử dụng trong chụp MRI để tăng cường độ tín hiệu của hình ảnh.
Điều trị ung thư: Xenon được sử dụng trong một số phương pháp điều trị ung thư, ví dụ như liệu pháp phóng xạ.
Nghiên cứu khoa học
Vật lý hạt: Xenon được sử dụng trong các thí nghiệm vật lý hạt để phát hiện các hạt cơ bản.
Hóa học: Xenon được sử dụng trong một số nghiên cứu hóa học, ví dụ như nghiên cứu về các hợp chất mới.
Khoa học vật liệu: Xenon được sử dụng trong một số ứng dụng khoa học vật liệu, ví dụ như sản xuất các lớp phủ mỏng.
Các ứng dụng khác
Đèn laser: Xenon được sử dụng trong một số loại đèn laser.
Hàn laser: Xenon được sử dụng trong hàn laser để tạo ra mối hàn có độ chính xác cao.
Khí nén: Xenon được sử dụng trong một số loại khí nén.
Điều chế và sản xuất nguyên tố Xenon
Điều chế
Điều chế trong phòng thí nghiệm
Phương pháp hóa học:
- Khử KNO₃ bằng H₂SO₄ đặc:
2KNO₃ + H₂SO₄ → K₂SO₄ + 2HNO₃
- Phân hủy HNO₃:
4HNO₃ → 2H₂O + 4NO₂ + O₂
- Khử NO₂ bằng Cu:
2NO₂ + Cu → CuO + 2NO
- Hấp thụ NO vào nước:
2NO + O₂ → 2NO₂
- Hấp thụ NO₂ vào dung dịch NaOH:
2NaOH + 2NO₂ → NaNO₂ + NaNO₃ + H₂O
- Điện phân dung dịch NaNO₃:
2NaNO₃ + 2H₂O → 2NaOH + H₂ + O₂ + Xe
Điều chế trong công nghiệp
Phương pháp tách khí:
-
- Xenon được tách từ khí lỏng sau khi hóa lỏng không khí.
- Quá trình tách dựa trên sự khác biệt về điểm sôi của các khí.
Sản xuất
Xenon được sản xuất chủ yếu từ khí lỏng sau khi hóa lỏng không khí.
Quá trình sản xuất bao gồm các bước sau:
-
- Hóa lỏng không khí
- Tách nitơ và oxy
- Tách argon
- Tách krypton và xenon
Xenon là một khí hiếm, do đó sản lượng cũng thấp.
Các nhà sản xuất Xenon lớn nhất thế giới là Pháp, Đức, và Hoa Kỳ.
Phản ứng của nguyên tố Xenon
Xenon là một khí hiếm, do đó nó có tính trơ cao và rất khó tác dụng với các chất khác. Tuy nhiên, trong một số điều kiện nhất định, Xenon có thể tham gia vào một số phản ứng hóa học.
- Phản ứng với Flo:

Xenon có thể phản ứng với Flo ở nhiệt độ cao (trên 400 °C) để tạo thành Xenon hexafluoride (XeF6). Đây là hợp chất Xenon đầu tiên được tổng hợp.
Phương trình phản ứng:
Xe + 3F2 → XeF6
- Phản ứng với Oxy:
Xenon có thể phản ứng với Oxy ở áp suất cao và nhiệt độ cao (trên 500 °C) để tạo thành Xenon trioxide (XeO3).
Phương trình phản ứng:
Xe + 3O2 → XeO3
- Phản ứng với nước:
Xenon có thể tan trong nước, nhưng không phản ứng với nước.
- Phản ứng với axit:
Xenon không phản ứng với axit.
- Phản ứng với bazơ:
Xenon không phản ứng với bazơ.
Lưu ý:
- Các phản ứng của Xenon thường xảy ra ở nhiệt độ cao hoặc áp suất cao.
- Xenon là một khí trơ, do đó nó không gây nguy hiểm cho con người.
- Tuy nhiên, việc tiếp xúc với Xenon ở nồng độ cao có thể gây ra một số tác dụng phụ, ví dụ như buồn ngủ và chóng mặt.
Vấn đề an toàn khi sử dụng nguyên tố Xenon
Ngạt thở:
Xenon là một khí trơ và không hỗ trợ hô hấp. Hít phải nồng độ Xenon cao có thể dẫn đến ngạt thở.
Gây mê:
Xenon có thể gây ra tác dụng gây mê ở nồng độ cao. Điều này có thể dẫn đến mất ý thức và mất kiểm soát cơ thể.
Nguy cơ cháy nổ:
Xenon là một khí dễ cháy. Khi trộn với oxy, nó có thể tạo thành hỗn hợp dễ nổ.
Cách bảo vệ bản thân khi sử dụng Xenon:
- Đảm bảo thông gió đầy đủ khi sử dụng Xenon.
- Tránh hít phải trực tiếp Xenon.
- Tránh sử dụng Xenon trong không gian kín.
- Tránh sử dụng Xenon gần nguồn lửa hoặc tia lửa.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Xenon mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Xenon. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







