Nguyên tố Vanadi: Khái niệm, tính chất và ứng dụng
Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Vanadi, bao gồm định nghĩa, ứng dụng, điều chế, và vấn đề an toàn
Vanadi là một kim loại màu trắng xám, có tính chất tương tự như titanium và chrom. Nó có nhiều ứng dụng trong công nghiệp và công nghệ, bao gồm sản xuất thép hợp kim, ống đạn, và các loại hợp kim chịu lực. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Vanadi, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Vanadi
Định nghĩa
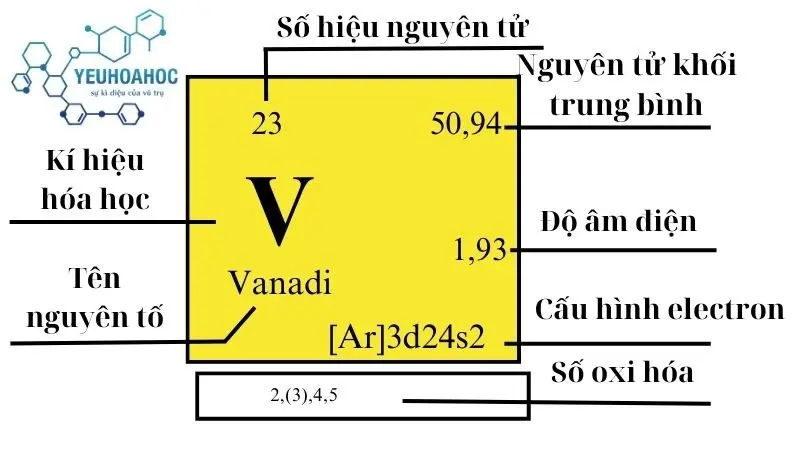
Vanadi là một nguyên tố hóa học quan trọng tên tiếng anh là Vanadium, có ký hiệu là V và số nguyên tử là 23 trong bảng tuần hoàn. Nổi tiếng với độ cứng và khả năng chịu nhiệt, vanadi được sử dụng rộng rãi trong nhiều ứng dụng công nghiệp và khoa học, bao gồm việc cải thiện độ bền và chất lượng của thép và các hợp kim khác.
Lịch sử hình thành nguyên tố Vanadi
Lịch sử phát hiện và nghiên cứu vanadi bắt đầu từ thế kỷ 19, khi nó được phát hiện lần đầu tiên bởi nhà khoa học Tây Ban Nha Andrés Manuel del Río vào năm 1801. Tuy nhiên, do một số hiểu nhầm, nguyên tố này không được công nhận ngay lập tức. Phải đến năm 1831, nhà khoa học Thụy Điển Nils Gabriel Sefström mới tái phát hiện vanadi và chính thức đặt tên cho nó, dựa trên tên của nữ thần Scandinavia, Vanadis, do màu sắc rực rỡ của các hợp chất của nó.
Một số mốc thời gian quan trọng trong lịch sử phát hiện
- Thế kỷ 18: Andrés Manuel del Río, nhà khoáng vật học người Tây Ban Nha, phát hiện ra một khoáng vật mới ở Mexico và đặt tên nó là “erythronium”.
- 1831: Friedrich Wöhler, nhà hóa học người Đức, xác định thành phần chính của erythronium là một nguyên tố mới và đặt tên nó là “vanadi”, theo tên Vanadis – nữ thần sắc đẹp và tình yêu trong thần thoại Bắc Âu.
- Thế kỷ 20: Kỹ thuật sản xuất Vanadi được phát triển, mở ra tiềm năng ứng dụng rộng rãi của kim loại này
Tầm quan trọng của nguyên tố Vanadi trong đời sống
Vanadi đóng một vai trò không thể thiếu trong công nghiệp thép, nơi nó được thêm vào để tăng cường độ cứng và độ bền của thép. Hợp kim vanadi được sử dụng trong các ứng dụng đòi hỏi vật liệu có độ bền cao như trục xe, dụng cụ cắt, và trong ngành hàng không. Ngoài ra, vanadi cũng là một thành phần quan trọng trong việc sản xuất pin, đặc biệt là trong pin vanadi dạng lưu trữ năng lượng, cung cấp một giải pháp bền vững cho việc lưu trữ năng lượng tái tạo.
Nguyên tố Vanadi trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn, vanadi thuộc nhóm 5 và là một phần của dãy chuyển tiếp. Đặc tính chính của vanadi là sự đa dạng trong trạng thái oxi hóa, cho phép nó tạo ra một loạt các hợp chất hóa học với các tính chất khác nhau
- Thuộc nhóm 5, chu kỳ 4 trong bảng tuần hoàn hóa học.
- Số nguyên tử: 23
- Cấu hình electron: [Ar]3d³4s²
- Khối lượng nguyên tử: 50,9415 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 5 | 4 | 50,9415(1) | 6,11 | 2183 | 3680 | 0,489 | 1,63 | 120 |
Tính chất của nguyên tố Vanadi
Tính chất vật lý
- Màu sắc: Xám bạc
- Trạng thái: Rắn
- Khối lượng riêng: 6,11 g/cm³
- Điểm nóng chảy: 1910 °C
- Điểm sôi: 3407 °C
- Độ bền: Cao, gấp 5 lần thép
- Tính dẻo dai: Dễ dàng gia công thành nhiều hình dạng khác nhau
- Khả năng chống ăn mòn: Tốt, có thể chịu được nước biển, axit và nhiều hóa chất khác
- Độ dẫn điện: Kém
- Độ dẫn nhiệt: Kém
Tính chất hóa học
- Cấu hình electron: [Ar]3d³4s²
- Số nguyên tử: 23
- Hóa trị: +2, +3, +4, +5
- Tính khử: Yếu
- Tính oxi hóa: Mạnh
- Tác dụng với axit:
- Tan trong axit nitric đặc, axit sunfuric đặc
- Không tan trong axit clohydric loãng
- Tác dụng với bazơ: Không tác dụng
- Tác dụng với dung dịch muối:
- Khử được một số ion kim loại như Fe²⁺, Cu²⁺
- Tác dụng với phi kim:
- Tác dụng với oxy ở nhiệt độ cao
- Tác dụng với nitơ ở nhiệt độ cao
- Tác dụng với clo ở nhiệt độ cao
Ứng dụng của nguyên tố Vanadi

Vanadi (V) là một kim loại chuyển tiếp có nhiều ứng dụng quan trọng trong nhiều lĩnh vực. Nhờ những tính chất ưu việt như độ bền cao, khả năng chống ăn mòn tốt, trọng lượng nhẹ và dẻo dai, Vanadi được sử dụng rộng rãi trong các ngành công nghiệp sau:
- Hợp kim:
Vanadi là thành phần quan trọng trong nhiều hợp kim có độ bền cao, chịu nhiệt tốt và chống ăn mòn như hợp kim thép, hợp kim titan, hợp kim nhôm.
Ví dụ:
- Thép vanadi được sử dụng trong chế tạo máy móc, dụng cụ, công trình xây dựng.
- Hợp kim chứa titan và vanadi được ứng dụng trong lĩnh vực hàng không và vũ trụ..
- Hợp kim nhôm-vanadi được sử dụng trong ngành công nghiệp ô tô.
- Pin nhiên liệu:
- Vanadi được sử dụng làm điện cực trong pin nhiên liệu vanadi.
- Pin nhiên liệu vanadi là một loại pin nhiên liệu có hiệu suất cao, tuổi thọ dài và thân thiện với môi trường.
- Y tế:
- Vanadi được sử dụng trong một số hợp chất y tế để điều trị bệnh tiểu đường và loãng xương.
- Ví dụ:
- Vanadyl sulfate được sử dụng để điều trị bệnh tiểu đường tuýp 2.
- Vanadium pentoxide được sử dụng để điều trị loãng xương.
- Ngành công nghiệp khác:
- Vanadi được sử dụng trong sản xuất hóa chất, xi mạ, và các ngành công nghiệp khác.
- Ví dụ:
- Vanadi được sử dụng làm xúc tác trong sản xuất hóa chất.
- Vanadi được sử dụng làm lớp phủ chống ăn mòn trong ngành xi mạ.
Điều chế và sản xuất nguyên tố Vanadi
Điều chế Vanadi trong phòng thí nghiệm
Trong môi trường phòng thí nghiệm, Vanadi có thể được điều chế thông qua phản ứng giữa các hợp chất của nó với các chất khử. Một phương pháp phổ biến là sử dụng aluminum để khử V₂O₅ (oxit Vanadi) trong điều kiện nhiệt độ cao để thu được Vanadi kim loại:
Phản ứng:
2Al+V2O5→2VO+2Al2O3
Phản ứng này thường được tiến hành trong lò nung ở nhiệt độ cao, và Vanadi kim loại thu được sau đó được lọc để loại bỏ tạp chất.
Điều chế Vanadi trong công nghiệp
Trong sản xuất công nghiệp, Vanadi thường được thu hồi từ quặng chứa Vanadi như vanadinit (Pb₅(VO₄)₃Cl) và carnotit (K₂(UO₂)₂(VO₄)₂·3H₂O) thông qua một loạt các quy trình hóa học và luyện kim.
1. Chiết Xuất Vanadi từ Quặng
- Lixivi hóa: Quặng vanadi được nghiền nhỏ và lixivi hóa bằng axit sunfuric hoặc bằng cách đốt cháy trong không khí để chuyển vanadi trong quặng thành dạng hòa tan.
- Chiết xuất hợp chất Vanadi: Các hợp chất vanadi sau đó được chiết xuất từ dung dịch bằng cách thêm chất khử như magiê hoặc natri, dẫn đến sự kết tủa của oxit vanadi.
2. Chuyển Đổi Oxit Vanadi thành Vanadi Kim Loại
- Khử Oxit Vanadi: Oxit vanadi thu được (thường là V₂O₅) sau đó được khử bằng cacbon, aluminum hoặc silic ở nhiệt độ cao trong lò nung điện hồ quang để sản xuất vanadi kim loại.
Sản xuất
Quá trình sản xuất Vanadi bao gồm các bước sau:
- Khai thác quặng Vanadi:
- Quặng Vanadi phổ biến nhất là ilmenit và rutil.
- Quặng được khai thác từ mỏ hoặc bãi cát ven biển.
- Luyện kim:
- Quặng Vanadi được nghiền nhỏ và xử lý bằng axit để chiết xuất VCl4.
- VCl4 được khử bằng Mg để tạo ra V dạng xốp.
- V xốp được nung nóng trong chân không để loại bỏ Mg dư.
- Gia công:
- V dạng xốp được nung chảy và đúc thành các hình dạng khác nhau như thanh, tấm, ống…
- V có thể được gia công bằng các phương pháp như cán, rèn, hàn…
Phản ứng của nguyên tố Vanadi
Nguyên tố Vanadi (V) tham gia vào nhiều phản ứng hóa học khác nhau do khả năng thay đổi trạng thái oxi hóa của nó.
Phản ứng với Oxy
Vanadi phản ứng với oxy tạo thành nhiều dạng oxit khác nhau tùy thuộc vào điều kiện phản ứng:
Khi nung nóng ở nhiệt độ cao trong không khí, Vanadi tạo thành V₂O₅ (pentoxit vanadi)
4V+5O2→2V2O5
Phản ứng với Axit
Vanadi cũng phản ứng với một số axit, tùy thuộc vào trạng thái oxi hóa và điều kiện phản ứng:
Với axit clohiđric (HCl), Vanadi có thể tạo thành vanadi(III) clorua (VCl₃):
2V+6HCl→2VCl3+3H2
Khi phản ứng với axit sunfuric đặc (H₂SO₄), có thể tạo ra vanadi(V) sunfat (V₂(SO₄)₅):
V2O5+2H2SO4→V2(SO4)5+H2O
Phản ứng với Các Kim Loại
Vanadi có thể tạo thành các hợp kim với nhiều kim loại khác như sắt, nhôm và titanium, cải thiện độ bền và tính chất của chúng. Phản ứng hợp kim hóa không có phương trình hóa học cụ thể nhưng thường diễn ra ở nhiệt độ cao trong lò luyện kim.
Phản ứng trong trạng thái Oxi hóa
Vanadi độc đáo ở chỗ nó có thể tồn tại ở nhiều trạng thái oxi hóa khác nhau trong dung dịch, từ +2 đến +5, cho phép nó tham gia vào các phản ứng oxi hóa-khử. Một ví dụ phổ biến là sự chuyển đổi giữa các trạng thái oxi hóa trong pin vanadi redox, nơi V(II) được oxi hóa thành V(III) và V(V) được khử thành V(IV):
Oxi hóa: V2+→V3++e−
Khử: V5++e−→V4+
Phản ứng với nước
Trong điều kiện tiêu chuẩn, Vanadi không phản ứng trực tiếp với nước, nhưng các ion vanadi trong dung dịch có thể tương tác với nước tạo ra các dạng hydrolyzed phức tạp, đặc biệt ở trạng thái oxi hóa cao.
Tồn tại và khai thác nguyên tố Vanadi
Nguyên tố Vanadi (V) tồn tại chủ yếu dưới dạng các hợp chất trong tự nhiên và được tìm thấy trong nhiều loại khoáng vật. Khai thác và sản xuất Vanadi đòi hỏi quy trình tinh chế phức tạp để chuyển đổi từ quặng chứa Vanadi thành Vanadi kim loại hoặc các hợp chất của nó sử dụng trong công nghiệp.
Tồn tại của Vanadi
Vanadi không tồn tại dưới dạng nguyên tố tự do trong tự nhiên do tính chất hoạt động hóa học của nó. Thay vào đó, nó được tìm thấy dưới dạng các hợp chất trong các loại quặng như:
- Vanadinit (Pb₅(VO₄)₃Cl): Một khoáng vật chứa Vanadi phổ biến, chứa chì và clor cùng với Vanadi.
- Carnotit (K₂(UO₂)₂(VO₄)₂·3H₂O): Một khoáng vật urani-vanadi có màu vàng, thường được tìm thấy trong các tầng trầm tích.
- Patronit (VS₄): Một hợp chất lưu huỳnh và Vanadi tìm thấy chủ yếu ở Venezuela.
Khai thác Vanadi
Quá trình khai thác Vanadi bắt đầu bằng việc xác định và khai thác các quặng chứa Vanadi. Phương pháp khai thác thường phụ thuộc vào loại quặng và vị trí của nó. Sau khi khai thác, quặng được xử lý để trích xuất Vanadi.
Vấn đề an toàn khi sử dụng nguyên tố Vanadi
Vanadi là một kim loại tương đối an toàn khi sử dụng, nhưng cũng có một số nguy cơ tiềm ẩn cần lưu ý:
Hít phải
- Hít phải bụi Vanadi có thể gây kích ứng đường hô hấp, dẫn đến ho, khó thở và đau ngực.
- Nguy cơ này cao hơn đối với những người làm việc với Vanadi, chẳng hạn như công nhân khai thác mỏ và công nhân nhà máy.
Tiếp xúc da
- Tiếp xúc da với Vanadi có thể gây kích ứng da, dẫn đến mẩn đỏ, ngứa và phát ban.
- Những người có da nhạy cảm có thể dễ bị ảnh hưởng hơn.
Nuốt phải
- Nuốt phải Vanadi có thể gây buồn nôn, nôn và tiêu chảy.
- Trong trường hợp nghiêm trọng, có thể dẫn đến tổn thương thận và gan.
Nguy cơ ung thư
- Một số nghiên cứu cho thấy Vanadi có thể gây ung thư phổi ở người.
- Tuy nhiên, cần thêm nhiều nghiên cứu để xác định mối liên hệ nguyên nhân và kết quả.
Lưu trữ và xử lý an toàn
- Vanadi và các hợp chất của nó nên được lưu trữ trong các b containers, xa khỏi các chất oxi hóa mạnh và trong môi trường khô ráo, thoáng mát. Khi xử lý, cần thực hiện trong tủ hút khí hoặc khu vực được thông gió tốt để giảm thiểu rủi ro hít phải hơi hoặc bụi.
Xử lý sự cố rò rỉ hoặc đổ vỡ
- Trong trường hợp xảy ra sự cố rò rỉ hoặc đổ vỡ, cần phải thực hiện các biện pháp phản ứng khẩn cấp phù hợp để hạn chế sự phơi nhiễm và ngăn chặn sự lan tỏa của chất độc. Sử dụng phương tiện bảo vệ cá nhân và tuân theo các quy trình an toàn đã được thiết lập.
Biện pháp phòng ngừa
- Để giảm thiểu nguy cơ khi sử dụng Vanadi, cần thực hiện các biện pháp phòng ngừa sau:
- Hạn chế tiếp xúc với Vanadi, đặc biệt là bụi Vanadi.
- Sử dụng thiết bị bảo hộ cá nhân như khẩu trang, găng tay và quần áo bảo hộ khi làm việc với Vanadi.
- Rửa tay kỹ lưỡng sau khi tiếp xúc với Vanadi.
Chất lượng nguyên tố

Vanadi được cung cấp dưới nhiều dạng khác nhau, bao gồm:
Bột: Dạng bột Vanadi thường được sử dụng trong các ứng dụng hóa học.
Thanh: Vanadi dạng thanh được sử dụng trong các ứng dụng hợp kim.
Tấm: Vanadi dạng tấm được sử dụng trong các ứng dụng công nghiệp.
Dây: Vanadi dạng dây được sử dụng trong các ứng dụng điện.
Độ tinh khiết: Vanadi có thể được cung cấp ở nhiều mức độ tinh khiết khác nhau, tùy thuộc vào ứng dụng. Ví dụ, Vanadi sử dụng trong ngành công nghiệp y tế và hàng không vũ trụ thường đòi hỏi mức độ tinh khiết cao hơn so với Vanadi sử dụng trong sản xuất thép.
Dạng vật lý: Vanadi có thể được cung cấp dưới dạng bột, tấm, cục, hoặc dạng hợp kim, tùy thuộc vào ứng dụng cuối cùng.
Tạp chất: Mức độ và loại tạp chất trong Vanadi có thể ảnh hưởng đến chất lượng và ứng dụng của nó. Các nhà sản xuất thường cung cấp thông tin chi tiết về tạp chất có trong sản phẩm.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Vanadi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Vanadi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







