Nguyên tố Terbi: Ứng dụng tính chất và lịch sử hấp dẫn
Bạn đọc hãy cùng yeuhoahoc.edu.vn đi sâu vào tìm hiểu về định nghĩa, lịch sử và vị trí của nguyên tố Terbium trong bảng tuần hoàn hóa học.
Trong thế giới rộng lớn của hóa học, nguyên tố Terbium tựa như một viên ngọc quý hiếm, chứa đựng nhiều tiềm năng chưa được khai phá hết. Với những đặc tính kỳ diệu và ứng dụng vượt trội, Terbium đã và đang trở thành một trong những nguyên tố được săn đón nhất. Bạn đọc hãy cùng yeuhoahoc.edu.vn đi sâu vào tìm hiểu về định nghĩa, lịch sử và vị trí của Terbium trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Terbi
Định nghĩa
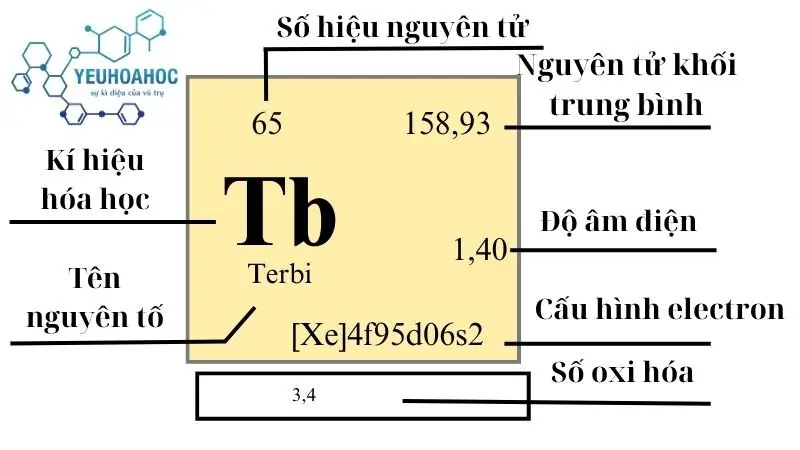
Nguyên tố Terbi có tên tiếng anh là Terbium, được biểu diễn qua kí hiệu “Tb” và có số hiệu nguyên tử là 65, là một phần của nhóm lantanit trong bảng tuần hoàn hóa học. Terbium nổi bật với các tính chất từ tính, quang học và điện học đặc biệt, làm cho nó trở thành nguyên tố không thể thiếu trong nhiều ứng dụng công nghệ cao.
Lịch sử hình thành nguyên tố Terbi
1843: Carl Gustaf Mosander phát hiện ra terbia, một oxit của nguyên tố mới.
1879: Jean Charles Galissard de Marignac phân tích terbia và xác định nguyên tố mới, terbi.
1935: Wilhelm Klemm và Hans Bommer lần đầu tiên điều chế terbi kim loại.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1843: Carl Gustaf Mosander phát hiện ra terbia.
- 1879: Jean Charles Galissard de Marignac xác định nguyên tố terbi.
- 1935: Wilhelm Klemm và Hans Bommer điều chế terbi kim loại.
- 1960: Terbi được sử dụng lần đầu tiên trong laser.
- 1970: Terbi được sử dụng trong các hợp kim để cải thiện độ bền và khả năng chống ăn mòn.
Nguyên tố Terbi trong bảng tuần hoàn hóa học
- Thuộc nhóm: 3
- Chu kỳ: 6
- Khối lượng nguyên tử: 158,92534 u
Trong bảng tuần hoàn, Terbium nằm ở nhóm lantanit, thuộc dãy nguyên tố đất hiếm. Đặc tính nổi bật của Terbium bao gồm khả năng phát quang mạnh mẽ khi tiếp xúc với ánh sáng tia cực tím, cùng với đó là tính từ tính đặc biệt, giúp nó trở thành nguyên tố quan trọng trong sản xuất đèn cực tím, thiết bị điện tử, và các loại laser.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 6 | 158,92535(2) | 8,229 | 1629 | 3503 | 0,182 | 1,2 | 1,2 |
Tính chất của nguyên tố Terbi
Tính chất vật lý
- Trạng thái: rắn
- Màu sắc: trắng bạc
- Cấu trúc tinh thể: lục phương
- Khối lượng riêng: 8,23 g/cm³
- Nhiệt độ nóng chảy: 1356 °C
- Nhiệt độ sôi: 3230 °C
- Độ dẫn điện: tốt
- Độ dẫn nhiệt: tốt
- Tính dẻo: cao
- Tính dễ uốn: cao
Tính chất hóa học
- Trạng thái oxy hóa: +3, +4
- Tính khử: trung bình
- Phản ứng với oxy: phản ứng chậm với oxy trong không khí tạo thành terbi(III) oxit (Tb2O3)
- Phản ứng với nước: phản ứng chậm với nước tạo thành terbi(III) hydroxit (Tb(OH)3)
- Phản ứng với axit: tan trong axit loãng tạo thành muối terbi(III)
- Phản ứng với halogen: phản ứng với halogen (như Cl2, Br2, I2) tạo thành muối terbi(III) halide
- Tính bền: tương đối bền trong không khí và nước
Một số tính chất đặc biệt khác:
- Terbi có tính từ sắt từ ở nhiệt độ thấp.
- Terbi có khả năng phát quang màu xanh lục khi được kích thích bởi bức xạ tia tử ngoại.
Ứng dụng của nguyên tố Terbi
Laser
- Terbi được sử dụng trong laser để tạo ra ánh sáng xanh lục. Ánh sáng xanh lục từ laser terbi có nhiều ứng dụng trong y học, khoa học và công nghiệp.
- Ví dụ: laser terbi được sử dụng trong phẫu thuật để cắt bỏ các mô, trong nghiên cứu khoa học để phân tích vật liệu và trong công nghiệp để chế tạo các thiết bị điện tử.
Hợp kim
- Terbi được sử dụng trong các hợp kim để cải thiện độ bền và khả năng chống ăn mòn.
- Ví dụ: hợp kim terbi-cobalt được sử dụng trong các nam châm vĩnh cửu, hợp kim terbi-nhôm được sử dụng trong các động cơ máy bay và hợp kim terbi-zirconium được sử dụng trong các lò phản ứng hạt nhân.
Thiết bị điện tử
- Terbi được sử dụng trong các thiết bị điện tử như bóng bán dẫn và pin.
- Ví dụ: terbi được sử dụng trong bóng bán dẫn để tăng hiệu quả chuyển đổi điện năng và trong pin để cải thiện dung lượng lưu trữ.
Y học
- Terbi được sử dụng trong y học để chẩn đoán và điều trị ung thư.
- Ví dụ: hợp chất terbi được sử dụng để tạo ra các chất tương phản MRI giúp phát hiện ung thư và tia X-quang để điều trị ung thư.
Nghiên cứu khoa học
- Terbi được sử dụng trong các nghiên cứu khoa học về cấu trúc vật chất và tính chất vật liệu.
- Ví dụ: terbi được sử dụng để nghiên cứu cấu trúc của các protein và để phát triển các vật liệu mới có tính năng cao.
Điều chế và sản xuất nguyên tố Terbi

Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp khử ion kim loại:
- Điện phân dung dịch muối terbi(III) (như TbCl3) với điện cực catôt là kim loại thủy ngân.
- Phản ứng khử terbi(III) oxit (Tb2O3) bằng hydro hoặc kim loại kali.
Phương trình điều chế:
- Điện phân: TbCl3 + 3e- → Tb + 3Cl-
- Khử oxit: Tb2O3 + 3H2 → 2Tb + 3H2O
- Khử oxit: Tb2O3 + 6K → 2Tb + 3K2O
Điều chế trong công nghiệp
- Phương pháp chiết xuất dung môi:
- Chiết xuất terbi từ quặng monazit hoặc bastnäsit bằng dung môi hữu cơ.
- Lọc và tinh chế dung dịch terbi để thu được terbi tinh khiết.
Phương trình điều chế:
- Chiết xuất: TbCl3 + 3HA → TbA3 + 3HCl (HA là dung môi hữu cơ)
Sản xuất
- Terbi được sản xuất chủ yếu từ quặng monazit và bastnäsit.
- Quặng được nghiền nhỏ và xử lý bằng axit để hòa tan các kim loại đất hiếm.
- Dung dịch sau đó được chiết xuất bằng dung môi hữu cơ để thu được terbi.
- Terbi tinh khiết được thu được bằng cách lọc và tinh chế dung dịch.
Phản ứng của nguyên tố Terbi
Phản ứng với axit
Terbi tan trong axit loãng tạo thành muối terbi(III). Ví dụ:
Tb + 3HCl → TbCl3 + 3H2
Tb + 2H2SO4 → Tb2(SO4)3 + 3H2
Phản ứng với oxy
Terbi phản ứng với oxy trong không khí tạo thành terbi(III) oxit:
4Tb + 3O2 → 2Tb2O3
Phản ứng với nước
Terbi phản ứng chậm với nước tạo thành terbi(III) hydroxit:
2Tb + 3H2O → 2Tb(OH)3 + 3H2
Phản ứng với halogen
Terbi phản ứng với halogen (như Cl2, Br2, I2) tạo thành muối terbi(III) halide:
2Tb + 3Cl2 → 2TbCl3
2Tb + 3Br2 → 2TbBr3
2Tb + 3I2 → 2TbI3
Phản ứng với dung dịch kiềm
Terbi tan trong dung dịch kiềm tạo thành hydroxit terbi(III):
Tb + 3NaOH → Tb(OH)3 + 3Na
Ví dụ cụ thể:
- Terbi phản ứng với axit hydrochloric:
Phương trình:
Tb + 3HCl → TbCl3 + 3H2
Điều kiện:
- Nhiệt độ phòng
- Dung dịch axit hydrochloric loãng
Hiện tượng:
- Kim loại terbi tan dần, có khí thoát ra là khí hydro.
- Dung dịch sau phản ứng có màu vàng nhạt.
- Terbi phản ứng với oxy:
Phương trình:
4Tb + 3O2 → 2Tb2O3
Điều kiện:
- Nhiệt độ cao
Hiện tượng:
- Kim loại terbi cháy sáng trong không khí, tạo thành lớp oxit màu trắng.
Vấn đề an toàn khi sử dụng nguyên tố Terbi
Độc tính
- Terbi có thể gây ra độc tính nếu tiếp xúc với lượng lớn.
- Các triệu chứng ngộ độc terbi bao gồm buồn nôn, nôn, tiêu chảy, đau bụng, yếu cơ và co giật.
- Cần phải cẩn thận khi sử dụng terbi và tuân thủ các biện pháp an toàn để tránh ngộ độc.
Dị ứng
- Một số người có thể bị dị ứng với terbi.
- Các triệu chứng dị ứng terbi bao gồm phát ban, ngứa, sưng tấy và khó thở.
- Nếu bạn có bất kỳ triệu chứng dị ứng nào sau khi tiếp xúc với terbi, hãy ngừng sử dụng terbi và đến gặp bác sĩ ngay lập tức.
Nguy cơ môi trường
- Terbi có thể gây hại cho môi trường nếu thải ra môi trường không được kiểm soát.
- Cần phải xử lý chất thải terbi theo đúng quy định để bảo vệ môi trường.
Biện pháp an toàn
- Khi sử dụng terbi, cần phải tuân thủ các biện pháp an toàn sau:
- Mang găng tay, khẩu trang và kính bảo hộ khi tiếp xúc với terbi.
- Hãy tránh để da và mắt tiếp xúc trực tiếp..
- Làm việc trong khu vực thông gió tốt.
- Rửa tay kỹ sau khi tiếp xúc với terbi.
- Bảo quản terbi trong hộp kín ở nơi khô ráo, thoáng mát.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Terbi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Terbi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







