Nguyên tố Tantali: Định nghĩa, vai trò và lịch sử bí ẩn
Bài viết này yeuhoahoc.edu.vn sẽ đưa bạn đi từ định nghĩa cơ bản đến lịch sử hình thành, vị trí của nguyên tố Tantali trong bảng tuần hoàn hóa học
Nguyên tố Tantali là một trong những nguyên tố hóa học quý hiếm, nổi bật với nhiều tính chất đặc biệt và ứng dụng quan trọng trong công nghệ và công nghiệp. Bài viết này yeuhoahoc.edu.vn sẽ đưa bạn đi từ định nghĩa cơ bản đến lịch sử hình thành và vị trí của Tantali trong bảng tuần hoàn hóa học, giúp bạn hiểu rõ hơn về nguyên tố bí ẩn này
Giới thiệu về nguyên tố Tantali
Định nghĩa
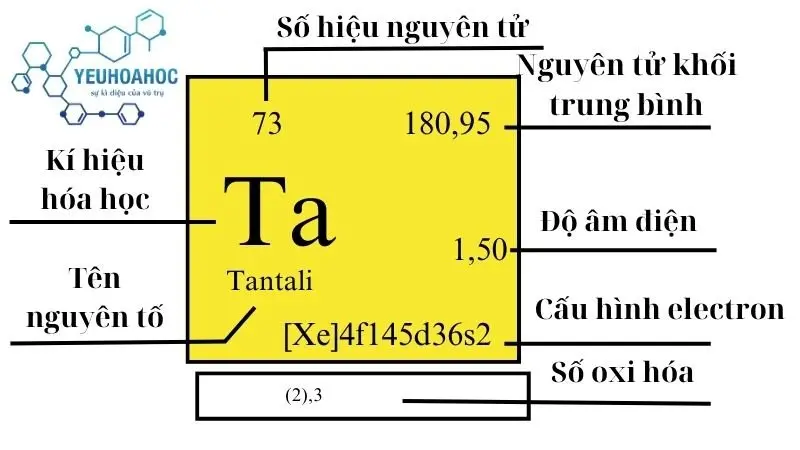
Tantali (tên tiếng Anh: Tantalum, ký hiệu: Ta) là một nguyên tố hóa học có số nguyên tử 73. Nó là một kim loại chuyển tiếp màu xám, cứng và có khả năng chống ăn mòn cao. Tantali được xếp vào nhóm VB trong bảng tuần hoàn hóa học.
Lịch sử hình thành nguyên tố Tantali
1802: Anders Gustaf Ekeberg, nhà hóa học người Thụy Điển, phát hiện ra Tantali trong khoáng vật columbite.
1802: William Hyde Wollaston, nhà hóa học người Anh, cũng phát hiện ra Tantali trong khoáng vật tantalite.
1844: Heinrich Rose, nhà hóa học người Đức, đặt tên cho nguyên tố này là Tantali theo tên Tantalus, một vị vua trong thần thoại Hy Lạp.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1802: Anders Gustaf Ekeberg và William Hyde Wollaston phát hiện ra Tantali.
- 1844: Heinrich Rose đặt tên cho nguyên tố này là Tantali.
- 1903: William Coolidge sử dụng Tantali để làm dây tóc bóng đèn.
- 1922: Tantali được sử dụng trong các tụ điện tantalum.
- 1950: Tantali được sử dụng trong các hợp kim chịu nhiệt.
- 1970: Tantali được sử dụng trong các thiết bị y tế.
Nguyên tố Tantali trong bảng tuần hoàn hóa học
- Ký hiệu: Ta
- Số nguyên tử: 73
- Cấu hình electron: [Xe] 4f14 5d3 6s2
- Khối lượng nguyên tử: 180,94788 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 5 | 6 | 180,94788(2) | 16,654 | 3290 | 5731 | 0,14 | 1,5 | 2 |
Tính chất của nguyên tố Tantali
Tính chất vật lý
- Màu sắc: Xám
- Trạng thái: Rắn
- Cấu trúc tinh thể: Lập phương tâm khối
- Khối lượng riêng: 16,65 g/cm³
- Điểm nóng chảy: 2996 °C
- Điểm sôi: 5425 °C
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
- Tính dẻo: Dẻo
- Độ cứng: Cứng
- Khả năng chống ăn mòn: Cao
Tính chất hóa học
- Hóa trị: +5, +4
- Tính khử: Trung bình
- Tính oxi hóa: Yếu
- Phản ứng với axit: Phản ứng với axit loãng để tạo thành muối tantali
- Phản ứng với bazơ: Không phản ứng với bazơ
- Phản ứng với nước: Không phản ứng với nước
- Phản ứng với oxy: Phản ứng với oxy ở nhiệt độ cao để tạo thành oxit tantali
Một số hợp chất quan trọng của Tantali
- Tantali(V) chloride (TaCl5): Chất rắn màu vàng, tan trong nước
- Tantali(V) fluoride (TaF5): Chất rắn màu trắng, tan trong nước
- Tantali(V) oxit (Ta2O5): Chất rắn màu trắng, không tan trong nước
- Tantali(V) hydroxide (Ta(OH)5): Chất rắn màu trắng, không tan trong nước
Ứng dụng của nguyên tố Tantali

Điện tử
- Tụ điện: Tantali được sử dụng để sản xuất tụ điện tantalum, có kích thước nhỏ, dung lượng lớn và tuổi thọ cao. Tụ điện tantalum được sử dụng trong nhiều thiết bị điện tử như điện thoại di động, máy tính xách tay và máy ảnh kỹ thuật số.
- Điện trở: Tantali được sử dụng để sản xuất điện trở tantalum có độ chính xác cao và độ ổn định cao. Điện trở tantalum được sử dụng trong các thiết bị điện tử như mạch khuếch đại và mạch lọc.
Hợp kim
- Hợp kim chịu nhiệt: Tantali được sử dụng để chế tạo các hợp kim chịu nhiệt có khả năng chịu được nhiệt độ cao. Hợp kim tantalum được sử dụng trong các động cơ máy bay, động cơ tên lửa và các thiết bị công nghiệp khác.
- Hợp kim chịu ăn mòn: Tantali được sử dụng để chế tạo các hợp kim chịu ăn mòn có khả năng chống lại sự ăn mòn của axit, bazơ và nước biển. Hợp kim tantalum được sử dụng trong các thiết bị hóa chất, thiết bị y tế và các thiết bị khác.
Y tế
- Cấy ghép: Tantali được sử dụng để chế tạo các thiết bị cấy ghép y tế như cấy ghép xương, cấy ghép khớp và cấy ghép nha khoa. Tantali được sử dụng trong các thiết bị cấy ghép vì nó có khả năng tương thích sinh học tốt, không độc hại và không gây dị ứng.
- Dụng cụ phẫu thuật: Tantali được sử dụng để chế tạo các dụng cụ phẫu thuật như dao mổ, kẹp và kim. Dụng cụ phẫu thuật tantalum được sử dụng vì nó có độ bền cao, sắc bén và dễ dàng khử trùng.
Hóa chất
- Thiết bị hóa chất: Tantali được sử dụng để chế tạo các thiết bị hóa chất như bình chứa, đường ống và van. Thiết bị tantalum được sử dụng trong các nhà máy hóa chất vì nó có khả năng chống ăn mòn cao.
- Chất xúc tác: Tantali được sử dụng làm chất xúc tác trong một số phản ứng hóa học.
Các ứng dụng khác
- Dây tóc bóng đèn: Tantali được sử dụng để làm dây tóc bóng đèn vì nó có điểm nóng chảy cao và độ bền cao.
- Kính quang học: Tantali được sử dụng để chế tạo kính quang học có độ chính xác cao.
- Trang sức: Tantali được sử dụng để chế tạo trang sức vì nó có vẻ ngoài đẹp và bền.
Điều chế và sản xuất nguyên tố Tantali
Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp khử hydro hóa:
Tantali có thể được điều chế bằng cách khử hydro hóa tantali(V) hydride (TaH5). Ví dụ:
2TaH5(s) → Ta(s) + 5H2(g)
- Phương pháp điện phân:
Tantali cũng có thể được điều chế bằng cách điện phân dung dịch muối tantali. Ví dụ:
TaCl5(aq) → Ta(s) + 5Cl2(g)
Điều chế trong công nghiệp:
- Phương pháp chiết xuất từ quặng coltan:
Tantali được sản xuất chủ yếu từ quặng coltan, một loại khoáng chất chứa nhiều columbi (tantalum và niobi). Quặng coltan được nghiền mịn và xử lý bằng axit để hòa tan các kim loại. Tantali sau đó được chiết xuất từ dung dịch bằng các phương pháp hóa học như trao đổi ion hoặc kết tủa.
- Phương pháp khử hydro hóa:
Tantali cũng có thể được điều chế bằng cách khử hydro hóa tantali(V) hydride (TaH5).
Sản xuất
Khai thác khoáng sản
- Quá trình sản xuất bắt đầu từ việc khai thác các khoáng vật chứa Tantali, chủ yếu là tantalite. Khoáng sản này thường được khai thác ở các mỏ ở Châu Phi, Châu Á, và một số nơi khác trên thế giới.
Tinh chế khoáng sản
- Sau khi khai thác, khoáng sản được nghiền nhỏ và qua quá trình tinh chế để loại bỏ các tạp chất. Quá trình này thường bao gồm nhiều giai đoạn như nghiền, sàng, và rửa.
Chiết xuất Tantali
- Tantali được chiết xuất từ khoáng sản thông qua quá trình hòa tan bằng axit. Trong quá trình này, khoáng vật được hòa tan trong một dung dịch axit mạnh để tách Tantali khỏi các tạp chất khác.
Tinh chế hóa học
- Tantali thu được sau đó được tinh chế hơn nữa thông qua các phản ứng hóa học để loại bỏ niobi và các nguyên tố khác còn lại. Một trong những phương pháp phổ biến là sử dụng quá trình chiết rút bằng dung môi để tách Tantali ra khỏi niobi.
Chuyển hóa thành dạng sử dụng
- Tantali tinh khiết cuối cùng được chuyển hóa thành dạng kim loại, bột, hoặc hợp chất tùy theo mục đích sử dụng. Điều này thường được thực hiện thông qua quá trình khử kim loại từ hợp chất của nó, ví dụ, bằng cách sử dụng quá trình nhiệt phân hoặc quá trình điện phân.
Phản ứng hóa học của nguyên tố Tantali (Ta)
Tantali là một kim loại trơ, có khả năng chống ăn mòn cao. Nó ít phản ứng với các chất khác ở nhiệt độ thường. Tuy nhiên, Ta có thể phản ứng với một số chất trong điều kiện nhất định. Dưới đây là một số ví dụ về phản ứng hóa học của Tantali:
Phản ứng với axit
- Ta không phản ứng với axit HCl và H2SO4 loãng ở nhiệt độ thường.
- Ta phản ứng với axit HNO3 đặc nóng để tạo thành Ta2O5:
2Ta + 10HNO3 → Ta2O5 + 10NO2 + 5H2O
- Ta phản ứng với axit HF đặc nóng để tạo thành TaF5:
2Ta + 10HF → 2TaF5 + 5H2
Phản ứng với oxy
- Ta không phản ứng với oxy ở nhiệt độ thường.
- Ta phản ứng với oxy khi nung nóng để tạo thành Ta2O5:
4Ta + 5O2 → 2Ta2O5
Phản ứng với kim loại khác
- Ta không phản ứng với hầu hết các kim loại khác ở nhiệt độ thường.
- Ta phản ứng với một số kim loại kiềm như Li và Na khi nung nóng để tạo thành hợp kim:
2Ta + 6Li → Li3Ta2
Phản ứng với halogen
- Ta phản ứng với flo khi nung nóng để tạo thành TaF5:
2Ta + 5F2 → 2TaF5
- Ta không phản ứng với clo, brom và iốt ở nhiệt độ thường.
Ví dụ cụ thể:
- Phản ứng của Ta với axit nitric:
2Ta + 10HNO3 → Ta2O5 + 10NO2 + 5H2O
- Phản ứng của Ta với oxy khi nung nóng:
4Ta + 5O2 → 2Ta2O5
- Phản ứng của Ta với flo khi nung nóng:
2Ta + 5F2 → 2TaF5
Vấn đề an toàn khi sử dụng nguyên tố Tantali
Tantali là một kim loại tương đối an toàn, nhưng cần lưu ý một số vấn đề an toàn khi sử dụng nó:
Nguy cơ ngộ độc
- Tantali có thể gây ngộ độc nếu nuốt phải hoặc hít phải.
- Các triệu chứng ngộ độc tantali bao gồm buồn nôn, nôn mửa, tiêu chảy, đau bụng, yếu cơ và co giật.
- Nếu nghi ngờ ngộ độc tantali, cần phải đến gặp bác sĩ ngay lập tức.
Kích ứng da và mắt
- Tantali có thể gây kích ứng da và mắt.
- Các triệu chứng kích ứng da bao gồm mẩn đỏ, ngứa và sưng tấy.
- Các triệu chứng kích ứng mắt bao gồm chảy nước mắt, đỏ mắt và ngứa mắt.
- Nếu tantali dính vào da hoặc mắt, cần rửa sạch ngay với nước.
Nguy cơ cháy nổ
- Bột tantali mịn có thể bắt lửa và nổ nếu tiếp xúc với lửa hoặc tia lửa.
- Cần phải bảo quản tantali ở nơi khô ráo, thoáng mát, tránh xa các nguồn nhiệt và tia lửa.
Biện pháp phòng ngừa
- Khi sử dụng tantali, cần phải đeo găng tay, khẩu trang và kính bảo hộ để tránh tiếp xúc trực tiếp với da và mắt.
- Cần phải làm việc trong khu vực thông gió tốt để tránh hít phải bụi tantali.
- Cần phải bảo quản tantali ở nơi an toàn, tránh xa tầm tay trẻ em.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Tantali mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Tantali. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







