Nguyên tố Tali: Định nghĩa, lịch sử, tính chất và ứng dụng
Trong nội dung bài viết này yeuhoahoc.edu.vn sẽ cho bạn đọc cái nhìn tổng quan về nguyên tố Tali từ định nghĩa, đến vai trò của nó trong bảng tuần hoàn hóa học.
Tali, một nguyên tố ít được biết đến nhưng có nhiều ứng dụng quan trọng trong công nghiệp và khoa học, đã trở thành chủ đề thú vị cho những người yêu thích hóa học. Trong nội dung bài viết này yeuhoahoc.edu.vn sẽ cho bạn đọc cái nhìn tổng quan về nguyên tố Tali từ định nghĩa, lịch sử phát hiện, đến vai trò và vị trí của nó trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Tali
Định nghĩa
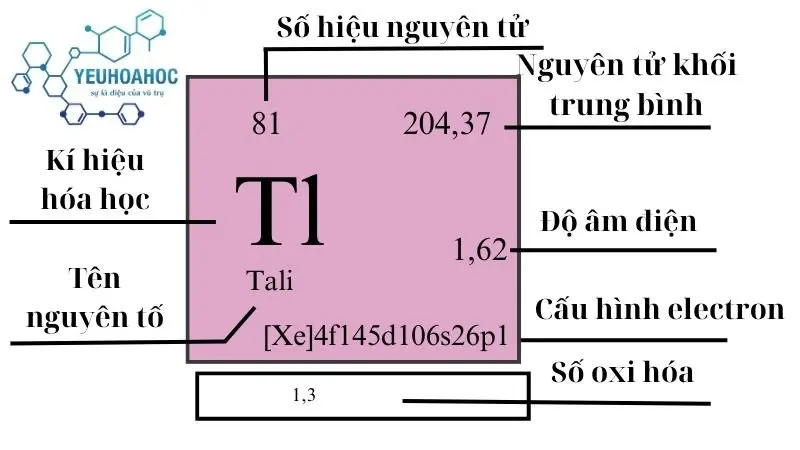
Tali , với tên tiếng Anh là “Thallium” và ký hiệu hóa học là “Tl”, là nguyên tố hóa học có số nguyên tử là 81. Thuộc nhóm kim loại chuyển tiếp, Tali nằm ở chu kỳ 6 và nhóm 13 trong bảng tuần hoàn. Được biết đến với tính chất mềm, dễ dát mỏng, Tali có màu trắng bạc và rất độc.
Lịch sử hình thành nguyên tố Tali
Lịch sử phát hiện:
- 1861: William Crookes phát hiện ra tali bằng phương pháp phân tích quang phổ.
- 1862: Claude-Auguste Lamy phát hiện ra tali độc lập với Crookes.
- Cuối thế kỷ 19: Tali được sử dụng trong y học để điều trị bệnh giang mai và một số bệnh khác.
- Thế kỷ 20: Tali được sử dụng trong các thiết bị điện tử và trong sản xuất kính.
Một số điểm thời gian quan trọng:
- 1861: William Crookes phát hiện ra tali.
- 1862: Claude-Auguste Lamy phát hiện ra tali độc lập với Crookes.
- 1904: William Henry Perkin phát hiện ra thallium(I) sulfate, một hợp chất được sử dụng trong y học để điều trị bệnh giang mai.
- 1920: Tali được sử dụng trong các thiết bị điện tử.
- 1940: Tali được sử dụng trong sản xuất kính.
- 1970: Tác hại của tali đối với sức khỏe con người được nhận thức.
- 1990: Việc sử dụng tali trong y học bị hạn chế.
Nguyên tố Tali trong bảng tuần hoàn hóa học
Tali nằm ở ô số 81 trong bảng tuần hoàn hóa học, thuộc nhóm 13 (nhóm bo) và chu kỳ 6. Nó có cấu hình electron là [Xe] 4f14 5d10 6s2 6p1.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 13 | 6 | 204,38 | 11,85 | 577 | 1746 | 0,129 | 1,62 | 0,85 |
Tính chất của nguyên tố Tali
Tính chất vật lý
- Trạng thái: Chất rắn
- Màu sắc: Xám trắng
- Độ dẻo: Dẻo
- Điểm nóng chảy: 304 °C
- Điểm sôi: 1473 °C
- Khối lượng riêng: 11,85 g/cm³
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
Tính chất hóa học
- Tính khử: Mạnh
- Tính oxi hóa: Yếu
- Trạng thái oxy hóa: +1, +3
- Phản ứng với axit: Phản ứng với axit loãng để tạo thành muối
- Phản ứng với kiềm: Phản ứng với kiềm để tạo thành muối
- Phản ứng với oxy: Bị oxy hóa bởi không khí để tạo thành lớp oxit mỏng
- Hợp chất:
- Thallium(I) chloride (TlCl): Chất rắn màu trắng, tan trong nước
- Thallium(I) sulfate (Tl2SO4): Chất rắn màu trắng, tan trong nước
- Thallium(III) oxide (Tl2O3): Chất rắn màu nâu đen, không tan trong nước
Ứng dụng của nguyên tố Tali

Lịch sử ứng dụng
- Thế kỷ 19: Tali được sử dụng trong y học để điều trị bệnh giang mai và một số bệnh khác.
- Thế kỷ 20: Tali được sử dụng trong các thiết bị điện tử và trong sản xuất kính.
- Thế kỷ 21: Việc sử dụng tali được hạn chế do tính độc hại của nó.
Ứng dụng hiện nay
- Y học:
- Điều trị một số bệnh ung thư (như ung thư tuyến tụy, ung thư hắc tố)
- Chẩn đoán hình ảnh (như chụp X-quang)
- Công nghiệp:
- Sản xuất kính đặc biệt (như kính có chiết suất cao)
- Sản xuất pin mặt trời
- Sản xuất thiết bị điện tử (như bóng đèn huỳnh quang)
- Nghiên cứu khoa học:
- Nghiên cứu về các vật liệu mới
- Nghiên cứu về các ứng dụng y tế mới
Lưu ý:
- Việc sử dụng tali cần được thực hiện cẩn thận do tính độc hại của nó.
- Cần có các biện pháp bảo hộ thích hợp khi tiếp xúc với tali.
Điều chế và sản xuất nguyên tố Tali
Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp điện phân:
- Điện phân dung dịch thallium(I) sulfate (Tl2SO4) với điện cực than chì.
- Phương pháp này cho phép thu được tali tinh khiết.
Phương trình điều chế:
2Tl2SO4 + 2H2O → 4Tl + 2H2SO4 + O2
Điều chế trong công nghiệp:
- Phương pháp nung nóng:
- Nung nóng quặng thallium(I) sulfide (Tl2S) với oxy.
- Phương pháp này cho phép thu được tali thô.
Phương trình điều chế:
2Tl2S + 3O2 → 2Tl2O3 + 2SO2
Sản xuất
- Tali được sản xuất chủ yếu từ quặng thallium(I) sulfide (Tl2S).
- Quặng thallium(I) sulfide được khai thác từ các mỏ kim loại khác như kẽm, chì và đồng.
- Sau khi khai thác, quặng thallium(I) sulfide được nghiền nhỏ và xử lý bằng phương pháp nung nóng để thu được tali thô.
- Tali thô được tinh chế bằng phương pháp điện phân để thu được tali tinh khiết.
Phản ứng của nguyên tố Tali

Phản ứng với axit
Tali có thể phản ứng với axit loãng để tạo thành muối. Ví dụ:
- Phản ứng với axit hydrochloric:
2Tl + 2HCl → 2TlCl + H2
Phản ứng với kiềm
Tali có thể phản ứng với kiềm để tạo thành muối. Ví dụ:
- Phản ứng với natri:
2Tl + 2Na → 2NaTl + H2
Phản ứng với oxy
Tali có thể bị oxy hóa bởi không khí để tạo thành lớp oxit mỏng. Ví dụ:
- Phản ứng với oxy:
4Tl + 3O2 → 2Tl2O3
Phản ứng với halogen
Tali có thể phản ứng với halogen để tạo thành muối halide. Ví dụ:
- Phản ứng với clo:
2Tl + 3Cl2 → 2TlCl3
Phản ứng với dung dịch muối kim loại
Tali có thể khử một số dung dịch muối kim loại khác để tạo thành kim loại. Ví dụ:
- Phản ứng với dung dịch đồng(II) sulfate:
Tl + CuSO4 → Tl2SO4 + Cu
Vấn đề an toàn của nguyên tố Tali
Tali là một nguyên tố độc hại cần được kiểm soát chặt chẽ để bảo vệ sức khỏe con người và môi trường.
Tác hại của Tali
Tiếp xúc với tali có thể gây ra các vấn đề về sức khỏe như:
-
- Rụng tóc
- Buồn nôn
- Nôn mửa
- Tiêu chảy
- Đau bụng
- Tổn thương hệ thần kinh
- Tử vong
Tali có thể tích tụ trong chuỗi thức ăn, gây nguy hại cho động vật hoang dã.
Nguy cơ phơi nhiễm Tali
- Hít phải hơi tali từ các thiết bị bị vỡ hoặc rò rỉ.
- Ăn phải cá bị ô nhiễm tali.
- Sử dụng các sản phẩm mỹ phẩm hoặc y tế có chứa tali.
- Tiếp xúc với tali trong môi trường làm việc.
Cách phòng tránh phơi nhiễm Tali
- Hạn chế sử dụng các sản phẩm chứa tali.
- Thay thế các thiết bị chứa tali bằng các thiết bị an toàn hơn.
- Cẩn thận khi sử dụng và xử lý tali.
- Rửa tay kỹ sau khi tiếp xúc với tali.
- Không ăn cá có hàm lượng tali cao.
- Sử dụng các biện pháp bảo hộ cá nhân khi tiếp xúc với tali trong môi trường làm việc.
Quy định về an toàn Tali
- Công ước Minamata về Thủy ngân là một hiệp ước quốc tế nhằm bảo vệ sức khỏe con người và môi trường khỏi tác hại của thủy ngân.
- Công ước Minamata cấm sản xuất, xuất khẩu và nhập khẩu một số sản phẩm chứa tali.
- Các quốc gia ký kết Công ước Minamata có nghĩa vụ thực hiện các biện pháp để giảm thiểu việc sử dụng và phát thải tali.
Dưới đây là bản tóm tắt các thông tin cơ bản về nguyên tố Tali mà chúng tôi đã thu thập. Mời bạn đọc tiếp và khám phá thêm thông tin về chủ đề này!
Chúng tôi mong rằng bạn đã có được một cái nhìn toàn diện và chi tiết về nguyên tố Tali qua bài viết này. Nếu có bất cứ thắc mắc nào hoặc bạn muốn tìm hiểu thêm, hãy thoải mái để lại lời bình luận ở phía dưới!







