Nguyên tố Silic: Định nghĩa, tầm quan trọng và ứng dụng
Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Silic, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng và điều chế
Silic, nguyên tố phổ biến trong vỏ Trái Đất và là thành phần chính của đá, cát, và thủy tinh, chơi một vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ. Từ ngành công nghiệp vật liệu đến công nghệ điện tử và y học, hiểu biết về Silic đã mở ra cánh cửa cho nhiều phát triển đột phá. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Silic, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và các vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Silic
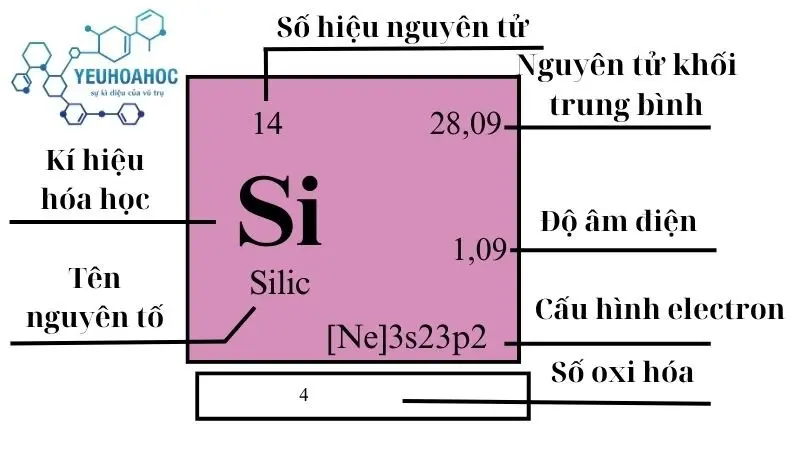
Định nghĩa
- Tên tiếng Anh: Silicon
- Ký hiệu: Si
- Số hiệu nguyên tử: 14
- Số electron lớp ngoài cùng: 4
Lịch sử hình thành nguyên tố
Silic được phát hiện vào năm 1824 bởi nhà hóa học người Thụy Điển Jöns Jacob Berzelius.
Mốc thời gian quan trọng:
- 1824: Jöns Jacob Berzelius phát hiện ra Silic.
- 1854: Friedrich Wöhler điều chế Silic tinh khiết.
- 1906: William Henry Bragg và William Lawrence Bragg phát hiện ra cấu trúc tinh thể của Silic.
- 1954: Gordon Teal và Jan Hendrik Frederik Kern phát triển phương pháp kéo tinh thể Silic.
Tầm quan trọng
Silic đứng ở vị trí thứ hai về mức độ phổ biến trong lớp vỏ Trái Đất, chỉ sau oxy, với tỷ lệ chiếm khoảng 28%.
Silic đóng vai trò quan trọng trong vũ trụ và trong đời sống con người:
- Vũ trụ: Silic là thành phần chính của các sao chổi, tiểu hành tinh và bụi vũ trụ.
- Đời sống con người:
-
-
- Silic là thành phần chính của cát, đá, thủy tinh và gốm sứ.
- Silic được sử dụng trong sản xuất xi măng, thép, nhôm và các hợp kim khác.
- Silic đóng vai trò quan trọng trong ngành điện tử, là nguyên liệu chính để sản xuất chip bán dẫn.
- Silic có vai trò quan trọng trong y học, được sử dụng trong một số loại thuốc và vật liệu y tế.
-
Nguyên tố trong bảng tuần hoàn hóa học
Silic thuộc nhóm IVA (nhóm cacbon) trong bảng tuần hoàn hóa học.
Silic là á kim, có tính chất trung gian giữa kim loại và phi kim.
Silic có thể thể hiện hóa trị +4 và +2
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 14 | 3 | 28,085 | 2,3296 | 1687 | 3538 | 0,705 | 1,9 | 282000 |
Tính chất của nguyên tố Silic
Tính chất vật lý
Silic là kim loại màu xám, có ánh kim loại.
Silic là chất rắn, giòn, không tan trong nước.
Silic có nhiệt độ nóng chảy cao (1410°C).
Silic có tính dẫn điện thấp.
Silic có tính bán dẫn.
Tính chất hóa học
Silic có tính khử và tính oxi hóa.
Tính khử:
-
- Silic tác dụng với halogen (như Cl2, Br2) ở nhiệt độ cao.
- Silic tác dụng với dung dịch kiềm loãng.
Tính oxi hóa:
-
- Silic tác dụng với oxi ở nhiệt độ cao.
- Silic tác dụng với axit nitric loãng.
Một số hợp chất quan trọng của Silic
SiO2 (silic đioxit): là thành phần chính của cát, thạch anh và các khoáng chất silicat khác.
Na2SiO3 (natri silicat): được sử dụng trong sản xuất thủy tinh, xà phòng và chất tẩy rửa.
CaSiO3 (canxi silicat): là thành phần chính của xi măng.
SiH4 (silane): được sử dụng trong sản xuất chất bán dẫn.
Ứng dụng của nguyên tố Silic:
Ngành công nghiệp điện tử
- Silic là vật liệu bán dẫn quan trọng để sản xuất vi mạch, transistor và các linh kiện điện tử khác.
- Silic được sử dụng để sản xuất pin mặt trời.
Ngành công nghiệp xây dựng
- Silic là thành phần chính của cát, thạch anh và các khoáng chất silicat khác, được sử dụng để sản xuất xi măng, kính, gốm sứ và các vật liệu xây dựng khác.
Ngành công nghiệp luyện kim
- Silic được sử dụng để sản xuất thép, hợp kim nhôm và các hợp kim khác.
Ngành công nghiệp hóa chất
- Silic được sử dụng để sản xuất silicat, silan và các hợp chất silic khác.
Ngành công nghiệp y tế
- Silic được sử dụng để sản xuất các implant y tế, chẳng hạn như khớp nhân tạo và stent.
Ngành công nghiệp thực phẩm
- Silic được sử dụng làm chất phụ gia thực phẩm, chẳng hạn như chất chống đông vón và chất tạo gel.
Điều chế và sản xuất nguyên tố Silic
Điều chế Silic trong phòng thí nghiệm
Phương pháp điện phân:
- Điện phân dung dịch muối silic nóng chảy (như NaAlCl4) với điện cực than.
- Silic được tạo ra ở catot.
Phương pháp khử:
- Dùng kim loại mạnh (như Mg) khử SiO2 ở nhiệt độ cao.
- Silic được tạo ra dưới dạng bột.
Sản xuất Silic trong công nghiệp
Phương pháp nung chảy khử:
- Nung chảy hỗn hợp SiO2 và than cốc trong lò điện.
- Silic được tạo ra dưới dạng lỏng.
Phương pháp Siemens:
- Nung nóng SiO2 với cacbon trong lò hồ quang.
- Silic được tạo ra dưới dạng hơi.
Phản ứng của nguyên tố Silic
Silic là nguyên tố có tính khử và tính oxi hóa:
- Tính khử:
- Tác dụng với halogen:
Silic tác dụng với halogen (như Cl2, Br2) ở nhiệt độ cao để tạo thành silic halide.
Ví dụ:
Si + 2Cl2 → SiCl4
- Tác dụng với dung dịch kiềm loãng:
Silic tác dụng với dung dịch kiềm loãng để tạo thành muối silicat và khí hydro.
Ví dụ:
Si + 2NaOH + H2O → Na2SiO3 + H2
- Tính oxi hóa:
- Tác dụng với oxi:
Silic tác dụng với oxi ở nhiệt độ cao để tạo thành silic dioxide.
Ví dụ:
Si + O2 → SiO2
- Tác dụng với axit nitric loãng:
Silic tác dụng với axit nitric loãng để tạo thành silic dioxide và khí nitơ dioxide.
Ví dụ:
Si + 4HNO3 → SiO2 + 4NO2 + 2H2O
Ngoài ra, Silic còn có thể tham gia vào một số phản ứng khác, như:
- Phản ứng thủy phân:
Silic tác dụng với nước ở nhiệt độ cao để tạo thành silic dioxide và khí hydro.
Ví dụ:
Si + 2H2O → SiO2 + 2H2
- Phản ứng với kim loại:
Silic tác dụng với một số kim loại (như Mg, Ca) ở nhiệt độ cao để tạo thành hợp kim.
Ví dụ:
Si + 2Mg → Mg2Si
Tồn tại và khai thác nguyên tố Silic
Trong tự nhiên, silic không được tìm thấy ở dạng nguyên chất mà luôn xuất hiện dưới dạng các hợp chất với các nguyên tố khác..
Khai thác Silic:
- Silic được khai thác từ các mỏ cát và thạch anh.
- Quá trình khai thác liên quan đến việc loại bỏ lớp đất phủ trên và sau đó khai thác cát hoặc thạch anh.
- Cát và thạch anh sau đó được nghiền và xử lý để loại bỏ các tạp chất.
Silic được sử dụng trong nhiều ngành công nghiệp khác nhau, bao gồm:
- Ngành công nghiệp điện tử: Silic là vật liệu bán dẫn được sử dụng để sản xuất vi mạch và các thiết bị điện tử khác.
- Ngành công nghiệp xây dựng: Silic được sử dụng để sản xuất xi măng, kính và các vật liệu xây dựng khác.
- Ngành công nghiệp luyện kim: Silic được sử dụng để sản xuất thép và các hợp kim khác.
- Ngành công nghiệp hóa chất: Silic được sử dụng để sản xuất silicat và các hợp chất silic khác.
Tác động môi trường của việc khai thác Silic:
- Việc khai thác Silic có thể gây ra một số tác động môi trường, bao gồm:
- Ô nhiễm không khí: Quá trình nghiền và xử lý cát và thạch anh có thể tạo ra bụi có thể gây ô nhiễm không khí.
- Ô nhiễm nước: Quá trình khai thác và xử lý silic có thể làm ô nhiễm nguồn nước.
- Phá hủy môi trường sống: Việc khai thác silic có thể phá hủy môi trường sống của động vật hoang dã.
Tái chế Silic:
- Silic có thể được tái chế từ các sản phẩm phế thải như kính, gốm sứ và thiết bị điện tử.
- Việc tái chế silic giúp giảm nhu cầu khai thác silic nguyên sinh và giảm tác động môi trường của việc khai thác silic
Vấn đề an toàn khi sử dụng nguyên tố Silic
Bụi silic
- Bụi silic có khả năng gây ra tình trạng kích ứng cho mắt, mũi và cổ họng.
- Tiếp xúc lâu dài với bụi silic có thể dẫn đến bệnh silicosis, một bệnh phổi tiến triển có thể gây tử vong.
- Silicosis thường gặp ở những người làm việc trong ngành công nghiệp khai thác, xây dựng và sản xuất.
Silic tinh thể
- Silic tinh thể có thể gây tổn thương da và mắt.
- Nuốt phải silic tinh thể có thể gây ra các vấn đề về sức khỏe.
Hợp chất silic
- Một số hợp chất silic, chẳng hạn như silan, có thể dễ cháy và độc hại.
Tác động môi trường
- Việc khai thác và xử lý silic có thể gây ra một số tác động môi trường, bao gồm:
- Ô nhiễm không khí
- Ô nhiễm nước
- Phá hủy môi trường sống
Để đảm bảo an toàn khi sử dụng silic, cần lưu ý một số biện pháp phòng ngừa sau:
- Hạn chế tiếp xúc với bụi silic.
- Sử dụng thiết bị bảo hộ cá nhân khi làm việc với silic tinh thể.
- Cẩn thận khi sử dụng các hợp chất silic.
- Tuân thủ các quy định về an toàn môi trường khi khai thác và xử lý silic.
Chất lượng và phương thức cung cấp nguyên tố Silic
Chất lượng Silic
- Hàm lượng tạp chất: Silic càng tinh khiết thì càng có giá trị cao.
- Kích thước hạt: Silic có kích thước hạt nhỏ hơn thường được sử dụng trong các ứng dụng điện tử.
- Hình dạng hạt: Silic có hình dạng hạt đồng đều thường được ưa chuộng hơn.
Phương thức cung cấp Silic

- Cát: Cát là nguồn silic phổ biến nhất.
- Thạch anh: Đây là một loại tinh thể được tạo thành từ silic.
- Ferrosilicon: Ferrosilicon là hợp kim của silic và sắt.
- Silicon tinh thể: Silicon tinh thể được sử dụng trong các ứng dụng điện tử.
Lựa chọn phương thức cung cấp silic phù hợp phụ thuộc vào một số yếu tố, bao gồm:
- Ứng dụng: Các ứng dụng khác nhau đòi hỏi các loại silic khác nhau.
- Giá cả: Cát là nguồn silic rẻ nhất, nhưng silicon tinh thể là loại silic đắt nhất.
- Tính sẵn có: Cát là nguồn silic readily available nhất, nhưng silicon tinh thể có thể khó kiếm hơn.
Trên đây là tất cả những kiến thức cơ bản về nguyên tố Silic mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Silic. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







