Nguyên tố Selen: Ứng dụng đa dạng trong công nghiệp
Bài viết này yeuhoahoc.edu.vn sẽ cùng các bạn khám phá khía cạnh chính của nguyên tố Seleni, từ tính chất hóa học đến tầm quan trọng trong đời sống hàng ngày.
Selen là một nguyên tố thiết yếu có vai trò quan trọng trong cơ thể sống và ứng dụng rộng rãi trong công nghiệp. Bài viết này yeuhoahoc.edu.vn sẽ cùng các bạn khám phá những khía cạnh chính của Seleni, từ tính chất hóa học đến tầm quan trọng trong đời sống hàng ngày.
Giới thiệu về nguyên tố Selen
Định nghĩa
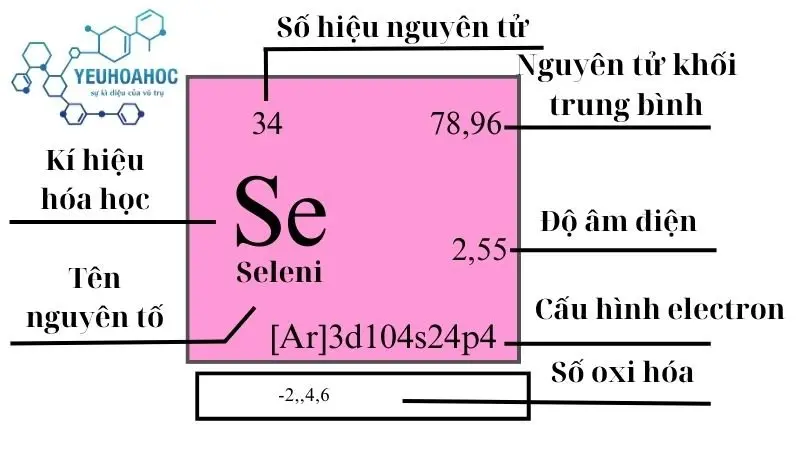
Selen, với tên tiếng Anh là “Selenium” và ký hiệu hóa học Se, là nguyên tố hóa học có số nguyên tử là 34. Là một thành viên của nhóm chalcogen trong bảng tuần hoàn, Selen được biết đến với các tính chất hóa học tương tự như lưu huỳnh và tellurium, và nó đóng một vai trò thiết yếu trong sinh học của nhiều sinh vật.
Lịch sử hình thành nguyên tố
Selen được phát hiện vào năm 1817 bởi Jöns Jacob Berzelius và Johann Gottlieb Gahn khi họ đang nghiên cứu lưu huỳnh trong các chất thải từ quá trình sản xuất axit sulfuric. Ban đầu, họ tưởng lầm Seleni là tellurium, nhưng sau đó Berzelius nhận ra rằng đây là một nguyên tố hoàn toàn mới.
- Một số mốc quan trọng lịch sử hình thành nguyên tố
1817: Jöns Jacob Berzelius, nhà hóa học người Thụy Điển, đã phát hiện ra seleni trong quá trình sản xuất axit sulfuric từ quặng pyrit.
1873: Seleni được sử dụng trong sản xuất kính màu.
Đầu thế kỷ 20: Seleni được sử dụng trong các thiết bị điện tử như bộ chỉnh lưu và tế bào quang điện.
Thập niên 1950: Vai trò sinh học của seleni được phát hiện.
Ngày nay: Seleni được sử dụng trong nhiều lĩnh vực khác nhau, bao gồm y học, dinh dưỡng, công nghiệp và nông nghiệp.
Tầm quan trọng của nguyên tố Seleni trong đời sống:
- Seleni là một vi chất dinh dưỡng thiết yếu cho con người và động vật.
- Seleni đóng vai trò quan trọng trong nhiều chức năng của cơ thể, bao gồm:
- Hệ miễn dịch
- Chức năng tuyến giáp
- Sinh sản
- Sức khỏe tim mạch
- Phòng chống ung thư
- Seleni cũng có thể giúp bảo vệ cơ thể khỏi tác hại của các gốc tự do.
Nguyên tố Selen và vị trí trong bảng tuần hoàn hóa học
- Seleni thuộc nhóm 16 (chalcogen) trong bảng tuần hoàn hóa học.
- Seleni nằm cùng nhóm với oxy, lưu huỳnh và teluri.
- Seleni là một phi kim.
- Seleni có tính chất hóa học tương tự như lưu huỳnh và teluri.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 4 | 78,96(3) | 4,809 | 453 | 958 | 0,321 | 2,55 | 0,05 | 4 |
Tính chất của nguyên tố Selen
Tính chất vật lý
- Selen là một chất rắn màu xám, ánh kim.
- Selen có hai dạng thù hình:
- Selen lục phương: mềm, dẻo, dễ dát mỏng.
- Selen đơn tà: cứng, giòn.
- Selen có nhiệt độ nóng chảy thấp (220 °C) và nhiệt độ sôi cao (685 °C).
- Selen là chất bán dẫn.
- Selen không tan trong nước.
- Selen tan trong axit nitric và axit sunfuric.
Tính chất hóa học
- Selen là một phi kim.
- Selen có số oxi hóa +4, +6, -2.
- Selen có thể phản ứng với nhiều kim loại để tạo thành selenua.
- Selen có thể phản ứng với axit để tạo thành muối selenit và selenat.
- Selen có thể phản ứng với halogen để tạo thành selen halua.
- Seleni có thể cháy trong không khí với ngọn lửa xanh mờ, tạo thành Seleni dioxide (SeO₂).
- Seleni phản ứng với Hydrogen tạo thành Hydrogen Selenide (H₂Se), một khí rất độc hại.
- Seleni phản ứng chậm với axit mạnh và có thể bị oxi hóa bởi một số chất oxi hóa mạnh. Nó cũng có thể tạo thành selenate trong phản ứng với bazơ mạnh.
Một số hợp chất quan trọng của Selen
- Selenua natri (Na2Se): được sử dụng trong sản xuất kính màu.
- Selenit natri (Na2SeO3): được sử dụng trong sản xuất thuốc và chất bổ sung dinh dưỡng.
- Selenat natri (Na2SeO4): được sử dụng trong sản xuất pin.
Ứng dụng của nguyên tố Selen

Selen có nhiều ứng dụng trong các lĩnh vực khác nhau, bao gồm:
Y học
- Selen được sử dụng để điều trị và phòng ngừa các bệnh do thiếu selen, chẳng hạn như bệnh Keshan và bệnh Kashin-Beck.
- Selen cũng được sử dụng để điều trị một số bệnh khác, chẳng hạn như ung thư, bệnh tim mạch và viêm khớp.
Dinh dưỡng
- Selen được sử dụng làm chất bổ sung dinh dưỡng để tăng cường sức khỏe và phòng ngừa bệnh tật.
- Selen cũng được thêm vào một số thực phẩm, chẳng hạn như ngũ cốc và sữa.
Công nghiệp
- Selen được sử dụng trong sản xuất kính màu.
- Selen cũng được sử dụng trong sản xuất pin, chất bán dẫn và các thiết bị điện tử khác.
Nông nghiệp
- Selen được sử dụng làm phân bón để tăng cường sức khỏe cây trồng và năng suất cây trồng.
- Selen cũng được sử dụng để phòng ngừa bệnh tật ở gia súc.
Một số ứng dụng cụ thể của Selen
- Selen được sử dụng trong sản xuất thuốc chống ung thư.
- Selen được sử dụng trong sản xuất các thiết bị quang điện.
- Selen được sử dụng trong sản xuất pin mặt trời.
- Selen được sử dụng trong sản xuất xà phòng và chất tẩy rửa.
Lưu ý:
- Selen là một vi chất dinh dưỡng thiết yếu, nhưng nó có thể gây độc nếu
- Liều lượng selen an toàn cho người lớn là 55 microgam mỗi ngày.
- Không nên sử dụng selen bổ sung mà không có sự hướng dẫn của bác sĩ.
Điều chế và sản xuất nguyên tố Selen
Điều chế
Điều chế trong phòng thí nghiệm:
Phương pháp khử:
- Khử selen dioxide bằng sulfur dioxide:
Một phần của quy trình này bao gồm việc chuyển đổi Seleni thành dạng dioxide, sau đó được khử bằng axit sunfuric và Hydrogen:
SeO2 + 2SO2 + 2H2O → Se + 2H2SO4
- Khử selen dioxide bằng axit hypophosphorous:
SeO2 + 4H3PO2 + 2H2O → Se + 4H3PO3
Phương pháp điện phân:
- Điện phân dung dịch selenious acid:
SeO2 + 4H+ + 4e- → Se + 2H2O
Điều chế trong công nghiệp
Quy trình tinh chế từ quặng đồng:
Trong công nghiệp, Seleni thường được tinh chế từ bùn anốt, một sản phẩm phụ của quá trình tinh chế đồng điện phân. Seleni được tách ra từ bùn này thông qua một loạt các quá trình hóa học và điện hóa.
Phương pháp nung nóng:
- Nung nóng selenide kim loại (selenide natri, selenide đồng):
Na2Se → Se + 2Na
Phương pháp khử:
- Khử selen dioxide bằng sulfur dioxide:
SeO2 + 2SO2 + 2H2O → Se + 2H2SO4
Sản xuất
Tinh chế
Seleni thu được từ các quy trình công nghiệp thường cần được tinh chế thêm để loại bỏ tạp chất. Quy trình này có thể bao gồm chưng cất, kết tinh lại, hoặc các phương pháp điện hóa khác để đảm bảo độ tinh khiết cao cần thiết cho ứng dụng cụ thể.
Chưng cất
Trong một số trường hợp, Seleni có thể được tinh chế hơn nữa thông qua chưng cất chân không để loại bỏ các tạp chất có điểm sôi cao hơn.
Selen được sản xuất chủ yếu từ bùn anode trong quá trình tinh luyện đồng. Bùn anode chứa selenide đồng, được nung nóng để thu hồi selen. Selen cũng được sản xuất từ quặng sulfide, quặng kim loại và khí thải công nghiệp.
Quy trình sản xuất selen:
- Quặng selen được nghiền mịn và nung nóng để loại bỏ tạp chất.
- Selen được chiết xuất từ quặng bằng phương pháp axit hóa hoặc nung chảy.
- Selen được tinh chế bằng phương pháp điện phân hoặc kết tủa.
- Selen được đóng gói và vận chuyển đến nhà máy sản xuất.
Tồn tại và khai thác nguyên tố Selen
Tồn tại
Selen là một nguyên tố phi kim, được tìm thấy trong tự nhiên với số nguyên tử 34 và ký hiệu Se. Selen tồn tại dưới dạng quặng selenide, selenat và selenit. Selen cũng được tìm thấy trong một số loại đá và đất.
Khai thác
Selen được khai thác từ hai nguồn chính:
- Quặng sulfide: Selen thường được tìm thấy trong quặng sulfide, chẳng hạn như pyrit và chalcopyrit. Quặng được khai thác và nghiền mịn, sau đó selen được chiết xuất bằng phương pháp nung chảy hoặc axit hóa.
- Bùn anode: Selen cũng được tìm thấy trong bùn anode, là một sản phẩm phụ của quá trình tinh luyện đồng. Bùn anode được nung nóng để thu hồi selen.
Vấn đề an toàn khi sử dụng nguyên tố Selen

Selen là một vi chất dinh dưỡng thiết yếu cho con người và động vật, nhưng nó có thể gây độc
Liều lượng selen an toàn:
- Liều lượng selen an toàn cho người lớn là 55 microgam mỗi ngày.
- Trẻ em cần ít selen hơn người lớn. Liều lượng selen an toàn cho trẻ em phụ thuộc vào độ tuổi và cân nặng của trẻ.
- Phụ nữ mang thai và cho con bú cần nhiều selen hơn người bình thường. Liều lượng selen an toàn cho phụ nữ mang thai và cho con bú là 65 microgam mỗi ngày.
Nguy cơ ngộ độc selen:
- Ngộ độc selen có thể xảy ra nếu bạn dùng quá nhiều selen.
- Các triệu chứng của ngộ độc selen bao gồm:
- Buồn nôn
- Nôn
- Tiêu chảy
- Rụng tóc
- Tổn thương thần kinh
- Mệt mỏi
- Hơi thở có mùi tỏi
- Viêm da
- Tăng huyết áp
- Suy tim
- Tử vong
Nguyên nhân ngộ độc selen:
- Ngộ độc selen có thể xảy ra do một số nguyên nhân, bao gồm:
- Uống quá nhiều selen bổ sung
- Ăn quá nhiều thực phẩm có hàm lượng selen cao
- Tiếp xúc với selen trong môi trường làm việc
Cách phòng ngừa ngộ độc selen:
- Để tránh ngộ độc selen, bạn nên:
- Không sử dụng selen bổ sung mà không có sự hướng dẫn của bác sĩ.
- Ăn một chế độ ăn uống cân bằng, đa dạng.
- Hạn chế tiếp xúc với selen trong môi trường làm việc.
Nếu bạn nghĩ rằng bạn có thể bị ngộ độc selen, hãy đến gặp bác sĩ ngay lập tức.
Lưu ý:
- Selen là một vi chất dinh dưỡng quan trọng, nhưng nó có thể gây độc nếu ăn qua nhiều
- Điều quan trọng là bạn phải tuân theo liều lượng selen an toàn để bảo vệ sức khỏe của mình.
Chất lượng và phương thức cung cấp nguyên tố Selen
Chất lượng
Selen có thể được tìm thấy trong nhiều dạng khác nhau, bao gồm:
- Selen nguyên tố
- Selenua natri
- Selenit natri
- Selenat natri
- Selen hữu cơ
Chất lượng của selen phụ thuộc vào độ tinh khiết và hàm lượng selen.
Selen nguyên tố có độ tinh khiết cao nhất.
Selenua natri, selenit natri và selenat natri là những dạng selen phổ biến được sử dụng trong các ứng dụng công nghiệp.
Selen hữu cơ là dạng selen dễ hấp thu nhất đối với cơ thể con người.
Phương thức cung cấp
Selen có thể được cung cấp cho cơ thể bằng nhiều cách khác nhau, bao gồm:
Thực phẩm: Selen có thể được tìm thấy trong nhiều loại thực phẩm, bao gồm thịt, cá, trứng, ngũ cốc và các loại hạt. Hàm lượng selen trong thực phẩm có thể thay đổi tùy thuộc vào loại đất nơi trồng thực phẩm.
Bổ sung selen: Selen có thể được bổ sung dưới dạng viên nang, viên nén hoặc dung dịch.
Tiêm selen: Selen có thể được tiêm tĩnh mạch hoặc tiêm bắp trong trường hợp cần thiết.
Lựa chọn phương thức cung cấp selen:
- Phương thức cung cấp selen tốt nhất phụ thuộc vào nhu cầu cá nhân của bạn.
- Nếu bạn đang thiếu selen, bạn nên tham khảo ý kiến bác sĩ để xác định phương thức cung cấp selen phù hợp nhất cho bạn.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Seleni mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Seleni. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







