Nguyên tố Seaborgi: Định nghĩa, phản ứng và ứng dụng
Khám phá nguyên tố Seaborgi - một phần ấn tượng và bí ẩn của bảng tuần hoàn. Bài viết này yeuhoahoc.edu.vn sẽ bật mí cho các bạn về những điều kì diệu của nó.
Khám phá nguyên tố Seaborgi – một phần ấn tượng và bí ẩn của bảng tuần hoàn. Được đặt theo tên nhà khoa học Glenn T. Seaborg, người có những đóng góp không thể đo lường trong lĩnh vực hóa học hạt nhân, Seaborgium nổi bật với tính chất đặc biệt và lịch sử phát hiện thú vị. Tham gia cùng chúng tôi tại yeuhoahoc.edu.vn để khám phá sâu hơn về nguyên tố siêu nặng này.
Giới thiệu về nguyên tố Seaborgi
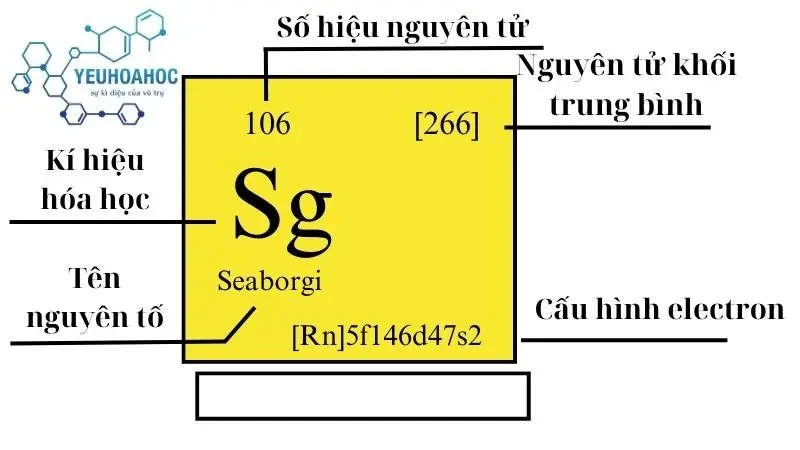
Định nghĩa
Seaborgium (Sg) là một nguyên tố nhân tạo với số nguyên tử là 106. Do không tồn tại tự nhiên, Seaborgium chỉ được tạo ra trong phòng thí nghiệm thông qua các phản ứng hạt nhân. Nó thuộc nhóm nguyên tố d-block, và là một phần của các nguyên tố chuyển tiếp, nằm trong dãy 7 của bảng tuần hoàn.
Lịch sử hình thành nguyên tố Seaborgi
- Năm 1974: Nhóm nghiên cứu của Albert Ghiorso tại Đại học California, Berkeley, Hoa Kỳ đã tổng hợp thành công Seaborgi bằng cách bắn phá Californi-249 với các ion Oxygen-18.
- Năm 1997: Tên gọi Seaborgi được IUPAC chính thức công nhận để vinh danh nhà hóa học Glenn T. Seaborg, người có công tiên phong trong việc tổng hợp các nguyên tố siêu nặng.
Mốc thời gian quan trọng:
- 1974: Seaborgi được tổng hợp lần đầu tiên.
- 1992: Đồng vị Seaborgi-269 được tổng hợp với chu kỳ bán rã 14,1 phút.
- 1997: IUPAC công nhận tên gọi Seaborgi.
Seaborgi trong bảng tuần hoàn hóa học
Seaborgium nằm trong nhóm 6 của bảng tuần hoàn hóa học, chia sẻ nhóm này với các nguyên tố như chromium (Cr), molybdenum (Mo), và tungsten (W), cho thấy nó có các tính chất hóa học dự đoán sẽ tương tự như những nguyên tố này. Mặc dù các tính chất cụ thể của Seaborgium chưa được biết đến do khó khăn trong việc tổng hợp và duy trì nó ở dạng ổn định đủ lâu để nghiên cứu, các nghiên cứu lý thuyết cho thấy nó có thể sẽ tạo thành các hợp chất tương tự như các nguyên tố trong nhóm của mình.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 6 | 7 | [269] | (35,0) | – | – | – | – | 0 |
Tính chất của nguyên tố Seaborgi
Tính chất vật lý
- Trạng thái: Kim loại rắn (dự đoán)
- Màu sắc: Trắng bạc (dự đoán)
- Khối lượng riêng: 35,0 g/cm³ (dự đoán)
- Nhiệt độ nóng chảy: 2650 °C (dự đoán)
- Nhiệt độ sôi: 5200 °C (dự đoán)
Tính chất hóa học
- Hóa trị: +2, +3, +4, +5, +6 (dự đoán)
- Tính khử: Mạnh
- Tính oxi hóa: Yếu
- Tính axit – bazơ: Lưỡng tính (dự đoán)
- Phản ứng với axit: Tan trong axit mạnh
- Phản ứng với bazơ: Tan trong bazơ mạnh
- Tạo hợp chất: Dự đoán tạo ra nhiều hợp chất với oxy, hydro, halogen, và các nguyên tố khác
Lưu ý:
- Do tính phóng xạ cao, Seaborgi không tồn tại trong tự nhiên và chỉ có thể được tổng hợp nhân tạo.
- Các tính chất của Seaborgi được dự đoán dựa trên các nguyên tố cùng nhóm trong bảng tuần hoàn và các nghiên cứu lý thuyết.
- Các nghiên cứu thực nghiệm về Seaborgi rất hạn chế do tính chất không ổn định của nó.
Dưới đây là một số tính chất cụ thể của Seaborgi:
- Tính khử: Seaborgi có tính khử mạnh hơn Wolfram (Tungsten) và Molybdenum.
- Tính oxi hóa: Seaborgi có tính oxi hóa yếu hơn Crom.
- Trạng thái oxy hóa: Seaborgi có thể thể hiện nhiều trạng thái oxy hóa, từ +2 đến +6.
- Hợp chất: Seaborgi đã được chứng minh là tạo ra một số hợp chất, bao gồm oxit, chloride, và fluoride.
Ứng dụng của nguyên tố Seaborgi

Hiện nay, Seaborgi không có ứng dụng thực tế nào do tính chất phóng xạ cao và thời gian bán rã ngắn của các đồng vị. Các nghiên cứu về Seaborgi chủ yếu tập trung vào:
- Hiểu rõ hơn về cấu tạo hạt nhân và tính chất hóa học của các nguyên tố siêu nặng.
- Phát triển các kỹ thuật tổng hợp nhân tạo mới.
- Tìm kiếm ứng dụng tiềm năng trong các lĩnh vực như y học, công nghiệp và khoa học vật liệu.
Dưới đây là một số ứng dụng tiềm năng của Seaborgi:
- Y học: Seaborgi có thể được sử dụng trong chẩn đoán và điều trị ung thư.
- Công nghiệp: Seaborgi có thể được sử dụng làm nguồn năng lượng cho các thiết bị vi mô và nano.
- Khoa học vật liệu: Seaborgi có thể được sử dụng để chế tạo các vật liệu mới có tính chất vượt trội.
Điều chế và sản xuất nguyên tố Seaborgi
Điều chế
Điều chế trong phòng thí nghiệm
Seaborgi được điều chế lần đầu tiên vào năm 1974 bởi nhóm nghiên cứu của Albert Ghiorso tại Đại học California, Berkeley, Hoa Kỳ. Phương pháp điều chế là bắn phá Californi-249 với các ion Oxygen-18:
249Cf + 18O → 263Sg + 4n
Điều chế trong công nghiệp:
Hiện nay, Seaborgi không được sản xuất trong công nghiệp do tính chất phóng xạ cao và thời gian bán rã ngắn của các đồng vị.
Sản xuất
Seaborgi chỉ được sản xuất với số lượng rất nhỏ trong các phòng thí nghiệm nghiên cứu. Phương pháp sản xuất phổ biến nhất là bắn phá các nguyên tố nặng khác nhau bằng các ion có năng lượng cao.
Dưới đây là một số phương pháp sản xuất Seaborgi khác:
- Phản ứng tổng hợp hạt nhân: Bắn phá các hạt nhân nguyên tử nhẹ hơn với nhau để tạo ra hạt nhân nguyên tử nặng hơn.
- Phản ứng phân rã hạt nhân: Bắn phá hạt nhân nguyên tử nặng bằng các hạt nhân khác để tạo ra các hạt nhân nguyên tử nhẹ hơn.
- Phản ứng chuyển đổi đồng vị: Chuyển đổi một đồng vị của một nguyên tố thành đồng vị của một nguyên tố khác.
Phản ứng của nguyên tố Seaborgi

Do tính phóng xạ cao và thời gian bán rã ngắn, Seaborgi chỉ được nghiên cứu với số lượng rất nhỏ. Do đó, thông tin về các phản ứng hóa học của nó còn hạn chế.
Phản ứng với axit
Seaborgi tan trong axit mạnh như axit nitric và axit hydrochloric để tạo thành muối. Ví dụ:
Sg + 4HNO3 → Sg(NO3)4 + 2H2
Phản ứng với bazơ
Seaborgi tan trong bazơ mạnh như NaOH và KOH để tạo thành hydroxit. Ví dụ:
Sg + 2NaOH → Sg(OH)2 + H2
Phản ứng oxy hóa khử
Seaborgi có thể thể hiện nhiều trạng thái oxy hóa, từ +2 đến +6. Do đó, nó có thể tham gia vào các phản ứng oxy hóa khử. Ví dụ:
Sg(II) + 2Cl2 → Sg(IV)Cl4
Phản ứng với phối tử
Seaborgi có thể tạo thành phức chất với các phối tử như EDTA và SCN-. Ví dụ:
Sg(III) + EDTA4- → [Sg(EDTA)]4-
Ví dụ cụ thể:
- Phản ứng của Seaborgi với axit nitric:
263Sg + 4HNO3 → 263Sg(NO3)4 + 2H2
Phản ứng này tạo ra muối Seaborgi nitrat (Sg(NO3)4) và khí hydro (H2).
- Phản ứng của Seaborgi với natri hydroxit:
263Sg + 2NaOH → 263Sg(OH)2 + H2
Phản ứng này tạo ra hydroxit Seaborgi (Sg(OH)2) và khí hydro (H2).
Vấn đề an toàn của nguyên tố Seaborgi
Seaborgi là một nguyên tố nguy hiểm do tính phóng xạ cao. Nó có thể gây hại cho sức khỏe con người và môi trường nếu không được xử lý cẩn thận.
Bức xạ:
Seaborgi phát ra tia alpha, beta và gamma. Tia alpha có thể gây tổn thương da, tia beta có thể gây tổn thương mô, và tia gamma có thể gây tổn thương DNA.
Ô nhiễm:
Seaborgi có thể bị ô nhiễm môi trường nếu không được xử lý và tiêu hủy đúng cách. Ô nhiễm Seaborgi có thể gây hại cho con người và động vật.
Nguy cơ cháy nổ:
Seaborgi có thể phản ứng với một số chất khác để tạo ra các hợp chất dễ cháy nổ.
Để đảm bảo an toàn khi làm việc với Seaborgi, cần thực hiện các biện pháp sau:
- Sử dụng các thiết bị bảo hộ cá nhân như găng tay, kính bảo hộ và quần áo bảo hộ.
- Làm việc trong khu vực thông gió tốt.
- Lưu trữ và tiêu hủy Seaborgi đúng cách.
Chúng tôi đã tổng hợp và biên soạn những kiến thức nổi bật và chính xác nhất về nguyên tố Seaborgium. Hãy cùng nhau khai thác và tìm hiểu những kiến thức bạn quan tâm!
Nếu bạn có bất kỳ ý kiến hoặc câu hỏi nào về nguyên tố hóa học hay bất kỳ chủ đề nào khác mà bạn muốn tìm hiểu sâu hơn, yeuhoahoc.edu.vn luôn mở cửa chào đón và sẵn lòng cung cấp thông tin đầy đủ và mới nhất, giúp bạn mở rộng vốn hiểu biết trong hành trình khám phá thế giới hóa học không bao giờ kết thúc.







