Nguyên tố Rutherfordi: 1 di sản của vật lý hạt nhân
Khám phá nguyên tố Rutherfordium, kí hiệu Rf và số nguyên tử 104, trong chuyến phiêu lưu mới nhất vào thế giới hóa học tại yeuhoahoc.edu.vn
Khám phá nguyên tố Rutherfordium, kí hiệu Rf và số nguyên tử 104, trong chuyến phiêu lưu mới nhất vào thế giới hóa học tại yeuhoahoc.edu.vn. Được đặt tên theo nhà vật lý học nổi tiếng Ernest Rutherford, Rutherfordium là nguyên tố siêu nặng với tính chất hóa học và vật lý đặc biệt, mở ra cánh cửa vào những bí ẩn của bảng tuần hoàn. Tham gia cùng chúng tôi để khám phá tính chất, ứng dụng và lịch sử phát hiện của nguyên tố kỳ thú này.
Giới thiệu về nguyên tố Rutherfordi
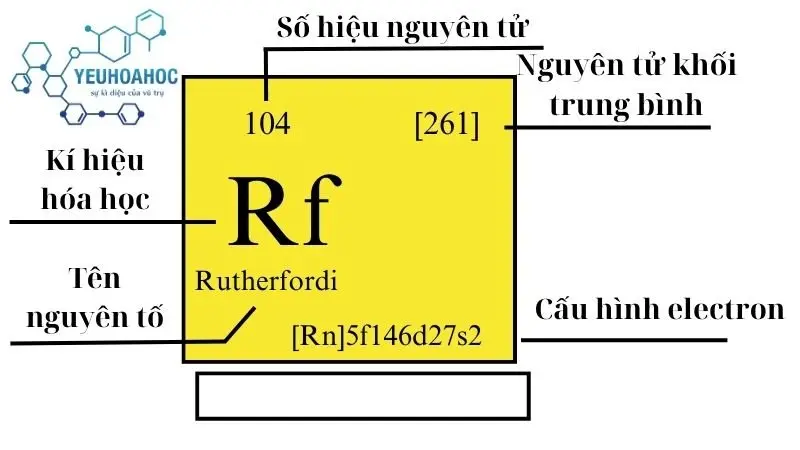
Định nghĩa
Rutherfordi, kí hiệu là Rf, là nguyên tố hóa học với số nguyên tử 104. Nó là một nguyên tố siêu nặng, tổng hợp nhân tạo và không có ở dạng tự nhiên. Với các đặc tính hóa học được dự đoán dựa trên vị trí của nó trong bảng tuần hoàn, Rutherfordi được cho là có tính chất tương tự như hafnium và zirconium, các nguyên tố thuộc nhóm 4 của bảng tuần hoàn hóa học.
Lịch sử hình thành nguyên tố Rutherfordi:
1964:
- Nhóm nghiên cứu của nhà khoa học Georgi Flerov tại Viện nghiên cứu hạt nhân Dubna (Liên Xô) đã tổng hợp thành công nguyên tố Rutherfordi.
- Họ bắn phá plutoni-242 bằng ion neon-22 để tạo ra đồng vị 260Rf.
1969:
- Nhóm nghiên cứu của Albert Ghiorso tại Đại học California, Berkeley (Mỹ) cũng tổng hợp thành công nguyên tố Rutherfordi.
- Họ sử dụng phản ứng bắn phá chì-208 bằng ion carbon-12 để tạo ra đồng vị 261Rf.
1997:
- Tên gọi “Rutherfordi” được IUPAC (Liên minh Hóa học Quốc tế) chính thức công nhận để vinh danh nhà vật lý Ernest Rutherford.
Nguyên tố Rutherfordi trong bảng tuần hoàn hóa học
- Thuộc chu kỳ 7, nhóm 4 (nhóm titan)
- Là nguyên tố đầu tiên của nhóm actini chuyển tiếp
- Có tính chất hóa học tương tự như hafni (Hf)
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 4 | 7 | [267] | (23,2) | (2400) | (5800) | – | – | 0 |
Tính chất của nguyên tố Rutherfordi
Tính chất vật lý
- Là kim loại, có khả năng dẫn điện và dẫn nhiệt tốt
- Dự đoán có màu trắng bạc
- Khối lượng riêng cao (khoảng 23 g/cm³)
- Nhiệt độ nóng chảy và sôi dự đoán cao
Tính chất hóa học
- Có tính khử mạnh
- Dễ dàng tạo hợp chất với oxy, hydro và các halogen
- Dự đoán thể hiện nhiều trạng thái oxy hóa khác nhau, từ +2 đến +6
- Hóa học của Rutherfordi chưa được nghiên cứu đầy đủ do tính phóng xạ cao của nó
Một số tính chất hóa học cụ thể:
Với oxy:
- Tạo thành dioxide Rutherfordi (RfO2)
- Dioxide Rutherfordi là một chất rắn màu vàng
Với hydro:
- Tạo thành hydride Rutherfordi (RfH3)
- Hydride Rutherfordi là một chất rắn màu đen
Với halogen:
- Tạo thành tetrafluoride Rutherfordi (RfF4)
- Tetrafluoride Rutherfordi là một chất rắn màu trắng
Ứng dụng của nguyên tố Rutherfordi
Hiện tại, Rutherfordi không có ứng dụng thực tế nào do tính chất phóng xạ cao của nó.
Tuy nhiên, Rutherfordi được sử dụng trong nghiên cứu khoa học, bao gồm:
Nghiên cứu cấu tạo hạt nhân nguyên tử:
- Rutherfordi được sử dụng để tạo ra các đồng vị mới của các nguyên tố khác.
- Việc nghiên cứu các đồng vị này giúp các nhà khoa học hiểu rõ hơn về cấu tạo hạt nhân nguyên tử.
Nghiên cứu hóa học của các nguyên tố siêu nặng:
- Rutherfordi được sử dụng để tổng hợp các nguyên tố siêu nặng khác.
- Việc nghiên cứu hóa học của các nguyên tố này giúp các nhà khoa học hiểu rõ hơn về bảng tuần hoàn hóa học và các quy luật hóa học.
Ngoài ra, Rutherfordi có thể có tiềm năng ứng dụng trong tương lai:
Y học:
- Có thể sử dụng Rutherfordi để phát triển các phương pháp điều trị ung thư.
- Tuy nhiên, cần nhiều nghiên cứu hơn để đảm bảo tính an toàn và hiệu quả.
Công nghiệp:
- Có thể sử dụng Rutherfordi để phát triển các nguồn năng lượng mới.
- Tuy nhiên, cần nhiều nghiên cứu hơn để phát triển các công nghệ sử dụng Rutherfordi một cách hiệu quả và an toàn.
Lưu ý:
- Việc sử dụng Rutherfordi cần được thực hiện cẩn thận do tính phóng xạ cao của nó.
- Cần có các biện pháp bảo hộ an toàn để đảm bảo an toàn cho người sử dụng và môi trường.
Điều chế và sản xuất nguyên tố Rutherfordi
Điều chế
Điều chế trong phòng thí nghiệm:
Rutherfordi được điều chế trong phòng thí nghiệm bằng cách bắn phá các nguyên tố nặng bằng các hạt nhân nhẹ. Phương trình phản ứng phổ biến nhất là:
- 242Pu + 22Ne → 260Rf + 4n
Điều chế trong công nghiệp:
Hiện nay, Rutherfordi không được sản xuất trong công nghiệp do tính phóng xạ cao và nhu cầu sử dụng thấp.
Sản xuất
Do tính phóng xạ cao, Rutherfordi chỉ được sản xuất với số lượng rất nhỏ trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt.
Phương pháp sản xuất phổ biến nhất là bắn phá các nguyên tố nặng như plutoni hoặc chì bằng các hạt nhân nhẹ như neon hoặc carbon.
Ví dụ:
- 242Pu + 22Ne → 260Rf + 4n
- 208Pb + 12C → 260Rf + 4n
Sản phẩm thu được sau phản ứng là hỗn hợp các đồng vị của Rutherfordi. Sau đó, các đồng vị này được phân tách bằng các phương pháp hóa học và vật lý.
Phản ứng của nguyên tố Rutherfordi
Rutherfordi là một nguyên tố hóa học có tính phóng xạ cao. Do đó, nó tham gia vào nhiều phản ứng hóa học và vật lý khác nhau.
Phản ứng phân rã alpha:
Đây là loại phản ứng phổ biến nhất của Rutherfordi. Trong phản ứng này, hạt nhân Rutherfordi phân rã thành hạt nhân heli (alpha) và một hạt nhân khác. Ví dụ:
- 260Rf → 4He + 256Fm
Phản ứng phân rã beta:
Trong phản ứng này, một neutron trong hạt nhân Rutherfordi phân rã thành một proton, một electron và một antineutrino. Ví dụ:
- 261Rf → 261Db + e- + ν̄e
Phản ứng bắt giữ electron:
Trong phản ứng này, hạt nhân Rutherfordi bắt giữ một electron và biến thành hạt nhân của một nguyên tố khác. Ví dụ:
- 261Rf + e- → 261Sg
Phản ứng oxy hóa khử:
Rutherfordi cũng có thể tham gia vào các phản ứng oxy hóa khử, ví dụ như phản ứng với axit hoặc bazơ. Ví dụ:
- Rf + 2HCl → RfCl2 + H2
Phản ứng tạo phức:
Rutherfordi có thể tạo phức với các phối tử khác nhau. Ví dụ:
- Rf + 6H2O → [Rf(H2O)6]3+
Lưu ý:
- Do tính phóng xạ cao, Rutherfordi khó nghiên cứu và điều chế.
- Hầu hết các thông tin về phản ứng của Rutherfordi được dự đoán dựa trên các nguyên tố lân cận trong bảng tuần hoàn.
Ví dụ cụ thể:
- Phản ứng của Rutherfordi với axit nitric:
Rutherfordi phản ứng với axit nitric loãng để tạo thành dung dịch nitrat Rutherfordi.
- 2Rf + 6HNO3 → 2Rf(NO3)3 + 3H2
- Phản ứng của Rutherfordi với hydro:
Rutherfordi phản ứng với hydro ở nhiệt độ cao để tạo thành hydride Rutherfordi.
- Rf + 3H2 → RfH3
Vấn đề an toàn của nguyên tố Rutherfordi
Rutherfordi là một nguyên tố phóng xạ cao, do đó nó có thể gây ra một số rủi ro an toàn:
Nguy cơ bức xạ:
- Tiếp xúc với bức xạ từ Rutherfordi có thể gây hại cho sức khỏe con người, bao gồm ung thư, đột biến gen và các vấn đề về hệ thống sinh sản.
- Cần thực hiện các biện pháp phòng ngừa để giảm thiểu nguy cơ tiếp xúc với bức xạ, chẳng hạn như:
- Sử dụng các thiết bị bảo hộ cá nhân như găng tay, quần áo và kính bảo hộ.
- Làm việc trong các khu vực được thiết kế đặc biệt để ngăn chặn bức xạ.
- Theo dõi mức độ phơi nhiễm bức xạ của người lao động.
Nguy cơ ô nhiễm môi trường:
- Rutherfordi có thể gây ô nhiễm môi trường nếu nó được thải ra môi trường không đúng cách.
- Cần thực hiện các biện pháp để kiểm soát sự ô nhiễm môi trường do Rutherfordi, chẳng hạn như:
- Xử lý chất thải Rutherfordi một cách an toàn.
- Theo dõi mức độ ô nhiễm Rutherfordi trong môi trường.
Nguy cơ hỏa hoạn và nổ:
- Rutherfordi có thể tạo ra một lượng nhiệt lớn, do đó nó có thể gây ra hỏa hoạn hoặc nổ nếu nó không được xử lý cẩn thận.
- Cần thực hiện các biện pháp phòng ngừa để giảm thiểu nguy cơ hỏa hoạn và nổ, chẳng hạn như:
- Bảo quản Rutherfordi ở nơi an toàn và mát mẻ.
- Sử dụng các thiết bị và quy trình an toàn để xử lý Rutherfordi.
Đây là những thông tin quan trọng và đặc sắc nhất về nguyên tố mà chúng tôi đã nghiên cứu và biên soạn. Hãy cùng nhau khai thác và tìm hiểu những kiến thức bạn quan tâm!
Nếu bạn có bất kỳ ý kiến hoặc câu hỏi nào về nguyên tố hóa học hay bất kỳ chủ đề nào khác mà bạn muốn tìm hiểu sâu hơn, yeuhoahoc.edu.vn luôn mở cửa chào đón và sẵn lòng cung cấp thông tin đầy đủ và mới nhất, giúp bạn mở rộng vốn hiểu biết trong hành trình khám phá thế giới hóa học không bao giờ kết thúc.







