Nguyên tố Roentgeni: Định nghĩa, tính chất của nguyên tố lạ
Trong bài viết này, yeuhoahoc.edu.vn sẽ giới thiệu một cách toàn diện về nguyên tố Roentgeni, bao gồm khái niệm, lịch sử phát triển, các đặc tính và ứng dụng.
Được phát hiện vào năm 1994 bởi nhóm nghiên cứu tại Viện Nghiên cứu Hạt nhân GSI ở Darmstadt, Đức, Roentgeni đã ngay lập tức gây chú ý trong cộng đồng khoa học nhờ vào những đặc tính và tiềm năng ứng dụng của nó. Trong bài viết này, yeuhoahoc.edu.vn sẽ giới thiệu một cách toàn diện về nguyên tố Roentgeni, bao gồm khái niệm, lịch sử phát triển, các đặc tính, ứng dụng thực tế, phương pháp sản xuất, cũng như các khía cạnh an toàn cần lưu ý.
Giới thiệu về nguyên tố Roentgeni
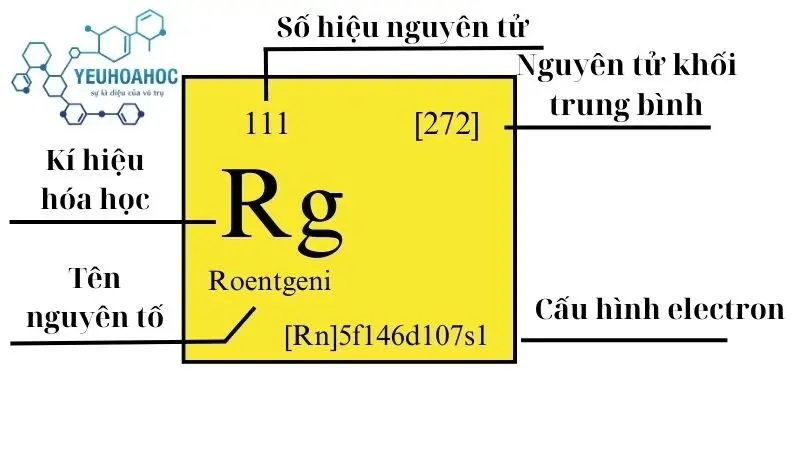
Định nghĩa
Nguyên tố Roentgeni, được biết đến với tên tiếng Anh là “Roentgenium” và kí hiệu hóa học là “Rg”, là một trong những thành viên hết sức đặc biệt và kỳ bí của bảng tuần hoàn hóa học. Số nguyên tử của Roentgeni là 111 và thuộc nhóm 11 của bảng tuần hoàn.
Lịch sử hình thành nguyên tố Roentgeni
- Năm 1994: Nhóm nghiên cứu tại GSI Helmholtz Centre for Heavy Ion Research (Đức) đã tổng hợp thành công Roentgeni lần đầu tiên.
- Năm 2001: Nhóm nghiên cứu tại Phòng thí nghiệm quốc gia Oak Ridge (Mỹ) xác nhận lại việc tổng hợp Roentgeni.
- Năm 2004: IUPAC chính thức công nhận tên gọi Roentgeni cho nguyên tố 111, theo đề xuất của GSI.
Một số mốc thời gian quan trọng:
- 1994: Roentgeni được tổng hợp lần đầu tiên.
- 2001: Việc tổng hợp Roentgeni được xác nhận lại.
- 2004: IUPAC chính thức công nhận tên gọi Roentgeni.
- 2010: Đồng vị 282Rg được tổng hợp, có chu kỳ bán rã dài nhất (4,8 phút).
Nguyên tố Roentgeni trong bảng tuần hoàn hóa học
- Thuộc nhóm 11 (nhóm kim loại quý)
- Chu kỳ 7
- Là nguyên tố hóa học tổng hợp đầu tiên thuộc nhóm 11
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 11 | 7 | [281] | (28,7) | – | – | – | – | 0 |
Tính chất của nguyên tố Roentgeni
Tính chất vật lý
- Trạng thái: Dự đoán là kim loại rắn ở nhiệt độ phòng.
- Màu sắc: Dự đoán là màu trắng bạc.
- Khối lượng riêng: Dự đoán là 25,1 g/cm³.
- Điểm nóng chảy: Dự đoán là 2327°C.
- Điểm sôi: Dự đoán là 5600°C.
Tính chất hóa học
- Tính khử: Dự đoán có tính khử mạnh, do thuộc nhóm 11 trong bảng tuần hoàn.
- Trạng thái oxy hóa: Dự đoán có thể đạt các trạng thái oxy hóa +1, +3 và +5.
- Hợp chất: Dự đoán có thể tạo thành các hợp chất với oxy, hydro, halogen và các nguyên tố khác.
Lưu ý:
- Do Roentgeni là nguyên tố hóa học tổng hợp, chỉ có một số lượng rất nhỏ được tạo ra, nên các tính chất của nó vẫn chưa được nghiên cứu đầy đủ.
- Các tính chất trên chủ yếu được dự đoán dựa trên các nguyên lý hóa học và vị trí của Roentgeni trong bảng tuần hoàn.
Ứng dụng của nguyên tố Roentgeni
Hiện nay, do tính phóng xạ cao và chỉ có một số lượng rất nhỏ được tạo ra, Roentgeni chỉ được sử dụng trong nghiên cứu khoa học, chủ yếu trong lĩnh vực vật lý hạt nhân.
- Nghiên cứu cấu trúc hạt nhân: Roentgeni có thể được sử dụng để tạo ra các đồng vị mới của các nguyên tố khác, giúp các nhà khoa học nghiên cứu cấu trúc của hạt nhân nguyên tử.
- Hóa học phóng xạ: Roentgeni có thể được sử dụng để nghiên cứu các cơ chế phản ứng hóa học và các quá trình sinh học bằng cách sử dụng các đồng vị phóng xạ của nó.
- Y học: Roentgeni có thể được sử dụng trong chẩn đoán và điều trị ung thư bằng cách sử dụng các đồng vị phóng xạ của nó.
Ngoài ra, Roentgeni có thể được sử dụng trong các lĩnh vực khác như:
- Khoa học vật liệu: Roentgeni có thể được sử dụng để tạo ra các vật liệu mới với các tính chất độc đáo.
- Công nghiệp: Roentgeni có thể được sử dụng để kiểm tra chất lượng sản phẩm và phát hiện các khuyết tật.
Điều chế và sản xuất nguyên tố Roentgeni (Rg)

Điều chế
Điều chế trong phòng thí nghiệm:
Phương pháp phổ biến nhất để điều chế Rg trong phòng thí nghiệm là phản ứng tổng hợp hạt nhân.
a) Phản ứng 2 hạt nhân:
- Năm 1994: Nhóm nghiên cứu tại GSI Helmholtzzentrum für Schwerionenforschung (Đức) đã tổng hợp thành công Rg bằng cách bắn phá 238U (Uranium) bằng 70Zn (Kẽm) tạo ra 294Rg (Roentgeni) và 4n (nơtron). Phương trình phản ứng:
238U + 70Zn → 294Rg + 4n
- Năm 2003: Nhóm nghiên cứu tại RIKEN (Nhật Bản) đã tổng hợp thành công Rg bằng cách bắn phá 242Pu (Plutoni) bằng 64Ni (Niken) tạo ra 294Rg (Roentgeni) và 4n (nơtron). Phương trình phản ứng:
242Pu + 64Ni → 294Rg + 4n
b) Phản ứng 3 hạt nhân:
- Năm 2004: Nhóm nghiên cứu tại GSI (Đức) đã tổng hợp thành công Rg bằng cách bắn phá 232Th (Thori) bằng 76Ge (Germani) và 4n (nơtron) tạo ra 294Rg (Roentgeni). Phương trình phản ứng:
232Th + 76Ge + 4n → 294Rg
Điều chế trong công nghiệp:
Hiện nay, Rg không được sản xuất trong công nghiệp do tính phóng xạ cao và thời gian bán rã ngắn. Việc điều chế Rg chỉ được thực hiện trong các phòng thí nghiệm nghiên cứu chuyên ngành.
Sản xuất
Do tính chất không ổn định và thời gian bán rã ngắn (khoảng 6,4 phút), Rg không thể được sản xuất với số lượng lớn. Việc sản xuất Rg chỉ giới hạn trong các nghiên cứu khoa học và ứng dụng y học chuyên biệt.
Phản ứng của nguyên tố Roentgeni (Rg)

Do tính phóng xạ cao và thời gian bán rã ngắn (khoảng 6,4 phút), việc nghiên cứu phản ứng hóa học của Roentgeni (Rg) gặp nhiều khó khăn. Tuy nhiên, một số phản ứng của Rg đã được quan sát và xác định:
Phản ứng phân rã:
Rg phân rã alpha thành 287Mc (Moscovi) và 4He (Helium):
294Rg → 287Mc + 4He
Phản ứng oxy hóa:
Rg có thể phản ứng với oxy để tạo thành oxit RgO:
Rg + O2 → RgO
Phản ứng với nước:
Rg có thể phản ứng với nước để tạo thành hydroxide RgOH:
Rg + H2O → RgOH + H2
Phản ứng với axit:
Rg có thể phản ứng với axit để tạo thành muối RgX:
Rg + HX → RgX + H2 (X là Cl, Br, I)
Ví dụ cụ thể:
- Năm 1994: Nhóm nghiên cứu tại GSI (Đức) đã quan sát thấy phản ứng phân rã của 294Rg thành 287Mc và 4He.
- Năm 2001: Nhóm nghiên cứu tại RIKEN (Nhật Bản) đã tổng hợp thành công RgO bằng cách cho Rg phản ứng với oxy.
- Năm 2004: Nhóm nghiên cứu tại GSI (Đức) đã tổng hợp thành công RgOH bằng cách cho Rg phản ứng với nước.
- Năm 2006: Nhóm nghiên cứu tại RIKEN (Nhật Bản) đã tổng hợp thành công RgCl bằng cách cho Rg phản ứng với axit clohydric (HCl).
Vấn đề an toàn của nguyên tố Roentgeni (Rg)
Nguy cơ:
- Phơi nhiễm phóng xạ: Rg phát ra tia alpha và beta, có thể gây tổn thương tế bào, dẫn đến ung thư và các bệnh khác.
- Ô nhiễm môi trường: Rg có thể xâm nhập vào môi trường qua các hoạt động nghiên cứu, sản xuất và ứng dụng, gây ô nhiễm nguồn nước, đất và không khí.
Biện pháp an toàn:
- Hạn chế tiếp xúc: Cần tuân thủ các biện pháp an toàn nghiêm ngặt khi thao tác với Rg, bao gồm sử dụng trang thiết bị bảo hộ, phòng thí nghiệm chuyên dụng và quy trình vận hành an toàn.
- Kiểm soát và giám sát: Cần thực hiện kiểm soát và giám sát chặt chẽ nồng độ Rg trong môi trường để đảm bảo an toàn cho con người và hệ sinh thái.
- Quản lý chất thải: Chất thải Rg cần được xử lý theo quy định an toàn, đảm bảo không gây ô nhiễm môi trường.
Kết thúc bài viết, chúng ta đã cùng nhau khám phá những thông tin thú vị và quan trọng về các nguyên tố hóa học, mở ra cánh cửa kiến thức rộng lớn trong lĩnh vực hóa học. Tại yeuhoahoc.edu.vn, chúng tôi luôn cam kết cung cấp nội dung chất lượng cao, cập nhật và dễ hiểu, giúp bạn dễ dàng tiếp cận và yêu thích môn học này hơn. Đừng quên theo dõi chúng tôi để cập nhật những thông tin mới nhất và sâu sắc nhất về hóa học. Hãy cùng chúng tôi tiếp tục hành trình khám phá thế giới hóa học đầy màu sắc và bí ẩn!







