Nguyên tố Rhodi: Sự quý giá và ứng dụng của kim loại hiếm
Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Rhodium, từ định nghĩa, lịch sử phát hiện đến vị trí của nó trong bảng tuần hoàn hóa học.
Trong thế giới lấp lánh của các kim loại quý, Rhodium (Rh) tỏa sáng với vẻ đẹp và tính ứng dụng đa dạng không kém phần ấn tượng. Với kí hiệu Rh và số nguyên tử 45, Rhodium không chỉ là một trong những kim loại quý hiếm nhất mà còn được coi là kim loại có giá trị cao trong nhiều ngành công nghiệp. Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Rhodium, từ định nghĩa, lịch sử phát hiện đến vị trí của nó trong bảng tuần hoàn hóa học và những ứng dụng không thể thiếu trong đời sống hiện đại.
Giới thiệu về nguyên tố Rhodium
Định Nghĩa
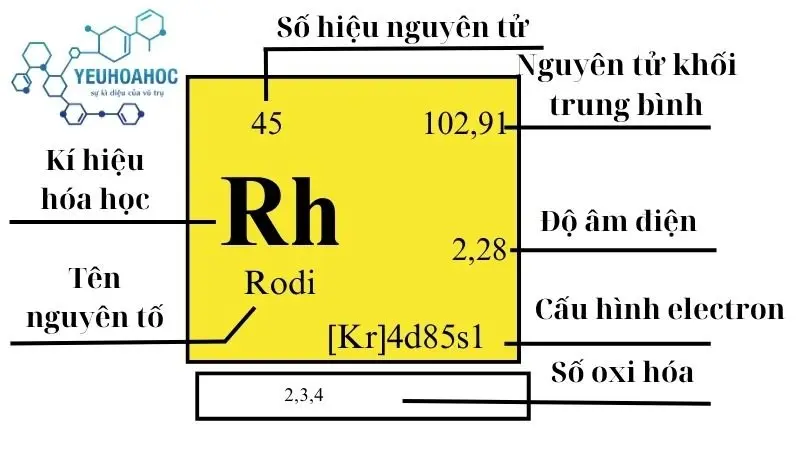
Rhodi là một nguyên tố hóa học với tên tiếng Anh là “Rhodium”, kí hiệu là Rh. Đây là một kim loại chuyển tiếp có màu trắng bạc, nổi tiếng với độ cứng, độ bền và khả năng phản xạ ánh sáng cao, khiến nó trở thành lựa chọn hàng đầu trong ngành trang sức và ngành công nghiệp ô tô.
Lịch sử hình thành nguyên tố Rhodi
- 1803: William Hyde Wollaston phát hiện ra Rhodi trong quặng platin.
- 1804: Wollaston công bố khám phá của mình.
- 1904: Rhodi được sử dụng lần đầu tiên trong các hợp kim với platin để làm đồ trang sức.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1750: Antonio de Ulloa phát hiện ra một loại quặng platin mới ở Nam Mỹ.
- 1780: Charles Scheele xác định platin là một nguyên tố mới.
- 1803: William Hyde Wollaston phát hiện ra Rhodi, Iridi, Palladium và Osmi trong quặng platin.
- 1828: Friedrich Wöhler và Justus von Liebig tổng hợp Rhodi lần đầu tiên.
Nguyên tố Rhodi trong bảng tuần hoàn hóa học

Rhodi nằm ở chu kỳ 5, nhóm 9 (VIIIB) của bảng tuần hoàn hóa học. Nó là một kim loại chuyển tiếp quý hiếm có tính bền cao. Rhodi không có đồng vị bền nào và tất cả các đồng vị của nó đều phân rã thành các nguyên tố khác. Đồng vị Rhodi lâu đời nhất là 101Rh có chu kỳ bán rã 3,03 năm.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 9 | 5 | 102,90550(2) | 12,41 | 2237 | 3968 | 0,243 | 2,28 | 0,001 |
Tính chất của nguyên tố Rhodi
Tính chất vật lý
- Trạng thái: Rắn
- Màu sắc: Trắng bạc
- Cấu trúc tinh thể: Lập phương tâm mặt
- Khối lượng riêng: 12,41 g/cm³
- Điểm nóng chảy: 1964 °C
- Điểm sôi: 3700 °C
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
- Tính dẻo: Dẻo
- Tính dai: Dai
Tính chất hóa học
- Trạng thái oxy hóa: +1, +2, +3, +4
- Tính khử: Yếu
- Tính oxi hóa: Mạnh
- Tác dụng với axit: Rhodi không tan trong hầu hết các axit.
- Tác dụng với bazơ: Rhodi không tan trong bazơ.
- Tác dụng với kim loại: Rhodi tạo hợp kim với nhiều kim loại khác.
- Tác dụng với phi kim loại: Rhodi tạo hợp chất với nhiều phi kim loại khác.
Một số tính chất hóa học đặc biệt:
- Rhodi có thể tồn tại ở nhiều trạng thái oxy hóa khác nhau.
- Rhodi tạo thành nhiều hợp chất với các nguyên tố khác nhau.
- Rhodi là một chất khử yếu và một chất oxi hóa mạnh.
Lưu ý:
- Rhodi là một kim loại quý hiếm và đắt tiền.
- Rhodi có thể gây hại cho sức khỏe nếu tiếp xúc với lượng lớn.
Ứng dụng của nguyên tố Rhodi

Hợp kim
Rhodi được sử dụng để làm hợp kim với platin và các kim loại khác để cải thiện độ cứng, độ bền và khả năng chống ăn mòn. Hợp kim Rhodi được sử dụng trong nhiều lĩnh vực như:
- Chế tạo đồ trang sức
- Chế tạo dụng cụ y tế
- Sản xuất các thành phần trong lĩnh vực công nghiệp hóa học.
- Chế tạo điện cực
Bộ chuyển đổi xúc tác
Rhodi là một thành phần quan trọng trong các bộ chuyển đổi xúc tác được sử dụng để giảm khí thải từ ô tô. Rhodi giúp xúc tác quá trình chuyển đổi các chất độc hại như NOx và CO thành các chất vô hại như N2 và CO2.
Lớp phủ
Rhodi được sử dụng để làm lớp phủ cho các đồ trang sức, dụng cụ y tế và các vật dụng khác để cải thiện độ bền và khả năng chống ăn mòn. Lớp phủ Rhodi cũng giúp tăng độ bóng và vẻ đẹp cho các sản phẩm.
Điện tử
- Rhodi được sử dụng trong các thiết bị điện tử để làm điện trở và các tiếp điểm. Rhodi có khả năng dẫn điện tốt và chống ăn mòn cao, giúp đảm bảo độ bền và hiệu quả cho các thiết bị điện tử.
Các ứng dụng khác
Rhodi được sử dụng trong một số ứng dụng khác như:
- Chế tạo các dụng cụ thí nghiệm
- Chế tạo các hợp kim chịu nhiệt
- Chế tạo các lớp phủ quang học
Điều chế và sản xuất nguyên tố Rhodi
Điều chế
Trong phòng thí nghiệm
- Rhodi có thể được điều chế bằng cách khử muối rhodi(III) bằng hydro hoặc natri hydroxit. Ví dụ:
RhCl3 + 3H2 → Rh + 3HCl
RhCl3 + 3NaOH → Rh + 3NaCl + H2O
- Rhodi cũng có thể được điều chế bằng cách điện phân dung dịch muối rhodi(III).
Trong công nghiệp
- Rhodi được sản xuất chủ yếu từ quặng platin. Quặng platin được nghiền nát và nung chảy để chiết xuất các kim loại quý hiếm. Sau đó, Rhodi được tách ra khỏi các kim loại khác bằng phương pháp thủy luyện.
Sản xuất
- Rhodi được sản xuất ở một số quốc gia trên thế giới, bao gồm Nam Phi, Nga và Canada.
- Nhu cầu về Rhodi đang tăng lên do các ứng dụng của nó trong các lĩnh vực như:
- Chế tạo ô tô
- Chế tạo đồ trang sức
- Chế tạo các thiết bị điện tử
Phản ứng của nguyên tố Rhodi
Rhodi là một kim loại quý hiếm có tính bền hóa học cao. Do đó, Rhodi ít tham gia vào các phản ứng hóa học hơn so với các kim loại khác. Nó có một số phản ứng đặc biết như:
Phản ứng với axit
- Rhodi không tan trong axit hydrochloric loãng hoặc axit nitric loãng.
- Rhodi tan trong axit sulfuric đặc nóng. Ví dụ:
Rh + 2H2SO4 → Rh2(SO4)3 + 3H2
Phản ứng với bazơ
- Rhodi không tan trong bazơ.
Phản ứng với kim loại
- Rhodi có thể tạo hợp kim với nhiều kim loại khác. Ví dụ:
Rh + Pt → RhPt
Phản ứng với phi kim loại
- Rhodi có thể tạo hợp chất với một số phi kim loại, ví dụ như:
Rh + 2Cl2 → RhCl4
Phản ứng oxy hóa khử
- Rhodi có thể thể hiện nhiều trạng thái oxy hóa khác nhau trong các phản ứng oxy hóa khử. Ví dụ:
RhCl3 + 3e- → Rh + 3Cl-
Ví dụ cụ thể:
- Phản ứng của Rhodi với axit sulfuric đặc nóng:
Rh + 2H2SO4 → Rh2(SO4)3 + 3H2
- Phản ứng của Rhodi với platin:
Rh + Pt → RhPt
- Phản ứng của Rhodi với clo:
Rh + 2Cl2 → RhCl4
- Phản ứng oxy hóa khử của Rhodi:
RhCl3 + 3e- → Rh + 3Cl-
Vấn đề an toàn khi sử dụng nguyên tố Rhodi
Khi sử dụng nguyên tố Rhodium (Rh), việc đảm bảo an toàn là rất quan trọng do một số tính chất đặc biệt và giá trị cao của nó
Hóa chất độc hại
Mặc dù Rhodium kim loại ít gây hại, nhưng các hợp chất của Rhodium, đặc biệt là những hợp chất dễ bay hơi như Rhodium chloride, có thể gây độc nếu tiếp xúc. Chúng có thể gây kích ứng da, mắt và đường hô hấp nếu không được xử lý cẩn thận.
Bụi và hạt mịn
Quá trình chế biến hoặc mài mòn Rhodium có thể tạo ra bụi hoặc hạt mịn. Việc hít phải bụi kim loại có thể gây ra vấn đề về hô hấp, đặc biệt trong môi trường làm việc không được thông gió tốt.
Biện pháp bảo vệ cá nhân
Khi xử lý Rhodium và hợp chất của nó, cần sử dụng đầy đủ thiết bị bảo hộ cá nhân bao gồm găng tay, kính bảo hộ và khẩu trang hoặc mặt nạ phòng độc để ngăn chặn tiếp xúc trực tiếp và hít phải hạt bụi.
Thiết bị an toàn và thông gió
- Cần đảm bảo rằng khu vực làm việc được trang bị hệ thống thông gió tốt để loại bỏ hơi độc và bụi kim loại. Trong một số trường hợp, việc sử dụng tủ hút khí độc là cần thiết để bảo vệ sức khỏe của người lao động.
Tái chế và xử lý chất thải
- Do giá trị cao và tính chất độc hại của một số hợp chất Rhodium, việc tái chế và xử lý chất thải cần được thực hiện một cách cẩn thận và tuân thủ các quy định môi trường.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Rhodi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Rhodi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







