Nguyên tố Radon: Từ phát hiện đến hiểu biết
Trong bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá về nguyên tố Radon, từ định nghĩa cơ bản đến lịch sử hình thành và vị trí trong bảng tuần hoàn.
Nguyên tố Radon, một thành viên bí ẩn của bảng tuần hoàn hóa học, đã từng là đề tài của nhiều nghiên cứu và thảo luận trong cộng đồng khoa học. Trong bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá về nguyên tố Radon, từ định nghĩa cơ bản đến lịch sử hình thành và vị trí của nó trong bảng tuần hoàn.
Giới thiệu nguyên tố Radon
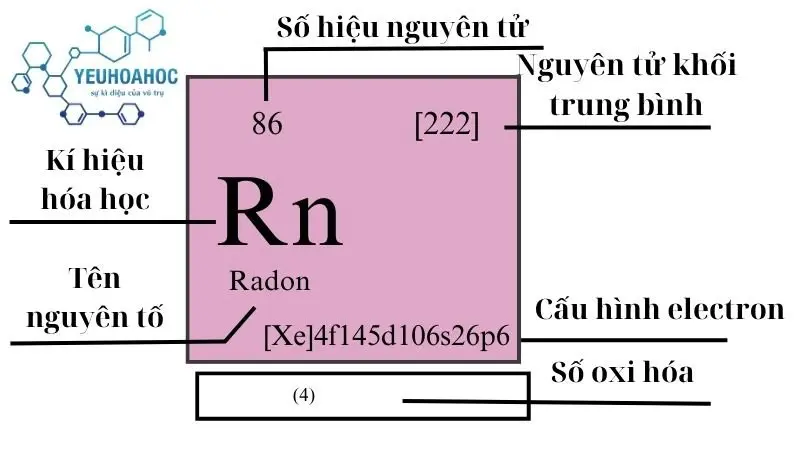
Định nghĩa
Radon (tiếng Anh: Radon) với kí hiệu hóa học là Rn, là nguyên tố hóa học có số nguyên tử là 86. Đây là một khí hiếm, không màu, không mùi, không vị, và là nguyên tố phóng xạ tự nhiên. Radon thuộc nhóm khí hiếm trong bảng tuần hoàn, nằm ở chu kỳ 6 và nhóm 18, cùng với Helium, Neon, Argon, Krypton, và Xenon.
Lịch sử hình thành nguyên tố Radon:
Năm 1899 – 1900: Radon lần đầu tiên được phát hiện bởi Friedrich Ernst Dorn, một nhà vật lý người Đức, khi ông quan sát thấy một loại khí phóng xạ thoát ra từ Radium. Ban đầu, nguyên tố này được gọi là “Radium Emanation”.
Một số điểm nổi bật trong quá trình tìm hiểu lịch sử.
- 1900: Friedrich Ernst Dorn phát hiện ra radon.
- 1910: William Ramsay và Robert Whytlaw-Gray xác định radon là một nguyên tố.
- 1929: Pierre Curie và Marie Curie phát hiện ra radon có thể gây ra ung thư phổi.
Nguyên tố Radon trong bảng tuần hoàn hóa học:
- Radon nằm ở chu kỳ 6, nhóm 18 (khí trơ) của bảng tuần hoàn hóa học.
- Nó là nguyên tố nặng nhất trong nhóm khí trơ.
- Radon có tính chất hóa học tương tự như các khí trơ khác, nhưng nó ít phản ứng hơn do tính phóng xạ cao.
- Radon có 39 đồng vị, tất cả đều không bền. Đồng vị bền nhất là Rn-222, có chu kỳ bán rã là 3,8 ngày.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 18 | 6 | [222] | 0,00973 | 202 | 211,3 | 0,094 | 2,2 | <0,001 |
Tính chất của nguyên tố Radon
Tính chất vật lý
- Radon là một khí không màu, không mùi và không vị.
- Nó là khí nặng nhất trong nhóm khí trơ, với mật độ 9,73 g/L ở 0°C và 1 atm.
- Radon là chất khí hóa lỏng ở -61,8°C và hóa rắn ở -71°C.
- Radon có tính tan trong nước thấp hơn so với các khí trơ khác.
- Radon có khả năng khuếch tán cao và có thể di chuyển qua các khe hở nhỏ trong vật liệu.
Tính chất hóa học
- Radon là một khí trơ, có nghĩa là nó tương đối không hoạt động về mặt hóa học.
- Radon không phản ứng với hầu hết các chất khác ở nhiệt độ phòng.
- Radon có thể phản ứng với một số kim loại và phi kim loại ở nhiệt độ cao.
- Radon có thể tạo thành các hợp chất với oxy, flo và clo.
Dưới đây là một số ví dụ về tính chất hóa học của Radon:
- Phản ứng với kim loại: Radon có thể phản ứng với một số kim loại, chẳng hạn như natri và kali, để tạo thành radonide. Ví dụ:
2Rn + 2Na → 2NaRn
- Phản ứng với phi kim loại: Radon có thể phản ứng với một số phi kim loại, chẳng hạn như oxy và flo, để tạo thành oxit và florua. Ví dụ:
Rn + O2 → RnO2
Rn + 2F2 → RnF2
Lưu ý:
- Radon là một nguyên tố nguy hiểm và cần được xử lý cẩn thận bởi các chuyên gia được đào tạo.
- Tiếp xúc với radon có thể dẫn đến ngộ độc phóng xạ, có thể gây ra các vấn đề sức khỏe nghiêm trọng, bao gồm cả ung thư.
- Radon đứng đầu trong các nguyên nhân gây ra ung thư phổi cho những người không tiêu thụ thuốc lá.
Ứng dụng của nguyên tố Radon

Y học
- Radon được sử dụng trong liệu pháp xạ trị để điều trị ung thư, đặc biệt là ung thư tuyến giáp.
- Radon cũng được sử dụng để tạo ra các nguồn bức xạ alpha để sử dụng trong chẩn đoán y tế.
Nghiên cứu khoa học
- Radon-210 được sử dụng trong các nghiên cứu khoa học về vật liệu, hóa học và sinh học.
- Radon-210 cũng được sử dụng để tạo ra các nguồn neutron để sử dụng trong các thí nghiệm vật lý.
Công nghiệp
- Radon-210 được sử dụng trong các thiết bị đo độ dày và các thiết bị chống tĩnh điện.
- Radon-210 cũng được sử dụng trong các nguồn năng lượng hạt nhân cỡ nhỏ để sử dụng trong các thiết bị vũ trụ.
Lưu ý:
- Việc sử dụng radon tiềm ẩn nhiều nguy cơ do tính phóng xạ của nó. Cần có các biện pháp an toàn nghiêm ngặt để bảo vệ người sử dụng khỏi bức xạ.
- Do tính nguy hiểm, việc sử dụng radon ngày càng được hạn chế. Các nhà khoa học đang tìm kiếm các phương pháp thay thế an toàn hơn để sử dụng trong các lĩnh vực y học, nghiên cứu khoa học và công nghiệp.
Phản ứng của nguyên tố Radon
Phân rã alpha
Radon-222 (Rn-222) là đồng vị phổ biến nhất của radon. Nó phân rã alpha thành polonium-218 (Po-218) và giải phóng hạt alpha:
222Rn → 218Po + 4He2
Phân rã beta
Radon-211 (Rn-211) phân rã beta thành chì-211 (Pb-211) và giải phóng hạt beta:
211Rn → 211Pb + -1e0
Phản ứng với kim loại
Radon có thể phản ứng với một số kim loại, chẳng hạn như natri và kali, để tạo thành radonide. Ví dụ:
2Rn + 2Na → 2NaRn
Phản ứng với phi kim loại
Radon có thể phản ứng với một số phi kim loại, chẳng hạn như oxy và flo, để tạo thành oxit và florua. Ví dụ:
Rn + O2 → RnO2
Rn + 2F2 → RnF2
Điều chế và sản xuất nguyên tố Radon
Điều chế
Điều chế trong phòng thí nghiệm
Radon có thể được điều chế trong phòng thí nghiệm bằng cách cho radium phân rã alpha. Radium là một nguyên tố phóng xạ tự nhiên phân rã thành radon và hạt alpha:
226Ra → 222Rn + 4He2
Radon được giải phóng từ radium có thể được thu thập bằng cách sử dụng các phương pháp hóa học hoặc vật lý.
Điều chế trong công nghiệp
Radon không được sản xuất thương mại do tính nguy hiểm và tính phóng xạ của nó. Tuy nhiên, radon có thể được thu thập từ các nguồn tự nhiên, chẳng hạn như khí tự nhiên và nước ngầm.
Sản xuất
Radon không được sản xuất thương mại do tính nguy hiểm và tính phóng xạ của nó. Sự áp dụng của radon bị giới hạn trong một số ngành như y tế, nghiên cứu khoa học và công nghiệp.
Vấn đề an toàn của nguyên tố Radon

Nguy cơ sức khỏe do radon
Radon đứng đầu trong các nguyên nhân gây ra ung thư phổi cho những người không tiêu thụ thuốc lá.
Mức độ radon cao có thể gây ra các vấn đề sức khỏe khác, bao gồm:
- Ung thư phổi
- Bệnh tim
- Bệnh đột quỵ
- Bệnh Alzheimer
- Bệnh Parkinson
Cách kiểm tra radon:
- Mức độ radon có thể được kiểm tra bằng bộ dụng cụ kiểm tra radon.
- Bộ dụng cụ kiểm tra radon có thể được mua tại các cửa hàng phần cứng hoặc trực tuyến.
- Việc kiểm tra radon nên được thực hiện trong ít nhất hai tháng.
Cách giảm thiểu radon:
- Có một số cách để giảm thiểu radon trong nhà và các tòa nhà, bao gồm:
- Hệ thống thông gió radon
- Hệ thống giảm áp radon
- Tăng cường độ kín của nhà
- Sử dụng vật liệu xây dựng có hàm lượng radon thấp
Dưới đây là bản tóm tắt các thông tin cơ bản về nguyên tố Radon mà chúng tôi đã thu thập. Mời bạn đọc tiếp và khám phá thêm thông tin về chủ đề này!
Chúng tôi mong rằng bạn đã có được một cái nhìn toàn diện và chi tiết về nguyên tố Radon qua bài viết này. Nếu có bất cứ thắc mắc nào hoặc bạn muốn tìm hiểu thêm, hãy thoải mái để lại lời bình luận ở phía dưới!







