Nguyên tố Radi: Định nghĩa và vai trò trong bảng tuần hoàn
Bài viết này, yeuhoahoc.edu.vn sẽ đưa bạn vào thế giới của nguyên tố Radi, từ định nghĩa cơ bản, lịch sử phát hiện, cho đến vị trí trong bảng tuần hoàn hóa học.
Radi, một nguyên tố hóa học với sức hấp dẫn và bí ẩn không ngừng thu hút sự chú ý của giới khoa học, đã và đang mở ra những khám phá đột phá, đồng thời đặt ra những thách thức trong việc ứng dụng và bảo vệ sức khỏe con người. Bài viết này, yeuhoahoc.edu.vn sẽ đưa bạn vào thế giới của nguyên tố Radi, từ định nghĩa cơ bản, lịch sử phát hiện, cho đến vị trí của nó trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Radi
Định nghĩa
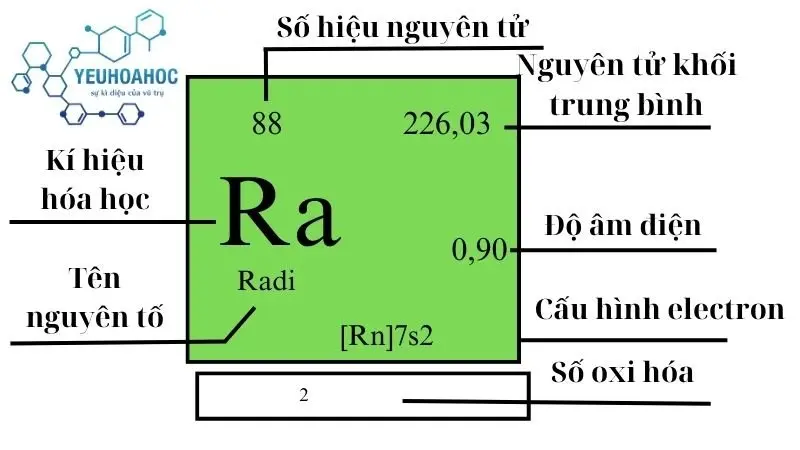
Nguyên tố Radi (tên tiếng Anh: Radium), với kí hiệu hóa học là Ra, là một nguyên tố hóa học thuộc nhóm kim loại kiềm thổ, được biết đến với tính phóng xạ mạnh mẽ. Radi là nguyên tố thứ 88 trong bảng tuần hoàn hóa học, và nó nằm trong nhóm các nguyên tố phóng xạ tự nhiên có khả năng phát ra tia α, β, và γ, đem lại ứng dụng rộng rãi trong nghiên cứu khoa học và y học, nhưng cũng kèm theo những rủi ro đối với sức khỏe.
Lịch sử hình thành nguyên tố Radi
1898: Marie Curie và Pierre Curie khám phá ra radium trong quặng urani.
1902: Marie Curie thành công trong việc chiết xuất radium tinh khiết.
1903: Marie Curie và Pierre Curie cùng với Henri Becquerel được trao giải Nobel Vật lý cho những nghiên cứu về phóng xạ.
1910: Radium được sử dụng trong y học để điều trị ung thư.
1920-1930: Radium được sử dụng rộng rãi trong nhiều lĩnh vực như y học, công nghiệp và khoa học.
1940-1950: Nguy cơ tiềm ẩn của việc sử dụng radium được nhận thức rõ ràng, dẫn đến việc hạn chế sử dụng nguyên tố này.
Ngày nay: Radium vẫn được sử dụng trong một số lĩnh vực y tế và công nghiệp, nhưng với các biện pháp an toàn nghiêm ngặt.
Nguyên tố Radi trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn hóa học, Radi nằm ở nhóm 2, là một phần của nhóm các kim loại kiềm thổ. Nó có số hiệu nguyên tử 88 và là một trong những nguyên tố phóng xạ tự nhiên mạnh nhất. Dù nằm trong cùng nhóm với các nguyên tố như canxi và magiê, Radi đặc biệt hơn với tính phóng xạ cao, làm cho nó có ứng dụng đặc biệt trong nhiều lĩnh vực nhưng cũng yêu cầu sự cẩn trọng cao khi sử dụng.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 2 | 7 | [226] | 5,5 | 973 | 2010 | 0,094 | 0,9 | <0,001 |
Tính chất của nguyên tố Radi (Radium)
Tính chất vật lý
- Số nguyên tử: 88
- Khối lượng nguyên tử: 226,0254 u
- Trạng thái: Rắn
- Màu sắc: Trắng bạc, nhưng dễ bị oxy hóa khi tiếp xúc với không khí chuyển sang màu đen
- Nhiệt độ nóng chảy: 700 °C
- Nhiệt độ sôi: 1140 °C
- Mật độ: 5,5 g/cm³
- Tính dẫn điện: Tốt
- Tính dẫn nhiệt: Tốt
Tính chất hóa học
- Tính kim loại: Mạnh
- Tính khử: Trung bình
- Cấu hình electron: [Rn] 7s²
- Hóa trị: +2
- Tác dụng với nước: Phản ứng với nước tạo thành dung dịch bazơ mạnh và khí hydro
- Tác dụng với axit: Phản ứng với axit tạo thành muối radium và khí hydro
- Tác dụng với kim loại: Phản ứng với một số kim loại tạo thành hợp kim
- Tính phóng xạ: Radium là một nguyên tố phóng xạ mạnh, phát ra tia alpha, beta và gamma.
Lưu ý:
- Radium là một nguyên tố nguy hiểm vì tính phóng xạ của nó. Tiếp xúc với radium có thể gây ra các vấn đề sức khỏe nghiêm trọng, bao gồm ung thư, bệnh bạch cầu và thiếu máu.
- Radium hiện nay không còn được sử dụng rộng rãi do tính nguy hiểm của nó. Tuy nhiên, nó vẫn được sử dụng trong một số ứng dụng y tế, chẳng hạn như điều trị ung thư.
Ứng dụng của nguyên tố Radi (Radium)

Y học
- Điều trị ung thư: Radium được sử dụng để điều trị ung thư bằng cách chiếu xạ trực tiếp vào khối u. Tuy nhiên, phương pháp này có thể gây ra các tác dụng phụ nghiêm trọng, bao gồm bỏng da và tổn thương mô.
- Chẩn đoán bệnh: Radium được sử dụng trong chụp X-quang để giúp chẩn đoán các bệnh lý. Tuy nhiên, hiện nay đã có các phương pháp chẩn đoán an toàn và hiệu quả hơn.
Công nghiệp
- Sơn phát sáng: Radium được sử dụng để tạo ra sơn phát sáng trong bóng tối. Tuy nhiên, việc sử dụng Radium trong sơn đã bị cấm do nguy cơ ảnh hưởng đến sức khỏe.
- Đo lường: Radium được sử dụng trong các thiết bị đo lường, chẳng hạn như máy đo độ dày và máy đo độ tuổi. Tuy nhiên, hiện nay đã có các thiết bị đo lường an toàn và hiệu quả hơn.
Nghiên cứu khoa học
- Nghiên cứu về phóng xạ: Radium được sử dụng để nghiên cứu về bản chất của phóng xạ và ảnh hưởng của nó đến vật chất.
- Nghiên cứu về cấu tạo nguyên tử: Radium được sử dụng để nghiên cứu về cấu tạo nguyên tử và các nguyên lý của vật lý hạt nhân.
Ngoài ra, Radium còn có một số ứng dụng khác, chẳng hạn như:
- Sản xuất khí Radon: Radium được sử dụng để sản xuất khí Radon, một loại khí phóng xạ được sử dụng trong y học để điều trị ung thư.
- Xử lý nước thải: Radium được sử dụng để xử lý nước thải bằng cách tiêu diệt các vi sinh vật.
Điều chế và sản xuất nguyên tố Radi
Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp 1: Khử RaCl₂ bằng BaCl₂:
RaCl₂ + BaCl₂ → RaSO₄↓ + BaCl₂
RaSO₄ + 2HCl → RaCl₂ + H₂SO₄
- Phương pháp 2: Điện phân dung dịch RaCl₂:
Cathode: Ra²⁺ + 2e⁻ → Ra
Anode: 2Cl⁻ → Cl₂ + 2e⁻
Điều chế trong công nghiệp:
- Phương pháp 1: Chiết xuất từ quặng urani:
- Quặng urani được nghiền mịn và xử lý bằng axit nitric.
- Dung dịch thu được được làm bay hơi để cô đặc.
- Radium được kết tủa dưới dạng RaSO₄.
- RaSO₄ được nung nóng để chuyển thành RaO.
- RaO được khử bằng hydro để thu được Ra.
Phương pháp 2: Chiết xuất từ thorianite:
- Thorianite là một loại khoáng sản chứa thorium.
- Thorium được chiết xuất từ thorianite và chuyển đổi thành RaCl₂.
- Radium được chiết xuất từ RaCl₂ bằng phương pháp điện phân.
Sản xuất
- Radium không còn được sản xuất thương mại do nguy cơ phơi nhiễm phóng xạ cao.
- Một lượng nhỏ radium vẫn được sản xuất cho các mục đích nghiên cứu và y tế.
Lưu ý:
- Radium là nguyên tố nguy hiểm, cần được xử lý cẩn thận để tránh phơi nhiễm phóng xạ.
- Các phương pháp điều chế và sản xuất radium được mô tả ở đây chỉ dành cho mục đích thông tin.
- Không nên thực hiện các thí nghiệm điều chế radium mà không có chuyên
môn và thiết bị an toàn phù hợp.
Phản ứng của nguyên tố Radi (Radium)
Phản ứng với nước
Radium phản ứng với nước tạo thành dung dịch bazơ mạnh và khí hydro:
Ra + 2H2O → Ra(OH)2 + H2↑
Phản ứng với axit
Radium phản ứng với axit tạo thành muối radium và khí hydro:
Ra + 2HCl → RaCl2 + H2↑
Phản ứng với kim loại
Radium phản ứng với một số kim loại tạo thành hợp kim:
2Ra + Mg → Mg2Ra
Phản ứng phân rã phóng xạ
Radium là một nguyên tố phóng xạ, nó phân rã thành các nguyên tố khác, ví dụ như Radon (Rn):
226Ra → 222Rn + 4He
Ví dụ cụ thể:
- Radium phản ứng với dung dịch axit clohydric:
Khi cho một viên Radium vào dung dịch axit clohydric, sẽ có khí hydro thoát ra và dung dịch có màu vàng. Khí hydro có thể được đốt cháy để tạo ra tiếng nổ nhỏ.
2Ra + 2HCl → 2RaCl2 + H2↑
- Radium phản ứng với nước:
Khi cho một viên Radium vào nước, sẽ có khí hydro thoát ra và nước có tính kiềm. Khí hydro có thể được đốt cháy để tạo ra tiếng nổ nhỏ.
Ra + 2H2O → Ra(OH)2 + H2↑
Vấn đề an toàn của nguyên tố Radi

Nguy cơ:
- Radium là nguyên tố phóng xạ mạnh, có thể gây hại cho sức khỏe con người nếu tiếp xúc trực tiếp hoặc gián tiếp.
- Tiếp xúc với radium có thể dẫn đến các vấn đề sức khỏe nghiêm trọng như ung thư, bệnh bạch cầu, thiếu máu, và hoại tử xương.
- Phụ nữ có thai và trẻ nhỏ đặc biệt nhạy cảm với những hậu quả gây hại của radium.
Biện pháp an toàn:
- Khi sử dụng radium:
- Cần được đào tạo bài bản và sử dụng các thiết bị bảo hộ cá nhân phù hợp.
- Hoạt động trong một khu vực có thiết kế và quản lý nghiêm ngặt.
- Tuân theo các quy định an toàn một cách nghiêm túc.
- Khi lưu trữ radium:
- Cần được bảo quản trong các thùng chứa chuyên dụng, có khả năng chống bức xạ.
- Lưu trữ ở khu vực an toàn, hạn chế sự tiếp xúc với con người.
- Thực hiện giám sát và kiểm tra thường xuyên nhằm bảo vệ sự an toàn
Quản lý và xử lý chất thải:
- Chất thải chứa radium cần được xử lý theo quy định của cơ quan quản lý an toàn hạt nhân.
- Các kỹ thuật xử lý thông dụng bao gồm
- Chôn lấp sâu dưới lòng đất
- Nung chảy và vit hóa
- Pha loãng và thải ra môi trường dưới mức cho phép
Dưới đây là bản tóm tắt các thông tin cơ bản về nguyên tố Radi mà chúng tôi đã thu thập. Mời bạn đọc tiếp và khám phá thêm thông tin về chủ đề này!
Chúng tôi mong rằng bạn đã có được một cái nhìn toàn diện và chi tiết về nguyên tố Radi qua bài viết này. Nếu có bất cứ thắc mắc nào hoặc bạn muốn tìm hiểu thêm, hãy thoải mái để lại lời bình luận ở phía dưới!







