Nguyên tố Platin: Kim loại quý bền vững với thời gian
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn sâu sắc về nguyên tố platinum từ định nghĩa, đến vị trí của nó trong bảng tuần hoàn hóa học.
Platin, hay bạch kim, là một trong những nguyên tố hóa học quý hiếm nhất và có giá trị nhất trên Trái Đất. Được biết đến với tính chất vật lý và hóa học đặc biệt, platinum không chỉ là biểu tượng của sự sang trọng và tinh tế trong ngành trang sức mà còn là một thành phần không thể thiếu trong nhiều ứng dụng công nghiệp và công nghệ cao. Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn sâu sắc về nguyên tố platinum từ định nghĩa, lịch sử hình thành, đến vị trí của nó trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Platin
Định nghĩa
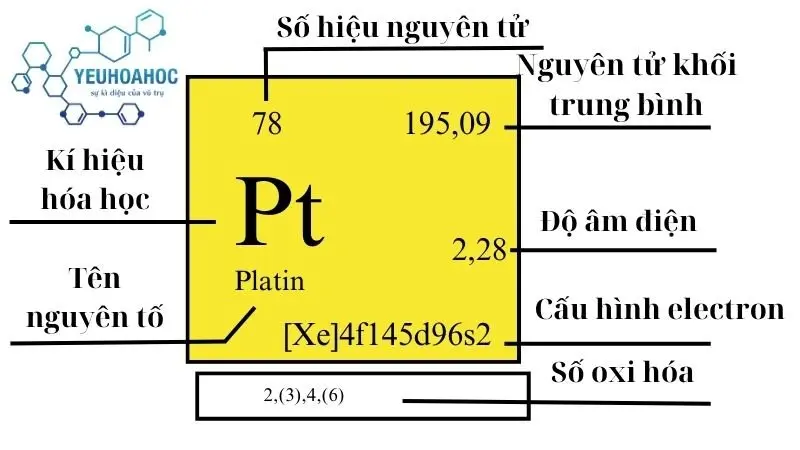
Platin, với tên tiếng Anh là “Platinum” và ký hiệu hóa học là “Pt”, là nguyên tố hóa học có số nguyên tử là 78. Nó thuộc nhóm kim loại chuyển tiếp và nằm trong chu kỳ 6 của bảng tuần hoàn. Được biết đến với độ cứng và khả năng chống ăn mòn cao, platinum cũng là một trong những kim loại quý hiếm có khả năng chịu nhiệt và dẫn điện tốt.
Lịch sử hình thành nguyên tố Platin
- Thời cổ đại: Người Ai Cập cổ đại đã biết đến Platin từ 7.000 năm trước. Họ sử dụng nó để làm đồ trang sức và tượng.
- Thế kỷ 16: Người Tây Ban Nha lần đầu tiên phát hiện Platin ở Nam Mỹ vào thế kỷ 16.
- Thế kỷ 18: Platin được sử dụng để làm tiền xu và đồ trang sức ở châu Âu.
Một vài thời điểm then chốt trong lịch sử khám phá:
- 1519: Người Tây Ban Nha lần đầu tiên phát hiện Platin ở Nam Mỹ.
- 1748: Antonio de Ulloa, một nhà thám hiểm người Tây Ban Nha, là người đầu tiên mô tả chi tiết về Platin.
- 1780: Carl Scheele, nhà hóa học Thụy Điển, được ghi nhận là người đầu tiên nhận biết Platin là một nguyên tố.
- 1803: William Henry Wollaston, nhà hóa học đến từ Anh, đã tạo ra một kỹ thuật để làm sạch Platin. Platin là một nguyên tố trong bảng tuần hoàn của hóa học
Nguyên tố Platin trong bảng tuần hoàn hóa học
- Platin nằm trong nhóm 10 (nhóm kim loại chuyển tiếp) của bảng tuần hoàn hóa học.
- Số nguyên tử: 78
- Khối lượng nguyên tử: 195,09 g/mol
- Cấu hình electron: [Xe] 4f14 5d9 6s1
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 10 | 6 | 195,084(9) | 21,46 | 2041,4 | 4098 | 0,133 | 2,28 | 0,005 |
Tính chất của nguyên tố Platin
Tính chất vật lý
- Điểm nóng chảy: 1768,4 °C
- Điểm sôi: 3827 °C
- Mật độ: 21,45 g/cm³
- Màu sắc: Trắng xám
- Cấu trúc tinh thể: Lập phương tâm mặt
- Độ cứng Mohs: 4,3
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
Tính chất hóa học
- Trạng thái oxy hóa: +2, +4
- Tính khử: Yếu
- Tính oxi hóa: Yếu
- Khả năng chống ăn mòn: Cao
- Phản ứng với axit: Không phản ứng với axit HCl loãng hoặc axit H2SO4 loãng. Phản ứng với axit aqua regia để tạo thành axit chloroplatinic (H2PtCl6).
- Phản ứng với kim loại khác: Có thể phản ứng với một số kim loại khác, ví dụ như natri, để tạo thành hợp kim.
- Phản ứng với halogen: Có thể phản ứng với halogen (như clo, brom) ở nhiệt độ cao để tạo thành muối halide.
Ứng dụng của nguyên tố Platin

Trang sức
- Platin được sử dụng để làm đồ trang sức vì nó có vẻ đẹp sang trọng và không bị gỉ sét.
- Platin cũng được sử dụng để làm nhẫn cưới và nhẫn đính hôn vì nó tượng trưng cho tình yêu vĩnh cửu.
Nha khoa
- Platin được sử dụng trong nha khoa để làm răng giả và mão răng vì nó có khả năng chống ăn mòn cao và tương thích sinh học tốt.
- Platin cũng được sử dụng để làm các chốt và mão răng vì nó có độ bền cao và có thể chịu được lực nhai lớn.
Thiết bị điện tử
- Platin được sử dụng trong các thiết bị điện tử vì nó có khả năng dẫn điện tốt và chịu được nhiệt độ cao.
- Platin được sử dụng để làm các tiếp điểm điện, điện cực và dây dẫn điện.
Bộ chuyển đổi xúc tác
- Platin được sử dụng trong các bộ chuyển đổi xúc tác để giảm thiểu khí thải từ ô tô.
- Platin giúp oxy hóa các chất ô nhiễm trong khí thải thành các chất vô hại.
Ngành công nghiệp hóa chất
- Platin được sử dụng làm xúc tác trong một số phản ứng hóa học vì nó có hoạt động xúc tác tốt và chịu được nhiệt độ cao.
- Platin cũng được sử dụng để làm lớp phủ cho các thiết bị trong ngành công nghiệp hóa chất để bảo vệ chúng khỏi bị ăn mòn.
Ngành công nghiệp y tế
- Platin được sử dụng trong một số thiết bị y tế, chẳng hạn như máy tạo nhịp tim và cấy ghép, vì nó có khả năng chống ăn mòn cao và tương thích sinh học tốt.
- Platin cũng được sử dụng trong các dụng cụ phẫu thuật vì nó có độ cứng cao và chịu được nhiệt độ cao.
Điều chế và sản xuất nguyên tố Platin
Điều chế
Trong phòng thí nghiệm:
Phương pháp khử:
Khử amoni hexachloroplatinat(IV) (NH4)2PtCl6 bằng hydro:
(NH4)2PtCl6 + 6H2 -> Pt + 2NH4Cl + 4HCl
Khử platin(IV) oxide (PtO2) bằng hydro:
PtO2 + 2H2 -> Pt + 2H2O
Phương pháp điện phân:
Điện phân dung dịch amoni hexachloroplatinat(IV) (NH4)2PtCl6 để tạo ra platin kim loại:
(NH4)2PtCl6 + 6H2O -> Pt + 2NH4Cl + 6HCl + O2
Trong công nghiệp:
- Platin được chiết xuất từ quặng niken và đồng. Quặng được nghiền mịn và sau đó được xử lý bằng axit để hòa tan kim loại. Platin sau đó được kết tủa từ dung dịch axit bằng cách sử dụng một chất khử.
- Platin cũng có thể được chiết xuất từ quặng platin. Quặng được nung chảy và sau đó được xử lý bằng axit để hòa tan kim loại. Platin sau đó được kết tủa từ dung dịch axit bằng cách sử dụng một chất khử.
Sản xuất
Platin được sản xuất bằng cách nung nóng bột platin trong lò nung ở nhiệt độ cao. Bột platin được tạo ra bằng cách nghiền mịn platin kim loại.
Phản ứng của nguyên tố Platin (Pt)
Phản ứng với axit
- Platin không phản ứng với axit hydrochloric (HCl) hoặc axit nitric (HNO3) loãng.
- Tuy nhiên, Platin có thể phản ứng với axit aqua regia (hỗn hợp axit HCl và HNO3 đậm đặc) để tạo thành platin chloride (PtCl4):
Pt + 4HCl + 4HNO3 → PtCl4 + 4H2O + 4NO2
Phản ứng với oxy
- Platin không bị oxy hóa trong không khí ở bất kỳ nhiệt độ nào.
- Platin chỉ phản ứng với oxy ở nhiệt độ cao trên 800°C để tạo thành platin dioxide (PtO2):
Pt + O2 → PtO2
Phản ứng với kim loại khác
- Platin có thể hợp kim với các kim loại khác, chẳng hạn như vàng, bạc và palladium.
- Hợp kim platin-iridi được sử dụng trong các thiết bị y tế và điện cực.
Phản ứng với halogen
- Platin có thể phản ứng với halogen, chẳng hạn như clo và brom, ở nhiệt độ cao để tạo thành muối halide:
Pt + 2Cl2 → PtCl2
Ví dụ cụ thể:
- Khi cho bột platin vào dung dịch axit aqua regia, dung dịch sẽ chuyển sang màu vàng cam do hình thành platin chloride.
- Khi nung nóng platin trong không khí ở nhiệt độ cao trên 800°C, platin sẽ bị oxy hóa và tạo thành một lớp oxit platin màu đen trên bề mặt.
Vấn đề an toàn của nguyên tố Platin (Pt)
Kích ứng da
- Platin có thể gây kích ứng da ở một số người.
- Các triệu chứng kích ứng da do Platin bao gồm ngứa, đỏ da và phát ban.
Kích ứng mắt
- Platin cũng có thể gây kích ứng mắt.
- Các triệu chứng kích ứng mắt do Platin bao gồm chảy nước mắt, đỏ mắt và ngứa mắt.
Dị ứng
- Một số người có thể bị dị ứng với Platin.
- Các triệu chứng dị ứng Platin bao gồm sưng mặt, khó thở và phát ban.
Nguy cơ ngộ độc
- Platin có thể gây ngộ độc nếu nuốt phải.
- Các triệu chứng ngộ độc Platin bao gồm buồn nôn, nôn mửa và tiêu chảy.
Biện pháp an toàn:
- Khi sử dụng Platin, cần phải đeo găng tay và kính bảo hộ để tránh tiếp xúc trực tiếp với da và mắt.
- Nên rửa tay kỹ lưỡng sau khi sử dụng Platin.
- Nếu bạn bị dị ứng với kim loại, hãy tránh tiếp xúc với Platin.
- Nếu bạn nuốt phải Platin, hãy đi khám bác sĩ ngay lập tức.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Platin mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Platin. Nếu có thắc mắc hay muốn biết thêm thông tin, xin đừng ngần ngại viết bình luận ở phần dưới!







