Nguyên tố Paladi: Kim loại quý đa dụng trong bảng tuần hoàn
Bài viết này yeuhoahoc.edu.vn sẽ đưa ra cái nhìn tổng quan về nguyên tố Paladi, từ định nghĩa, lịch sử đến vị trí của nó trong bảng tuần hoàn.
Trong bảng tuần hoàn hóa học, Paladi (Pd) chiếm một vị trí đặc biệt với vai trò và ứng dụng không thể phủ nhận trong ngành công nghiệp và công nghệ hiện đại. Với kí hiệu Pd và số nguyên tử 46, Paladi không chỉ là một trong những kim loại quý hiếm mà còn nổi tiếng với khả năng xúc tác vượt trội. Bài viết này yeuhoahoc.edu.vn sẽ đưa ra cái nhìn tổng quan về Paladi, từ định nghĩa, lịch sử hình thành đến vị trí của nó trong bảng tuần hoàn và những ứng dụng chính của kim loại quý này.
Giới thiệu về nguyên tố Paladi
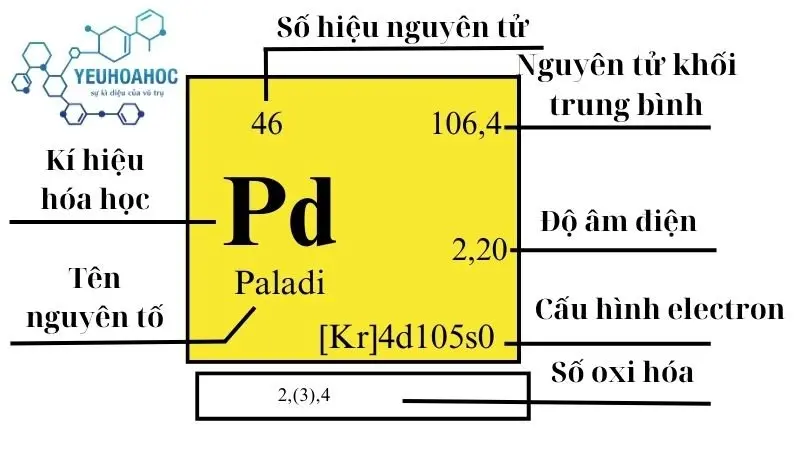
Định nghĩa
Paladi, với tên tiếng Anh là “Palladium”, là một nguyên tố hóa học có kí hiệu là Pd. Đây là một kim loại quý hiếm, thuộc nhóm kim loại chuyển tiếp, được biết đến với màu trắng bạc, độ cứng và độ bền cao, cũng như khả năng chống ăn mòn tốt.
Lịch sử hình thành nguyên tố Paladi
1803: William Hyde Wollaston, một hóa học gia người Anh, được công nhận là người đầu tiên phát hiện ra Paladium trong khi nghiên cứu quặng platinum. Wollaston đã giới thiệu Paladium đến cộng đồng khoa học mà không tiết lộ phương pháp tách nó, điều này tạo nên một bí ẩn lớn cho đến khi ông công bố phương pháp vào năm 1805.
Mốc thời gian quan trọng:
- 1803: William Hyde Wollaston, nhà hóa học người Anh, phát hiện ra Paladi trong quặng platin.
- 1804: Wollaston đặt tên cho nguyên tố này là Paladi, theo tên của Pallas, một tiểu hành tinh được đặt tên theo tên gọi tượng trưng của nữ thần Athena.
- Thế kỷ 19: Paladi bắt đầu được sử dụng trong trang sức và nha khoa.
- Thế kỷ 20: Paladi được sử dụng rộng rãi hơn trong các ứng dụng công nghiệp và y tế.
Nguyên tố Paladi trong bảng tuần hoàn hóa học

- Vị trí: Nhóm 10, chu kỳ 5
- Cấu hình electron: [Kr] 4d¹⁰
- Khối lượng nguyên tử: 106,42 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 10 | 5 | 106,42(1) | 12,02 | 1828,05 | 3236 | 0,244 | 2,2 | 0,015 |
Tính chất của nguyên tố Paladi
Tính chất vật lý
- Là kim loại màu trắng bạc, mềm, dẻo.
- Có nhiệt độ nóng chảy cao (1552 °C) và nhiệt độ sôi cao (2940 °C).
- Có mật độ cao (12,02 g/cm³).
- Chống ăn mòn tốt.
- Là một nguyên tố chất dẫn điện và dẫn nhiệt tốt.
Tính chất hóa học
- Có nhiều trạng thái oxy hóa (+2, +3, +4, +6).
- Là chất khử mạnh.
- Tạo ra các hợp chất với nhiều nguyên tố khác nhau, như oxy, clo, hydro, cacbon.
- Là chất xúc tác hiệu quả trong nhiều phản ứng hóa học.
Một số tính chất cụ thể:
- Paladi không tan trong axit nitric loãng và axit sunfuric loãng.
- Paladi tan trong axit aqua regia (hỗn hợp axit nitric và axit hydrochloric).
- Paladi bị oxy hóa bởi flo ở nhiệt độ cao.
- Paladi tạo thành hợp kim với nhiều kim loại khác nhau, như platin, iridi, rutheni.
Ứng dụng của nguyên tố Paladi

Do có nhiều tính chất ưu việt như:
- Khả năng chống ăn mòn cao
- Độ cứng và độ bền tốt
- Khả năng dẫn điện tốt
- Là chất xúc tác hiệu quả
Paladi được sử dụng trong nhiều lĩnh vực khác nhau, bao gồm:
Bộ chuyển đổi xúc tác
- Paladi là ứng dụng quan trọng nhất của Paladi.
- Paladi được sử dụng trong bộ chuyển đổi xúc tác cho ô tô để giảm thiểu khí thải độc hại.
- Bộ chuyển đổi xúc tác sử dụng Paladi để biến đổi khí độc hại như carbon monoxide và nitrogen oxide thành khí thải vô hại như carbon dioxide và nitrogen.
Nha khoa
- Paladi được sử dụng trong nha khoa để làm mão răng, cầu răng và trám răng.
- Paladi được sử dụng vì nó có khả năng chống ăn mòn cao, độ bền tốt và tương thích sinh học tốt.
Điện tử
- Paladi được sử dụng trong các linh kiện điện tử, như tụ điện và điện trở.
- Paladi được sử dụng vì nó có khả năng dẫn điện tốt và chống ăn mòn cao.
Trang sức
- Paladi được sử dụng trong trang sức do có vẻ ngoài sáng bóng và sang trọng.
- Paladi thường được sử dụng để làm nhẫn, vòng cổ và hoa tai.
Hóa chất
- Paladi được sử dụng làm chất xúc tác trong nhiều phản ứng hóa học.
- Paladi được sử dụng vì nó là chất xúc tác hiệu quả và có thể hoạt động trong điều kiện ôn hòa.
Một số ứng dụng khác
- Paladi được sử dụng trong các dụng cụ y tế, như máy tạo nhịp tim và cấy ghép.
- Paladi được sử dụng trong các thiết bị lọc nước.
- Paladi được sử dụng trong các hợp kim chịu nhiệt.
Điều chế và sản xuất nguyên tố Paladi
Điều chế
Trong phòng thí nghiệm
Từ quặng platin:
- Quặng platin được nghiền mịn và nung nóng với axit regia.
- Paladi được tách ra từ dung dịch sau đó bằng phương pháp điện phân.
Từ hợp chất Paladi:
- Paladi có thể được điều chế từ các hợp chất của nó bằng phương pháp khử.
- Ví dụ, Paladi có thể được điều chế từ muối Paladi(II) chloride (PdCl2) bằng cách khử với hydro:
PdCl2 + H2 → Pd + 2HCl
Trong công nghiệp
Paladi được sản xuất như một sản phẩm phụ của quá trình khai thác và tinh chế niken, đồng và platin.
Quá trình sản xuất Paladi bao gồm:
-
- Luyện quặng để chiết xuất kim loại thô.
- Tinh chế kim loại thô bằng phương pháp điện phân.
- Kết tủa Paladi từ dung dịch điện phân.
Phương trình điều chế:
Từ quặng platin
4Pt + 15HCl + 3HNO3 → 4H2PtCl6 + 3NO2 + 12H2O
H2PtCl6 + 6NH4OH → (NH4)2PtCl6 + 2HCl + 2H2O
(NH4)2PtCl6 + 2NaHSO3 → PtS2 + 2NH4Cl + 2H2SO4
PtS2 + 6HNO3 → PtO2 + 2H2SO4 + 2S
Từ muối Paladi(II) chloride
PdCl2 + H2 → Pd + 2HCl
Sản xuất
- Paladi được sản xuất chủ yếu ở Nga, Canada và Nam Phi.
- Nhu cầu Paladi đang tăng lên do
- Được ứng dụng một cách phổ biến trong các lĩnh vực công nghiệp và y tế.
- Tính chất ưu việt của Paladi như khả năng chống ăn mòn cao, độ cứng và độ bền tốt.
Phản ứng của nguyên tố Paladi (Pd)
Phản ứng với oxi
- Khi nung nóng trong không khí, Paladi có thể phản ứng với oxi để tạo thành oxit paladi(II) (PdO):
2Pd + O2 → 2PdO
Phản ứng với axit
- Paladi tan trong axit nitric loãng và axit sunfuric đặc nóng:
Pd + 6HNO3 → Pd(NO3)2 + 3NO2 + 3H2O
Pd + 3H2SO4 → PdSO4 + 3SO2 + 3H2O
Phản ứng với dung dịch kiềm
- Paladi không phản ứng với dung dịch kiềm.
Phản ứng với halogen
- Paladi phản ứng với halogen (như Cl2, Br2) khi nung nóng để tạo thành muối halogenua:
Pd + 2Cl2 → PdCl2
Phản ứng với hydro
- Paladi không phản ứng với hydro ở nhiệt độ thường.
Ví dụ cụ thể:
Sử dụng Paladi làm chất xúc tác: Paladi được sử dụng rộng rãi làm chất xúc tác trong nhiều phản ứng hóa học, như:
Phản ứng khử hydro hóa:
C2H4 + H2 → C2H6 (Pd/C)
Phản ứng cộng hợp:
CH2=CH2 + HCl → CH3CH2Cl (PdCl2)
Vấn đề an toàn khi sử dụng nguyên tố Paladi (Pd)
Hợp chất phóng xạ
Một số đồng vị của Paladium có thể phóng xạ, dù không phổ biến trong ứng dụng hàng ngày. Cần thận trọng khi xử lý các hợp chất hoặc đồng vị phóng xạ của Paladium, đặc biệt trong môi trường nghiên cứu hoặc y tế.
Tiếp xúc hóa chất
Các hợp chất của Paladium, như chloride và nitrate, có thể gây độc nếu tiếp xúc qua da, hít phải, hoặc nuốt phải. Cần tránh tiếp xúc trực tiếp và sử dụng thiết bị bảo hộ cá nhân thích hợp.
Bụi kim loại
Khi mài, cắt, hoặc thao tác với Paladium, có thể tạo ra bụi hoặc hạt mịn. Bụi kim loại có thể gây kích ứng đường hô hấp hoặc da, do đó cần đảm bảo thông gió tốt và sử dụng mặt nạ phòng độc khi làm việc.
Rủi ro hỏa hoạn và nổ
Một số hợp chất của Paladium có thể phản ứng mạnh với chất oxi hóa hoặc khi tiếp xúc với không khí ẩm, tạo ra nguy cơ hỏa hoạn hoặc nổ. Cần lưu trữ và xử lý các hợp chất này một cách cẩn thận trong điều kiện an toàn.
Chất thải hóa học
Việc xử lý và loại bỏ chất thải hóa học chứa Paladium cần tuân thủ nghiêm ngặt các quy định về môi trường để tránh ô nhiễm.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Paladi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Paldi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







