Nguyên tố Nitơ: Khái niệm, tính chất điều chế và ứng dụng
Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Nitơ, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan.
Nguyên tố Nitơ (N) là một trong những nguyên tố quan trọng và phổ biến nhất trên Trái Đất. Với tính chất đặc biệt và ứng dụng đa dạng, nitơ đóng vai trò không thể phủ nhận trong nhiều lĩnh vực khác nhau. Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Nitơ, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Nitơ
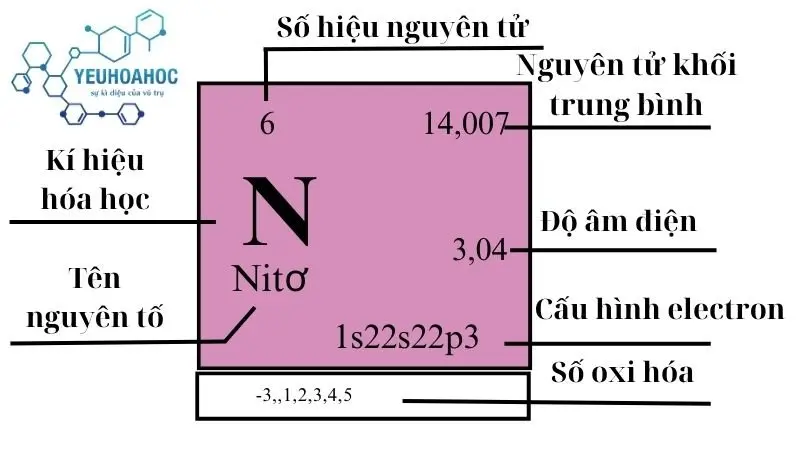
Định nghĩa
- Nitơ (tên tiếng Anh là Nitrogen) là nguyên tố hóa học thứ 7 trong bảng tuần hoàn, ký hiệu N, số hiệu nguyên tử 7.
- Nitơ là một nguyên tố phi kim, không màu, không mùi, không vị và hóa lỏng ở -196°C.
- Nitơ là nguyên tố phổ biến thứ 7 trong vũ trụ và thứ 2 trong bầu khí quyển Trái Đất (chiếm 78%).
Lịch sử
- Daniel Rutherford đã khám phá Nitơ vào năm 1772.
- Carl Wilhelm Scheele và Henry Cavendish cũng phát hiện ra nitơ độc lập vào cùng năm.
- Antoine Lavoisier đặt tên cho nguyên tố này là “nitrogene” (từ tiếng Hy Lạp “nitron” nghĩa là “niter” và “genes” nghĩa là “sinh ra”) vào năm 1790.
Các mốc quan trọng trong việc hình thành nguyên tố Nitơ:
- Nitơ được hình thành trong quá trình hạt nhân hóa (nucleosynthesis) trong các ngôi sao.
- Sau khi các ngôi sao chết, nitơ được giải phóng vào vũ trụ.
- Nitơ trên Trái Đất được hình thành từ phản ứng sét giữa nitơ và oxy trong khí quyển.
- Nitơ cũng được hình thành bởi vi sinh vật trong quá trình cố định nitơ.
Tầm quan trọng
- Nitơ là thành phần quan trọng của protein, axit nucleic và các hợp chất hữu cơ khác.
- Nitơ đóng vai trò quan trọng trong sự sống.
- Nitơ có ứng dụng rộng rãi trong nhiều lĩnh vực, bao gồm:
- Nông nghiệp: Phân bón nitơ được sử dụng để giúp cây phát triển.
- Công nghiệp: Nitơ được sử dụng để sản xuất thép, amoniac, axit nitric và các hóa chất khác
- Y học: Nitơ lỏng được sử dụng để bảo quản máu, mô và các tế bào.
Nguyên tố nitơ trong bảng tuần hoàn hóa học
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 15 | 2 | 14,0072 4 9 | 0,0012506 | 63,15 | 77,36 | 1,04 | 3,04 | 19 |
Tính chất của Nitơ
Tính chất vật lý của Nitơ
- Nitơ là khí không màu, không mùi và không độc hại ở điều kiện thông thường.
- Nó là một trong những thành phần chính của khí không khí, chiếm khoảng 78%.
- Nitơ có mật độ cao hơn không khí và ít tan trong nước.
- Nitơ hóa lỏng ở -196°C và hóa rắn ở -210°C.
Tính chất hóa học của Nitơ
- Nitơ có thể tạo ra các liên kết hóa học đa dạng, bao gồm liên kết đôi và liên kết ba.
- Nó có độ âm điện cao và có thể tham gia vào nhiều phản ứng hóa học quan trọng.
- Nitơ có thể phản ứng với kim loại, phi kim và các hợp chất khác.
Dưới đây là một số ví dụ về tính chất hóa học của nitơ:
- Quá trình nitration: Nitơ có thể phản ứng với axit nitric để tạo thành các hợp chất nitro, được sử dụng trong sản xuất thuốc nổ và thuốc nhuộm.
- Phản ứng tổng hợp amino axit: Nitơ có thể phản ứng với amoniac và carbon dioxide để tạo thành amino axit, là thành phần cơ bản của protein.
- Phản ứng liên kết nitơ: Nitơ có thể liên kết với các nguyên tố khác để tạo thành các hợp chất hữu cơ, chẳng hạn như amoniac, nitrat và nitrit.
Ứng dụng của nguyên tố Nitơ
Trong ngành công nghiệp hóa chất
- Nitơ được sử dụng để sản xuất axit nitric, một nguyên liệu quan trọng trong sản xuất phân bón, thuốc nổ và hóa chất khác.
- Nitơ được sử dụng làm chất phân tán trong các sản phẩm như sơn, mực in và keo.
- Nitơ được sử dụng làm chất xúc tác trong các phản ứng hóa học.
Trong y học
- Nitơ lỏng được sử dụng để làm lạnh trong các quá trình hồi phục từ thương tổn và trong phẫu thuật lạnh.
- Nitơ được sử dụng để bảo quản máu, mô và tế bào.
Trong nông nghiệp
- Nitơ là thành phần chính của phân bón và đóng vai trò quan trọng trong việc tăng cường sự phát triển của cây trồng.
- Nitơ được sử dụng để bảo quản ngũ cốc và các sản phẩm nông nghiệp khác.
Trong các lĩnh vực khác
- Nitơ được sử dụng để làm đầy lốp xe và bóng bay.
- Nitơ được sử dụng để dập tắt cháy do nó không hỗ trợ sự cháy.
- Nitơ được sử dụng để làm sạch các thiết bị và dụng cụ.
Điều chế và sản xuất Nitơ
Điều chế
Phương pháp chưng cất phân đoạn không khí
Đây là phương pháp phổ biến nhất để sản xuất nitơ. Không khí được hóa lỏng và sau đó được phân tách thành các thành phần khác nhau dựa trên điểm sôi của chúng. Nitơ có điểm sôi thấp hơn oxy nên nó được thu được đầu tiên.
Phương pháp hấp thụ
Phương pháp này sử dụng các vật liệu hấp thụ có khả năng hấp thụ oxy tốt hơn nitơ. Không khí được cho qua các vật liệu hấp thụ và nitơ được thu được ở dạng tinh khiết.
Phương pháp màng
Phương pháp này sử dụng các màng lọc có khả năng cho phép nitơ đi qua nhưng giữ lại oxy. Không khí được cho qua các màng lọc và nitơ được thu được ở dạng tinh khiết.
Phương pháp trao đổi ion
Phương pháp này sử dụng các hạt trao đổi ion có khả năng trao đổi ion oxy với ion nitrat. Nước được cho qua các hạt trao đổi ion và nitơ được thu được ở dạng tinh khiết.
Sản xuất Nitơ
Nito được sản xuất trên quy mô lớn để đáp ứng nhu cầu của nhiều ngành công nghiệp khác nhau. Các nhà máy sản xuất nito thường sử dụng phương pháp chưng cất phân đoạn không khí để sản xuất nito.
Phản ứng của nguyên tố Nitơ

- Phản ứng hóa hợp:
- N2 + O2 -> 2NO (điều kiện: tia lửa điện)
- N2 + 3H2 -> 2NH3 (điều kiện: xúc tác, nhiệt độ)
- Phản ứng phân hủy:
- 2NH3 -> N2 + 3H2 (điều kiện: nhiệt độ)
- 2NaNO3 -> 2NaNO2 + O2 (điều kiện: nhiệt độ)
- Phản ứng thế:
- Mg + N2 -> Mg3N2 (điều kiện: nhiệt độ)
- Cu + 2HNO3 -> Cu(NO3)2 + H2 (điều kiện: loãng)
- Phản ứng cháy:
- 4P + 5O2 -> 2P2O5 (điều kiện: đốt cháy)
- S + N2 -> S2N2 (điều kiện: đốt cháy)
Tồn tại và khai thác Nitơ
Tồn tại
- Nitơ tồn tại dưới dạng khí tự do trong khí quyển, chiếm khoảng 78%.
- Nitơ cũng tồn tại dưới dạng hợp chất, chẳng hạn như:
- Muối nitrat: KNO3 (kali nitrat), NaNO3 (natri nitrat)
- Muối nitrit: NaNO2 (natri nitrit), KNO2 (kali nitrit)
- Hợp chất hữu cơ: Protein, axit nucleic, amoniac (NH3)
Khai thác
- Nitơ được khai thác từ không khí thông qua quá trình hóa lỏng. Quá trình này bao gồm:
- Nén khí quyển
- Làm lạnh khí quyển
- Ngưng tụ và hóa lỏng khí quyển
- Phân tách nitơ lỏng khỏi các khí khác (oxy, argon, carbon dioxide)
- Nitơ cũng được khai thác từ các mỏ muối nitrat, chẳng hạn như:
- Mỏ NaNO3 ở Chile
- Mỏ KNO3 ở Ấn Độ
Chất Lượng và phương thức cung cấp Nitơ
Chất lượng nitơ
- Nitơ được cung cấp ở nhiều độ tinh khiết khác nhau, tùy thuộc vào nhu cầu sử dụng.
- Độ tinh khiết của nitơ được biểu thị bằng tỷ lệ phần trăm nitơ trong khí.
- Nitơ có độ tinh khiết cao (99,999%) được sử dụng trong các ngành công nghiệp như điện tử và y tế.
- Nitơ có độ tinh khiết thấp hơn (99,5%) được sử dụng trong các ngành công nghiệp như nông nghiệp và hóa chất.
Phương thức cung cấp nitơ
- Nitơ có thể được cung cấp dưới dạng khí lỏng hoặc khí nén.
- Nitơ lỏng được cung cấp trong các bình chứa đặc biệt.
- Nitơ khí nén được cung cấp trong các bình thép hoặc bằng đường ống.
Vấn đề an toàn khi sử dụng nguyên tố Nitơ
Bỏng lạnh

Nitơ lỏng có nhiệt độ rất thấp (-196°C) và có thể gây bỏng lạnh nếu tiếp xúc trực tiếp với da. Khi tiếp xúc với nitơ lỏng, da có thể bị đỏ, sưng, phồng rộp và thậm chí hoại tử. Do đó, cần sử dụng các biện pháp bảo hộ như găng tay, kính bảo hộ và quần áo dài tay khi tiếp xúc với nitơ lỏng.
Ngạt thở
Nitơ là khí không màu, không mùi và không vị, do đó, con người khó có thể nhận biết khi nồng độ nitơ trong không khí tăng cao. Khi nồng độ nitơ trong không khí cao hơn 21%, con người có thể bị ngạt thở. Do đó, cần đảm bảo thông gió tốt khi sử dụng nitơ trong không gian kín.
Áp suất cao
Nitơ lỏng được bảo quản trong các bình chứa áp suất cao. Nếu bình chứa bị hỏng hoặc rò rỉ, có thể gây nguy hiểm cho người sử dụng. Do đó, cần tuân thủ các quy trình an toàn khi sử dụng và bảo quản bình chứa nitơ lỏng.
Cháy nổ
Nitơ không hỗ trợ sự cháy, nhưng có thể làm tăng nguy cơ cháy nổ trong một số trường hợp. Ví dụ, nếu nitơ được sử dụng để dập tắt đám cháy, nó có thể đẩy oxy ra khỏi khu vực đám cháy và khiến đám cháy bùng phát trở lại. Do đó, cần cẩn thận khi sử dụng nitơ trong môi trường có nguy cơ cháy nổ.
Các vấn đề sức khỏe khác
Ngoài các vấn đề an toàn nêu trên, nitơ cũng có thể gây ra một số vấn đề sức khỏe khác như:
- Đau đầu: Hít phải lượng nitơ quá nhiều có thể gây đau đầu.
- Buồn nôn: Hít phải lượng nitơ quá nhiều có thể gây buồn nôn và nôn mửa.
- Chóng mặt: Hít phải lượng nitơ quá nhiều có thể gây chóng mặt và mất thăng bằng.
Trên đây là tất cả những kiến thức cơ bản về nguyên tố Nitơ mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Nitơ. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







