Nguyên tố Mangan: Tính chất, ứng dụng và tầm quan trọng
Bài viết này yeuhoahoc.edu.vn sẽ cùng các bạn khám phá lịch sử, tầm quan trọng và những ứng dụng chính của nguyên tố mangan
Mangan là một thành phần không thể thiếu trong nhiều quy trình sản xuất và quá trình sinh học. Bài viết này yeuhoahoc.edu.vn sẽ cùng các bạn khám phá lịch sử, tầm quan trọng và những ứng dụng chính của nguyên tố hóa học này, cung cấp cái nhìn sâu sắc về vị trí và vai trò của Mangan trong bảng tuần hoàn các nguyên tố.
Giới thiệu về nguyên tố Mangan
Định Nghĩa Nguyên Tố Mangan
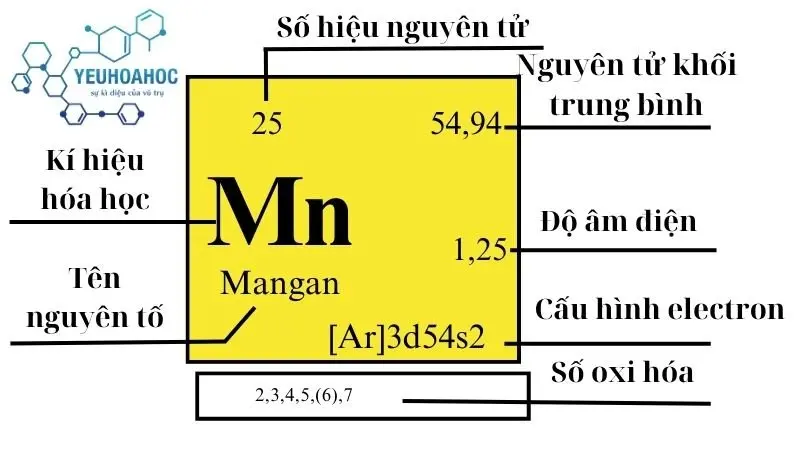
Mangan là một nguyên tố hóa học tên gọi tiếng anh là Manganese có ký hiệu là Mn và số nguyên tử là 25 trong bảng tuần hoàn. Đây là một kim loại chuyển tiếp màu trắng bạc, cứng nhưng dễ vỡ. Mangan được biết đến với vai trò quan trọng trong việc sản xuất thép và các ứng dụng công nghiệp khác nhờ vào tính chất hóa học độc đáo của nó.
Lịch sử hình thành nguyên tố Mangan
- Thời cổ đại: Mangan đã được sử dụng từ thời cổ đại, chủ yếu trong sản xuất đồ gốm và thủy tinh.
- Thế kỷ 18:
- 1774: Carl Wilhelm Scheele lần đầu tiên phân lập mangan dioxide (MnO2) từ pyrolusite.
- 1778: Johan Gottlieb Gahn lần đầu tiên khử mangan dioxide thành kim loại mangan.
Tầm quan trọng của nguyên tố Mangan trong đời sống:
Mangan là một nguyên tố quan trọng trong đời sống với nhiều ứng dụng:
- Hợp kim: Mangan là thành phần quan trọng trong thép, giúp tăng cường độ, độ cứng và khả năng chống ăn mòn.
- Pin: Mangan dioxide được sử dụng làm cathode trong pin alkaline.
- Hóa chất: Mangan được sử dụng trong sản xuất hóa chất, như thuốc nhuộm, phân bón và thuốc trừ sâu.
- Y tế: Mangan là một vi chất dinh dưỡng thiết yếu cho cơ thể, cần thiết cho chức năng của hệ thần kinh, hệ xương và hệ miễn dịch.
Nguyên tố Mangan trong bảng tuần hoàn hóa học
- Nhóm: 7
- Chu kỳ: 4
- Khối lượng nguyên tử: 54,938045 g/mol
- Cấu hình electron: [Ar] 3d5 4s2
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 7 | 4 | 54,938045(5) | 7,44 | 1519 | 2334 | 0,479 | 1,55 | 950 |
Tính chất của nguyên tố Mangan
Tính chất vật lý
- Trạng thái: rắn
- Màu sắc: trắng xám
- Khối lượng riêng: 7,44 g/cm³
- Nhiệt độ nóng chảy: 1244 °C
- Nhiệt độ sôi: 2066 °C
- Cấu trúc tinh thể: lập phương tâm khối
- Tính chất cơ học: cứng, giòn
- Tính dẫn điện: dẫn điện tốt
- Tính dẫn nhiệt: dẫn nhiệt tốt
Tính chất hóa học
- Trạng thái oxy hóa: +2, +3, +4, +6, +7
- Tính khử: Mn có thể khử trong môi trường axit.
- Tính oxi hóa: Mn có thể oxi hóa một số kim loại khác, như Fe và Zn.
- Tính tạo phức: Mn có thể tạo phức với nhiều phối tử khác nhau, như H2O, NH3 và EDTA.
- Phản ứng với axit: Mn tan trong axit nitric loãng và axit sunfuric đặc.
- Phản ứng với bazơ: Mn không tác dụng với bazơ.
- Phản ứng với phi kim: Mn tác dụng với oxy, clo và nitơ ở nhiệt độ cao.
MnO₄²⁻), và +7 (trong pe manganat, MnO₄⁻) cũng khá quan trọng trong hóa học và công nghiệp.
Ứng dụng của nguyên tố Mangan

Hợp kim
Mangan là thành phần quan trọng trong thép, giúp tăng cường độ, độ cứng và khả năng chống ăn mòn.
Mangan cũng được sử dụng trong sản xuất hợp kim khác, như đồng thau, nhôm và niken.
Pin
Mangan dioxide (MnO2) được sử dụng làm cathode trong pin alkaline.
Pin alkaline là loại pin phổ biến được sử dụng trong nhiều thiết bị điện tử, như đồng hồ, máy tính và đèn pin.
Hóa chất
Mangan được sử dụng trong sản xuất hóa chất, như thuốc nhuộm, phân bón và thuốc trừ sâu.
Mangan dioxide cũng được sử dụng trong sản xuất kính và gốm sứ
Y tế
Mangan là một vi chất dinh dưỡng thiết yếu cho cơ thể, cần thiết cho chức năng của hệ thần kinh, hệ xương và hệ miễn dịch.
Thiếu mangan có thể dẫn đến các vấn đề sức khỏe, như loãng xương, mệt mỏi và rối loạn chức năng thần kinh.
Các ứng dụng khác:
- Mangan được sử dụng trong sản xuất gạch, xi măng và vật liệu xây dựng khác.
- Mangan cũng được sử dụng trong sản xuất các sản phẩm gia dụng, như dao kéo và dụng cụ nấu ăn.
Điều chế và sản xuất nguyên tố Mangan
Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp khử nhiệt nhôm:
- Cho hỗn hợp bột nhôm và oxit mangan (MnO2) vào ống nghiệm.
- Nung nóng hỗn hợp bằng đèn cồn cho đến khi phản ứng xảy ra.
- Phản ứng xảy ra mãnh liệt, toả nhiệt cao, thu được kim loại mangan và nhôm oxit.
- Phương trình phản ứng:
3MnO2 + 4Al → 3Mn + 2Al2O3
Điều chế trong công nghiệp:
Phương pháp điện phân:
-
- Cho dung dịch mangan sulfat (MnSO4) vào bể điện phân.
- Dùng điện cực than chì làm catôt và anôt.
- Dòng điện đi qua dung dịch, Mn2+ bị khử thành kim loại mangan tại catôt.
- Phương trình phản ứng:
Mn2+ + 2e- → Mn
Sản xuất
Quặng mangan:
-
- Quặng mangan là nguồn nguyên liệu chính để sản xuất mangan.
- Các loại quặng mangan phổ biến bao gồm pyrolusite (MnO2), manganite (MnOOH) và hausmannite (Mn3O4).
- Quặng mangan được khai thác từ các mỏ trên khắp thế giới.
Quy trình sản xuất:
-
- Quặng mangan được nghiền nhỏ và sau đó được nung trong lò nung để khử oxy.
- Mangan được thu được dưới dạng kim loại hoặc hợp kim.
Phản ứng của nguyên tố Mangan

Mangan là một nguyên tố hóa học có nhiều tính chất hóa học đặc biệt. Dưới đây là một số ví dụ về phản ứng của nguyên tố Mangan:
Phản ứng với axit
Mangan tác dụng với axit loãng để giải phóng khí hydro.
Ví dụ:
-
- Mn + 2HCl → MnCl2 + H2
- Mn + H2SO4 → MnSO4 + H2
Phản ứng với oxy
Mangan tác dụng với oxy ở nhiệt độ cao để tạo thành oxit mangan.
Ví dụ:
-
- Mn + O2 → MnO2
Phản ứng với clo
Mangan tác dụng với clo ở nhiệt độ cao để tạo thành clorua mangan.
Ví dụ:
-
- Mn + Cl2 → MnCl2
Phản ứng khử – oxy hóa
Mangan có thể tham gia vào các phản ứng khử – oxy hóa với nhiều chất khác nhau.
Ví dụ:
-
- Mn2+ + 2e- → Mn (khử)
- Mn4+ + 2e- → Mn2+ (oxy hóa)
Tính chất lưỡng tính
Mangan(IV) oxit (MnO₂) là một oxit lưỡng tính, có thể phản ứng với cả axit và bazơ. Khi tác dụng với axit, nó tạo ra muối mangan(II), và khi tác dụng với bazơ, nó tạo ra manganit MnO2+2NaOH+H2O→Na2MnO3+2H2O
Ngoài ra, Mangan còn có thể tham gia vào nhiều phản ứng hóa học khác.
Lưu ý:
- Tính chất hóa học của Mangan phụ thuộc vào nhiều yếu tố, như trạng thái oxy hóa, môi trường phản ứng và chất tham gia phản ứng.
- Cần cân nhắc các yếu tố này khi dự đoán và thực hiện các phản ứng hóa học của Mangan.
Tồn tại và khai thác nguyên tố Mangan
Tồn tại
- Mangan là nguyên tố phổ biến thứ 12 trong vỏ Trái đất, chiếm khoảng 0,1%.
- Mangan tồn tại trong tự nhiên dưới dạng quặng mangan, như pyrolusite (MnO2), manganite (MnOOH) và hausmannite (Mn3O4).
- Quặng mangan được tìm thấy ở nhiều nơi trên thế giới, bao gồm Nam Phi, Úc, Trung Quốc, Brasil và Gabon.
Khai thác
- Mangan được khai thác bằng phương pháp khai thác và khai thác ngầm.
- Phương pháp khai thác được sử dụng cho các mỏ quặng mangan nằm gần bề mặt Trái đất.
- Phương pháp khai thác ngầm được sử dụng cho các mỏ quặng mangan nằm sâu dưới lòng đất.
- Quặng mangan được khai thác được nghiền nhỏ và sau đó được nung trong lò nung để khử oxy.
- Mangan được thu được dưới dạng kim loại hoặc hợp kim.
Lưu ý:
- Quá trình khai thác mangan có thể gây ô nhiễm môi trường do phát thải khí bụi và nước thải.
- Cần có biện pháp bảo vệ môi trường trong quá trình khai thác mangan
Vấn đề an toàn khi sử dụng nguyên tố Mangan
Mangan là một nguyên tố thiết yếu cho cơ thể con người, nhưng nó cũng có thể gây hại nếu tiếp xúc quá mức. Dưới đây là một số vấn đề an toàn cần lưu ý khi sử dụng nguyên tố Mangan:
Hít phải
- Hít phải bụi mangan có thể gây ra các vấn đề về hô hấp, như viêm phế quản và xơ phổi.
- Cần sử dụng thiết bị bảo hộ cá nhân, như khẩu trang, khi làm việc với mangan.
Tiếp xúc da
- Tiếp xúc da với mangan có thể gây kích ứng da, như mẩn đỏ, ngứa và phát ban.
- Cần đeo găng tay và quần áo bảo hộ khi làm việc với mangan.
Nuốt phải
- Nuốt phải mangan có thể gây ra các vấn đề về tiêu hóa, như buồn nôn, nôn mửa và tiêu chảy.
- Cần cẩn thận khi sử dụng mangan trong thực phẩm và đồ uống.
Ảnh hưởng đến sức khỏe sinh sản
- Mangan có thể ảnh hưởng đến sức khỏe sinh sản ở nam giới và phụ nữ.
- Cần tham khảo ý kiến bác sĩ trước khi sử dụng mangan nếu bạn đang mang thai hoặc cho con bú.
Ảnh hưởng đến hệ thần kinh
- Tiếp xúc với mangan trong thời gian dài có thể gây ra các vấn đề về hệ thần kinh, như Parkinson.
- Cần theo dõi sức khỏe thường xuyên nếu bạn làm việc với mangan.
Lưu ý:
- Mức độ an toàn của Mangan phụ thuộc vào nhiều yếu tố, như dạng thức, liều lượng và thời gian tiếp xúc.
- Cần tham khảo ý kiến chuyên gia để đảm bảo an toàn khi sử dụng Mangan.
Ngoài ra, bạn cũng nên lưu ý:
- Tránh sử dụng các sản phẩm chứa mangan nếu bạn có dị ứng với mangan.
- Bảo quản mangan ở nơi khô ráo, thoáng mát, tránh xa tầm tay trẻ em.
- Rửa tay kỹ sau khi làm việc với mangan.
Chất lượng và phương thức cung cấp nguyên tố Mangan
Chất lượng
- Chất lượng của nguyên tố Mangan được đánh giá dựa trên hàm lượng mangan, tạp chất và độ tinh khiết.
- Mangan được phân loại thành các cấp khác nhau dựa trên chất lượng, như mangan thương mại, mangan tinh khiết và mangan siêu tinh khiết.
- Mangan thương mại được sử dụng cho các ứng dụng thông thường, như sản xuất thép và hợp kim.
- Mangan tinh khiết được sử dụng cho các ứng dụng đặc biệt, như sản xuất pin và hóa chất.
- Mangan siêu tinh khiết được sử dụng cho các ứng dụng trong ngành điện tử và y tế.
Phương thức cung cấp
- Mangan được cung cấp dưới dạng kim loại, hợp kim, oxit và muối.
- Kim loại mangan được cung cấp dưới dạng thanh, viên và bột.
- Hợp kim mangan được cung cấp dưới dạng thanh, tấm và dây.
- Oxit mangan được cung cấp dưới dạng bột.
- Muối mangan được cung cấp dưới dạng tinh thể và dung dịch.
Cung cấp bởi:
- Mangan được cung cấp bởi các nhà sản xuất kim loại và hóa chất.
- Các nhà sản xuất này khai thác quặng mangan, xử lý quặng mangan và sản xuất mangan dưới dạng kim loại, hợp kim, oxit và muối.
- Các nhà cung cấp mangan bán mangan cho các nhà sản xuất, nhà phân phối và người tiêu dùng.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Mangan mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Mangan. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







