Nguyên tố Iod: Lợi ích sức khỏe và ứng dụng đời sống
Bài viết này, yeuhoahoc.edu.vn sẽ giới thiệu sâu hơn về nguyên tố Iod, từ cấu trúc, tính chất, đến những ứng dụng và lợi ích sức khỏe mà nó mang lại.
Iod, một nguyên tố thiết yếu cho cơ thể, không chỉ quan trọng trong y tế và dinh dưỡng mà còn đóng vai trò không thể thiếu trong nhiều ngành công nghiệp. Iod nổi bật với đặc tính khử trùng mạnh mẽ và khả năng cung cấp hormone thiết yếu cho tuyến giáp. Bài viết này, yeuhoahoc.edu.vn sẽ giới thiệu sâu hơn về Iod, từ cấu trúc, tính chất, đến những ứng dụng và lợi ích sức khỏe mà nó mang lại, cung cấp cái nhìn toàn diện về nguyên tố đa năng này.
Giới thiệu về nguyên tố Iod
Định nghĩa
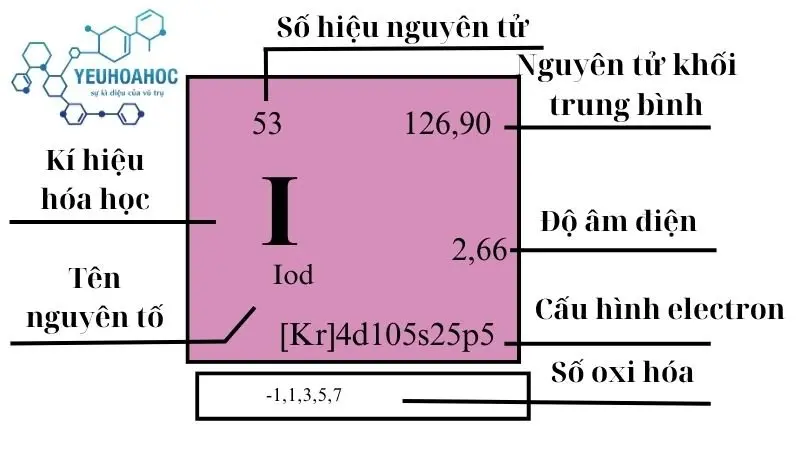
Nguyên tố Iod, với tên tiếng Anh là Iodine và kí hiệu hóa học là I, là một nguyên tố hóa học thuộc nhóm Halogen với số nguyên tử là 53 trong bảng tuần hoàn. Iod được biết đến nhiều nhất qua tính chất là một chất rắn tím đậm ở nhiệt độ phòng, có khả năng phát ra hơi màu tím đặc trưng khi nóng chảy.
Lịch sử hình thành nguyên tố Iod
- Năm 1811: Bernard Courtois, một nhà hóa học người Pháp, đã phát hiện ra I-ốt trong khi nghiên cứu tảo bẹ.
- Tên gọi “Iod” bắt nguồn từ tiếng Hy Lạp “iodes”, có nghĩa là “màu tím”, do màu tím đặc trưng của nguyên tố này khi ở dạng hơi.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1813: Joseph Louis Gay-Lussac xác định I-ốt là một nguyên tố.
- 1820: Jean-François Coindet sử dụng I-ốt để điều trị bệnh bướu cổ.
- 1831: Baron Antoine Bussy xác định cấu trúc phân tử của I-ốt (I2).
- 1908: David Marine phát hiện ra tầm quan trọng của I-ốt đối với sức khỏe con người.
Nguyên tố Iod trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn, Iod nằm ở nhóm 17, được biết đến là nhóm Halogen. Halogen bao gồm các nguyên tố có tính chất hóa học tương tự nhau, chẳng hạn như khả năng tạo thành muối khi phản ứng với kim loại.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 17 | 5 | 126,90447(3) | 4,93 | 386,85 | 457,4 | 0,214 | 2,66 | 0,45 |
Tính chất của nguyên tố Iod
Tính chất vật lý
- Dạng tồn tại: Rắn, màu tím đen
- Nhiệt độ nóng chảy: 113,7 °C
- Nhiệt độ sôi: 184,3 °C
- Tỉ trọng: 4,93 g/cm³
- Độ tan:
- Tan ít trong nước
- Tan trong cồn, etanol
- Tan trong dung dịch KI
Tính chất hóa học
- Tính oxi hóa: I-ốt có tính oxi hóa mạnh
- Phản ứng với kim loại: I-ốt tác dụng với kim loại để tạo thành muối I-odua
- Ví dụ:
Mg + I2 → MgI2
- Phản ứng với axit: I-ốt tác dụng với axit để tạo thành muối I-odua và axit tương ứng
- Ví dụ:
I2 + 2HCl → 2HI + Cl2
- Phản ứng với dung dịch kiềm: I-ốt tác dụng với dung dịch kiềm để tạo thành muối I-odua và hypoiodit
- Ví dụ:
I2 + 2NaOH → NaI + NaIO + H2O
- Phản ứng với tinh bột: I-ốt tạo thành phức màu xanh với tinh bột
Lưu ý:
- I-ốt có thể gây độc nếu sử dụng quá liều.
- Cần cẩn thận khi sử dụng I-ốt và các hợp chất của nó.
Ứng dụng của nguyên tố Iod
Y tế
- Phòng ngừa và điều trị bệnh bướu cổ: Iod là thành phần thiết yếu của hormone tuyến giáp, do đó nó đóng vai trò quan trọng trong việc duy trì chức năng tuyến giáp. Thiếu hụt Iod có thể dẫn đến bệnh bướu cổ, một tình trạng tuyến giáp phì đại.
- Sát trùng vết thương: Iod có tính sát khuẩn mạnh, do đó nó được sử dụng để sát trùng vết thương và ngăn ngừa nhiễm trùng.
- Xử lý nhiễm trùng: Iod được sử dụng để điều trị một số bệnh nhiễm trùng do vi khuẩn, nấm và ký sinh trùng.
Hóa học
- Chất xúc tác: Iod được sử dụng làm chất xúc tác trong một số phản ứng hóa học, ví dụ như trong sản xuất xà phòng và thuốc nhuộm.
- Sản xuất thuốc nhuộm: Iod được sử dụng để sản xuất một số loại thuốc nhuộm, ví dụ như thuốc nhuộm màu tím.
- Sản xuất xà phòng: Iod được sử dụng để sản xuất một số loại xà phòng, ví dụ như xà phòng diệt khuẩn.
Nông nghiệp
- Khử trùng đất: Iod được sử dụng để khử trùng đất và ngăn ngừa nấm bệnh.
- Phòng trừ sâu bệnh: Iod được sử dụng để phòng trừ một số loại sâu bệnh, ví dụ như rệp và nấm.
Thực phẩm
- Chất phụ gia thực phẩm: Iod được sử dụng làm chất phụ gia thực phẩm để bảo quản thực phẩm và tăng cường hương vị.
- Giúp bảo quản thực phẩm: Iod có tính sát khuẩn mạnh, do đó nó được sử dụng để bảo quản thực phẩm và ngăn ngừa hư hỏng.
Điều chế và sản xuất nguyên tố Iod
Điều chế Iod
Điều chế trong phòng thí nghiệm
- Phương pháp 1: Phản ứng giữa KI và H2SO4 đặc:
2KI + H2SO4 đặc → K2SO4 + 2HI + I2
- Phương pháp 2: Phản ứng giữa MnO2 và KI:
MnO2 + 4KI + 4H2SO4 → 2K2SO4 + MnSO4 + 4H2O + I2
Điều chế trong công nghiệp
- Phương pháp 1: Chiết xuất từ rong biển:
- Người ta dùng rong biển đốt cháy để tạo ra tro.
- Tro được nung nóng với axit sulfuric để giải phóng Iod.
- Iod được thu thập dưới dạng hơi và ngưng tụ thành chất rắn.
- Phương pháp 2: Khai thác từ nước muối:
- Nước muối được bơm lên từ các giếng sâu.
- Iod được tách ra khỏi nước muối bằng cách điện phân.
- Iod được thu thập dưới dạng hơi và ngưng tụ thành chất rắn.
Sản xuất Iod
Iod được sản xuất chủ yếu từ hai nguồn:
Rong biển:
- Đây là phương pháp truyền thống để sản xuất Iod.
- Rong biển được thu hoạch và sấy khô.
- Sau đó, rong biển được mang đi đốt cháy để tạo ra tro.
- Tro được nung nóng với axit sulfuric để giải phóng Iod.
- Iod được thu thập dưới dạng hơi và ngưng tụ thành chất rắn.
Nước muối:
- Đây là phương pháp hiện đại để sản xuất Iod.
- Nước muối được bơm lên từ các giếng sâu.
- Iod được tách ra khỏi nước muối bằng cách điện phân.
- Iod được thu thập dưới dạng hơi và ngưng tụ thành chất rắn.
Phản ứng của nguyên tố Iod

Phản ứng với kim loại
Iod phản ứng với nhiều kim loại để tạo thành muối iodua. Ví dụ:
- Phản ứng với sắt:
Fe + I₂ → FeI₂
- Phản ứng với nhôm:
2Al + 3I₂ → 2AlI₃
Phản ứng với dung dịch kiềm
Iod phản ứng với dung dịch kiềm để tạo thành muối iodua và hypoiodit. Ví dụ:
- Phản ứng với NaOH:
I₂ + 2NaOH → NaI + NaIO + H₂O
Phản ứng với axit
Iod phản ứng với axit để tạo thành muối iodua và axit hypoiodous. Ví dụ:
- Phản ứng với H₂SO₄:
I₂ + H₂SO₄ → 2HI + H₂SO₃
Phản ứng với tinh bột
Iod tạo thành phức hợp màu xanh lam với tinh bột. Phản ứng này được sử dụng để kiểm tra sự hiện diện của tinh bột.
Ví dụ cụ thể:
- Thử nghiệm với dung dịch hồ tinh bột:
Cho vài giọt dung dịch Iod vào dung dịch hồ tinh bột, dung dịch sẽ chuyển sang màu xanh lam. Khi đun nóng dung dịch, màu xanh lam sẽ nhạt dần và mất đi khi dung dịch sôi. Khi dung dịch nguội, màu xanh lam sẽ xuất hiện trở lại.
Vấn đề an toàn khi sử dụng nguyên tố Iod
Dấu hiệu ngộ độc Iod
- Buồn nôn
- Nôn mửa
- Tiêu chảy
- Đau bụng
- Nhức đầu
- Chóng mặt
- Yếu ớt
- Mệt mỏi
- Khô miệng
- Kim loại trong miệng
- Nổi mẩn ngứa
- Sưng tấy
- Sốt
Nguy cơ ngộ độc Iod
- Trẻ em có nguy cơ ngộ độc Iod cao hơn người lớn.
- Những người có bệnh lý tuyến giáp có nguy cơ ngộ độc Iod cao hơn.
- Sử dụng quá nhiều Iod có thể dẫn đến ngộ độc.
Cách sử dụng Iod an toàn
- Chỉ sử dụng Iod theo hướng dẫn của bác sĩ.
- Không sử dụng Iod nếu bạn đang mang thai hoặc cho con bú.
- Không sử dụng Iod nếu bạn có bệnh lý tuyến giáp.
- Tránh tiếp xúc trực tiếp với Iod.
- Bảo quản Iod ở nơi khô ráo, thoáng mát, tránh xa tầm tay trẻ em.
Biện pháp xử lý khi ngộ độc Iod
- Gọi khẩn cấp cho cấp cứu 115 hoặc đến cơ sở y tế gần nhất.
- Uống nhiều nước.
- Gây nôn (nếu có thể).
- Không cho người ngộ độc ăn hoặc uống bất cứ thứ gì.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Iod mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Iod. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







