Nguyên tố Gali: Tính chất và vai trò trong công nghệ
Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Gali, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn.
Galli là một nguyên tố đặc biệt với nhiều ứng dụng độc đáo trong công nghiệp và khoa học. Tính chất độc đáo của gallium đã tạo ra sự quan tâm rộng rãi trong việc nghiên cứu và áp dụng trong các lĩnh vực khác nhau. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Gali, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Gali
Định nghĩa
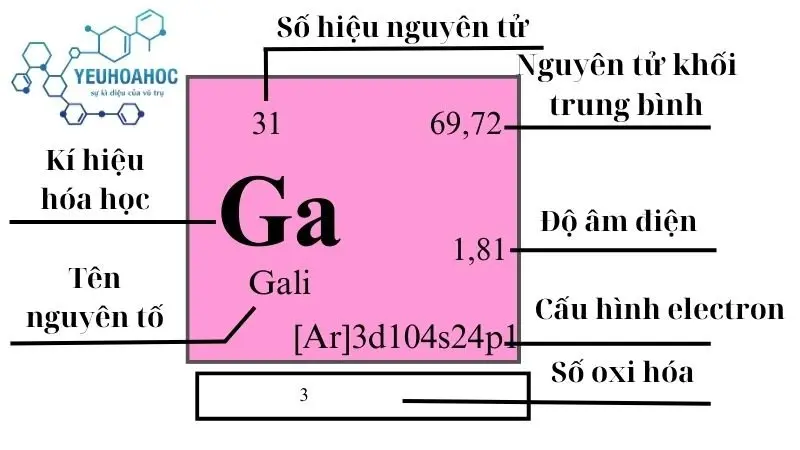
Gali, với tên tiếng Anh là “Gallium” và ký hiệu hóa học là Ga, là nguyên tố hóa học có số nguyên tử là 31. Đặc biệt nổi bật với điểm nóng chảy thấp chỉ ở 29.76°C, gali có thể lỏng ở nhiệt độ gần với nhiệt độ phòng và chuyển sang thể rắn khi được làm lạnh. Gali được sử dụng rộng rãi trong ngành công nghiệp điện tử và quang học.
Lịch sử hình thành nguyên tố Gali
Gali được phát hiện vào năm 1875 bởi nhà hóa học người Pháp Lecoq de Boisbaudran thông qua phân tích phổ học của một khoáng chất kẽm. Sự phát hiện này đáng chú ý bởi nó chứng minh dự đoán trước đó của Dmitri Mendeleev về tồn tại của một nguyên tố ở vị trí Ga trong bảng tuần hoàn, dựa trên nguyên lý của bảng tuần hoàn hóa học mà ông đã phát triển.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1875: Paul Émile Lecoq de Boisbaudran phát hiện ra Gali bằng phương pháp phân tích quang phổ.
- 1876: Lecoq de Boisbaudran chiết xuất Gali tinh khiết.
- 1878: Lecoq de Boisbaudran đặt tên cho nguyên tố này là Gali, theo tiếng Latinh “Gallia” (tên gọi của Pháp).
Tầm quan trọng của nguyên tố Gali trong đời sống
- Gali được sử dụng trong nhiều lĩnh vực, bao gồm:
- Hợp kim: Gali được sử dụng để tạo ra các hợp kim có độ bền cao, nhẹ và chống ăn mòn.
- Điện tử: Gali được sử dụng trong các thiết bị bán dẫn, chẳng hạn như diode phát sáng (LED) và tế bào năng lượng mặt trời.
- Y học: Gali được sử dụng trong các hợp chất radioisotope để chẩn đoán và điều trị ung thư.
- Nhiệt kế: Gali có nhiệt độ nóng chảy thấp (29,76 °C) nên được sử dụng trong nhiệt kế đo nhiệt độ cao.
Nguyên tố Gali trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn, Gali thuộc nhóm 13, chu kỳ 4, là một phần của nhóm boron. Tính chất độc đáo của Gali, bao gồm khả năng chịu nhiệt độ cao khi ở trạng thái lỏng và tạo hợp chất với các bán dẫn, làm cho nó trở thành một nguyên tố quan trọng trong nghiên cứu khoa học và ứng dụng công nghiệp.
- Gali thuộc nhóm 13 (nhóm bo) trong bảng tuần hoàn hóa học.
- Gali là một kim loại mềm, màu trắng bạc.
- Gali có số nguyên tử 31, nghĩa là hạt nhân nguyên tử của nó có 31 proton.
- Gali có cấu hình electron hóa trị là 3d10 4s2 4p1.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 13 | 4 | 69,723(1) | 5,907 | 302,9146 | 2477 | 0,371 | 1,81 | 19 |
Tính chất của nguyên tố Gali (Ga)
Tính chất vật lý
- Gali là kim loại mềm, màu trắng bạc, có ánh kim.
- Gali có nhiệt độ nóng chảy thấp (29,76 °C), chỉ cao hơn nhiệt độ phòng một chút.
- Gali có thể tan chảy trong lòng bàn tay.
- Gali có điểm sôi cao (2204 °C).
- Gali có mật độ cao (5,904 g/cm³).
- Gali dẫn điện và dẫn nhiệt tốt.
Tính chất hóa học
- Gali là kim loại có tính khử trung bình.
- Gali tác dụng với axit:
2Ga + 6HCl → 2GaCl3 + 3H2↑
Ga + 2H2SO4 → Ga2(SO4)3 + H2↑
- Gali tác dụng với dung dịch muối của kim loại đứng sau nó trong dãy điện hóa:
Ga + CuSO4 → GaSO4 + Cu↓
Ga + AgNO3 → Ga(NO3)3 + Ag↓
- Gali tác dụng với oxi:
2Ga + 3O2 → Ga2O3
- Gali tác dụng với axit nitric:
4Ga + 10HNO3 → 4Ga(NO3)3 + N2↑ + 5H2O
Lưu ý:
- Gali không tác dụng với nước.
- Gali bị khử trong dung dịch kiềm.
Tóm lại:
- Gali là kim loại có tính khử trung bình.
- Gali tác dụng với axit, dung dịch muối của kim loại đứng sau nó trong dãy điện hóa, oxi và axit nitric.
Ứng dụng của nguyên tố Gali
Gali là một nguyên tố hóa học có ký hiệu Ga và số nguyên tử 31. Nó là một kim loại mềm, màu trắng bạc, có nhiệt độ nóng chảy thấp (29,76 °C). Gali có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau, bao gồm:
Hợp kim
- Gali được sử dụng để tạo ra các hợp kim có độ bền cao, nhẹ và chống ăn mòn.
- Ví dụ, hợp kim gali-nhôm được sử dụng trong ngành hàng không vũ trụ vì độ bền và trọng lượng nhẹ.
- Gali cũng được sử dụng để tạo ra các hợp kim có nhiệt độ nóng chảy thấp, được sử dụng trong các ứng dụng như hàn và đúc.
Điện tử
- Gali được sử dụng trong các thiết bị bán dẫn, chẳng hạn như diode phát sáng (LED) và tế bào năng lượng mặt trời.
- Gali arsenide là một hợp chất bán dẫn quan trọng được sử dụng trong các thiết bị điện tử tốc độ cao.
- Gali cũng được sử dụng trong các chất kết dính chip điện tử do khả năng dẫn điện tốt và khả năng làm giảm nhiệt độ hoạt động của chip.
Y học
- Gali được sử dụng trong các hợp chất radioisotope để chẩn đoán và điều trị ung thư.
- Ví dụ, gali-67 citrate được sử dụng để chẩn đoán u lympho và ung thư tuyến tụy.
- Gali cũng được sử dụng trong các loại thuốc điều trị ung thư, chẳng hạn như gallium nitrate.
Nhiệt kế
- Gali có nhiệt độ nóng chảy thấp (29,76 °C) nên được sử dụng trong nhiệt kế đo nhiệt độ cao.
- Ví dụ, nhiệt kế gali được sử dụng trong các lò nung và lò luyện kim.
- Gali cũng được sử dụng trong các thiết bị đo nhiệt độ y tế.
Các ứng dụng khác
- Gali được sử dụng trong các loại kem đánh răng để làm trắng răng.
- Gali được sử dụng trong các hợp kim nha khoa vì độ bền và khả năng chống ăn mòn.
- Gali cũng được sử dụng trong các thiết bị quang học và các ứng dụng khác.
Điều chế và sản xuất nguyên tố Gali
Nguyên tố Gali (Ga) không tồn tại tự do trong tự nhiên mà thường được tìm thấy dưới dạng hợp chất trong quặng và khoáng vật. Quá trình điều chế và sản xuất Gali phức tạp và đòi hỏi nhiều bước xử lý cụ thể. Dưới đây là quy trình chung để điều chế và sản xuất Gali:
Điều chế Gali

Khai thác và xử lý quặng
- Gali thường được điều chế như một sản phẩm phụ trong quá trình sản xuất kim loại khác, chủ yếu là nhôm và kẽm từ quặng bauxite và sphalerite.
- Quá trình này bắt đầu bằng việc khai thác quặng chứa Gali, tiếp theo là xử lý hóa học để trích xuất Gali dưới dạng các hợp chất, thường là gali(III) hydroxide (Ga(OH)₃).
Tinh chế Gali
- Gali hydroxide sau đó được chuyển hóa thành gali kim loại thông qua quá trình điện phân hoặc bằng cách khử hóa học với các chất khử như cacbon hoặc nhôm ở nhiệt độ cao.
2Ga(OH)3+3C→2Ga+3CO2+3H2O
- Gali kim loại thô sau khi được điều chế thường chứa tạp chất và cần phải được tinh chế. Một phương pháp tinh chế phổ biến là thông qua quá trình kết tinh chọn lọc, nơi Gali được làm lạnh chậm để kết tinh, tách biệt từ các tạp chất.
Sản xuất Gali
Chưng cất chân không
- Để tăng độ tinh khiết, Gali kim loại sau quá trình tinh chế đầu tiên có thể được chưng cất dưới chân không. Quá trình này giúp loại bỏ các tạp chất có điểm bay hơi khác nhau so với Gali.
Kết tinh zone
- Phương pháp kết tinh zone, nơi một vùng nhiệt di động qua một khối Gali kim loại, cũng có thể được sử dụng để tăng độ tinh khiết của Gali bằng cách loại bỏ tạp chất.
Phản ứng của nguyên tố Gali
Gali là một kim loại mềm, màu trắng bạc, có tính khử trung bình.
Phản ứng với axit
- Phản ứng với axit nitric đặc:
4Ga + 10HNO3 → 4Ga(NO3)3 + N2O + 5H2O
- Phản ứng với axit clohydric:
2Ga + 6HCl → 2GaCl3 + 3H2
Phản ứng với dung dịch kiềm
Ga + 2NaOH → Na2GaO2 + H2
Phản ứng với oxy khi nung nóng:
2Ga + O2 → Ga2O3
Phản ứng với halogen khi nung nóng:
2Ga + 3Cl2 → 2GaCl3
Phản ứng khử:
- Phản ứng với dung dịch CuSO4:
Ga + CuSO4 → GaSO4 + Cu
Ví dụ cụ thể:
- Cho mẩu Gali vào dung dịch axit nitric đặc:
Ta thấy có khí màu nâu thoát ra là NO2. Dung dịch chuyển sang màu xanh lam là do tạo thành muối gali(III) nitrat.
- Cho mẩu Gali vào dung dịch NaOH:
Ta thấy có khí không màu thoát ra là H2. Dung dịch chuyển sang màu xanh lam đậm là do tạo thành phức gali(III) hydroxit.
- Nung nóng mẩu Gali trong không khí:
Ta thấy mẩu Gali chuyển sang màu trắng xám là do tạo thành gali(III) oxit.
Ngoài ra, Gali còn có thể tham gia vào nhiều phản ứng hóa học khác.
Tồn tại và khai thác nguyên tố Gali
Tồn tại
- Gali là một nguyên tố tương đối hiếm, với hàm lượng trong vỏ Trái đất khoảng 16,9 ppm (phần triệu), tương tự như chì, coban và niobi.
- Nó không tồn tại dưới dạng nguyên tố tự do trong tự nhiên mà chỉ tồn tại dưới dạng hợp chất, chủ yếu là trong quặng bauxite.
- Một số loại bụi than chứa một lượng nhỏ gali, thường dưới 1% trọng lượng.
Khai thác
- Gali được sản xuất độc quyền như một sản phẩm phụ trong quá trình xử lý quặng của các kim loại khác.
- Nguồn chính của nó là bauxite, quặng chính của nhôm, tuy nhiên cũng có thể chiết xuất từ quặng kẽm sunfua (sphalerite) trong một lượng nhỏ.
- Cục Khảo sát Địa chất Hoa Kỳ (USGS) ước tính rằng hơn 1 triệu tấn gali được chứa trong trữ lượng quặng bauxite đã biết.
- Việc khai thác gali phụ thuộc vào tốc độ khai thác bauxite, quặng kẽm và than đá.
Vấn đề an toàn khi sử dụng nguyên tố Gali
- Gali là một kim loại có thể gây hại cho sức khỏe nếu tiếp xúc với lượng lớn.
- Một số triệu chứng của ngộ độc gali bao gồm:
- Buồn nôn
- Nôn
- Tiêu chảy
- Đau bụng
- Chuột rút
- Nhức đầu
- Sốt
- Lơ mơ
- Ngộ độc gali cấp tính có thể gây tử vong.
- Gali cũng có thể gây ra các tác dụng phụ khác như:
- Kích ứng da
- Kích ứng mắt
- Viêm phế quản
- Thiếu hụt đồng
Biện pháp phòng ngừa:
- Hạn chế tiếp xúc với gali, đặc biệt là với lượng gali lớn.
- Sử dụng các biện pháp bảo hộ cá nhân khi làm việc với gali, chẳng hạn như găng tay, khẩu trang và kính bảo hộ.
- Làm việc trong khu vực thông gió tốt.
- Tuân thủ các quy định về an toàn khi sử dụng gali.
- Tham khảo ý kiến bác sĩ trước khi sử dụng các sản phẩm bổ sung gali.
Chất lượng và phương thức cung cấp nguyên tố Gali
Chất lượng Gali
- Gali được cung cấp dưới dạng kim loại, hợp kim và các hợp chất.
- Chất lượng gali có thể khác nhau tùy thuộc vào nhà cung cấp.
- Các yếu tố ảnh hưởng đến chất lượng gali bao gồm
- Độ tinh khiết của Gali là yếu tố quan trọng nhất đối với chất lượng, với Gali tinh khiết điện tử (đạt 99.9999% hoặc cao hơn) được yêu cầu cho hầu hết các ứng dụng công nghệ bán dẫn.
- Tạp chất cần được kiểm soát chặt chẽ, vì chúng có thể ảnh hưởng đến tính chất và hiệu suất của hợp chất bán dẫn Gali.
Phương thức cung cấp Gali
- Gali có thể được mua từ các nhà cung cấp hóa chất và kim loại.
- Phương thức cung cấp gali bao gồm:
- Bột
- Thanh
- Lá
- Hợp kim
- Hợp chất
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Gali mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Gali. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







