Nguyên tố Chlor: Khám phá tính chất và ứng dụng đa dạng
Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Chlor, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế.
Nguyên tố Chlor là một trong những nguyên tố hóa học quan trọng và phổ biến trong tự nhiên. Với ký hiệu hóa học là Cl và số nguyên tử là 17 trong bảng tuần hoàn, Chlor thuộc nhóm các halogen, và là một trong những nguyên tố có tầm quan trọng lớn trong hóa học và ngành công nghiệp. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Chlor, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Chlor
Định nghĩa
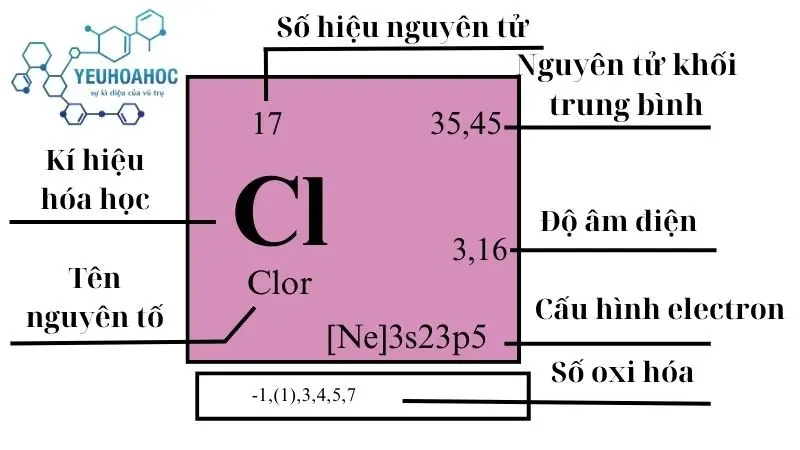
Chlor, với tên tiếng Anh là “Chlorine”, kí hiệu hóa học là Cl, có số hiệu nguyên tử là 17, và thuộc nhóm 7 (nhóm Halogen) trong bảng tuần hoàn. Chlor có 17 electron, với 7 electron ở lớp ngoài cùng, thuộc chu kỳ 3 của bảng tuần hoàn làm cho nó rất hoạt động hóa học.
- Tên tiếng Anh: Chlorine
- Ký hiệu: Cl
- Số hiệu nguyên tử: 17
- Số electron: 17
- Số electron lớp ngoài cùng: 7
Lịch sử hình thành nguyên tố
Chlor được Carl Wilhelm Scheele phát hiện vào năm 1774, nhưng ban đầu nó được tưởng là một hợp chất hơn là một nguyên tố. Đến năm 1810, Sir Humphry Davy khẳng định Chlor là một nguyên tố trong bảng tuần hoàn hóa học.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- Năm 1774: Carl Wilhelm Scheele lần đầu tiên điều chế được khí chlor bằng cách cho axit hydrochloric tác dụng với pyrolusite (MnO2).
- Năm 1810: Humphry Davy đề xuất tên gọi “chlorine” cho nguyên tố này.
- Năm 1825: Michael Faraday phát hiện ra cách hóa lỏng khí chlor.
Tầm quan trọng của nguyên tố trong đời sống:
Chlor có nhiều ứng dụng thiết yếu trong cuộc sống hàng ngày, từ khử trùng nước uống và bể bơi đến việc sử dụng trong sản xuất nhiều loại sản phẩm công nghiệp.
Nguyên tố Chlor trong bảng tuần hoàn hóa học
- Chlor thuộc nhóm 17 (Halogen) trong bảng tuần hoàn hóa học.
- Các nguyên tố khác trong nhóm 17 bao gồm flo, brom, iốt và astatin.
- Các nguyên tố trong nhóm 17 có tính oxi hóa cao và có thể tạo thành muối với kim loại.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 17 | 3 | 35,452 3 4 9 | 0,003214 | 171,6 | 239,11 | 0,479 | 3,16 | 145 |
Tính chất của nguyên tố Chlor
Tính chất vật lý
- Chlor là khí màu vàng lục, có mùi hắc khó chịu.
- Khối lượng riêng: 3,214 g/L (ở 0°C và 1 atm).
- Nhiệt độ nóng chảy: -101,5°C.
- Nhiệt độ sôi: -34,04°C.
- Tan trong nước: Chlor tan trong nước tốt hơn so với các halogen khác.
- Độ độc: Chlor là khí độc, có thể gây kích ứng mắt, mũi, họng và phổi.
Tính chất hóa học
- Chlor là một halogen, có tính oxi hóa mạnh.
- Chlor có thể tác dụng với hầu hết các kim loại tạo thành muối clorua.
- Chlor có thể tác dụng với nhiều phi kim loại tạo thành hợp chất.
- Chlor có thể tác dụng với dung dịch kiềm tạo thành muối clorua và hipoclorit.
- Chlor có thể tác dụng với axit hữu cơ tạo thành hợp chất hữu cơ chứa clo.
Ứng dụng của nguyên tố Chlor

- Khử trùng:
- Chlor được sử dụng để khử trùng nước, hồ bơi và các bề mặt khác.
- Chlor có khả năng tiêu diệt vi khuẩn, virus và nấm mốc.
- Sản xuất hóa chất:
- Chlor được sử dụng để sản xuất nhiều loại hóa chất, bao gồm PVC, axit hydrochloric, và thuốc trừ sâu.
- PVC là một loại nhựa được sử dụng rộng rãi trong nhiều lĩnh vực.
- Axit hydrochloric là một loại axit mạnh được sử dụng trong nhiều ngành công nghiệp.
- Thuốc trừ sâu được sử dụng để diệt trừ sâu bệnh trong nông nghiệp.
- Sản xuất giấy:
- Chlor được sử dụng để tẩy trắng bột giấy.
- Việc tẩy trắng bột giấy giúp cho giấy trắng hơn và đẹp hơn.
- Sản xuất dược phẩm:
- Chlor được sử dụng để sản xuất một số loại thuốc.
- Một số loại thuốc có chứa Chlor bao gồm thuốc giảm đau, thuốc kháng sinh và thuốc trị ung thư.
- Một số ứng dụng khác:
- Chlor được sử dụng để sản xuất pin, cao su, và xà phòng.
- Chlor cũng được sử dụng để khử trùng nước thải.
Điều chế và sản xuất nguyên tố Chlor
Điều chế
- Điều chế trong phòng thí nghiệm:
- Phương pháp phổ biến: Cho axit hydrochloric đặc tác dụng với chất oxi hóa mạnh như MnO2, KMnO4.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
- Phương pháp khác: Điện phân dung dịch NaCl bão hòa có màng ngăn.
- Điều chế trong công nghiệp:
- Phương pháp điện phân: Điện phân dung dịch NaCl bão hòa có màng ngăn.
NaCl + H2O → NaOH + Cl2↑ + H2↑
- Phương pháp oxy hóa: Cho MnO2 tác dụng với HCl.
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Sản xuất
Chlor được sản xuất chủ yếu bằng phương pháp điện phân dung dịch NaCl bão hòa có màng ngăn.Quy trình sản xuất:
Dung dịch NaCl được bão hòa bằng cách cho NaCl vào nước và khuấy đều.
Dung dịch NaCl bão hòa được đưa vào bể điện phân.
Bể điện phân được chia thành hai ngăn bởi một màng ngăn.
Điện cực âm được làm bằng than chì.
Điện cực dương được làm bằng kim loại trơ như titan.
Dòng điện được đi qua dung dịch NaCl.
Tại điện cực âm, nước bị điện phân thành H2 và OH-.
Tại điện cực dương, Cl- bị điện phân thành Cl2.
Khí Cl2 được thu gom và làm khô
Sản lượng:
Nhu cầu Chlor trên toàn thế giới ước tính khoảng 60 triệu tấn mỗi năm.
Các nhà sản xuất Chlor lớn nhất là Trung Quốc, Hoa Kỳ, Nhật Bản và Đức.
Phản ứng của nguyên tố Chlor
- Phản ứng với kim loại:
- Chlor có thể tác dụng với hầu hết các kim loại tạo thành muối clorua.
2Na + Cl2 → 2NaCl
- Phản ứng với kim loại mạnh xảy ra ở nhiệt độ thường.
- Phản ứng với kim loại yếu cần đun nóng.
- Phản ứng với phi kim loại:
- Chlor có thể tác dụng với nhiều phi kim loại tạo thành hợp chất.
H2 + Cl2 → 2HCl
- Phản ứng với phi kim loại mạnh xảy ra ở nhiệt độ thường.
- Phản ứng với phi kim loại yếu cần đun nóng.
- Phản ứng với dung dịch kiềm:
- Chlor có thể tác dụng với dung dịch kiềm tạo thành muối clorua và hipoclorit.
Cl2 + 2NaOH → NaCl + NaClO + H2O
- Phản ứng với axit hữu cơ:
- Chlor có thể tác dụng với axit hữu cơ tạo thành hợp chất hữu cơ chứa clo.
CH4 + Cl2 → CH3Cl + HCl
- Phản ứng với nước:
- Chlor có thể tác dụng với nước tạo thành axit hydrochloric và axit hipoclorit.
Cl2 + H2O → HCl + HClO
Tồn tại và khai thác nguyên tố Chlor
Tồn tại
- Chlor là nguyên tố phổ biến thứ 17 trong vỏ Trái đất.
- Nó tồn tại trong tự nhiên dưới dạng muối clorua, phổ biến nhất là halit (NaCl).
- Chlor cũng tồn tại trong nước biển và các khoáng chất khác.
Khai thác
- Chlor không được khai thác trực tiếp từ tự nhiên.
- Nó được sản xuất bằng phương pháp điện phân dung dịch NaCl bão hòa
Vấn đề an toàn khi sử dụng nguyên tố Chlor
Chlor là một nguyên tố hóa học có nhiều ứng dụng quan trọng trong đời sống. Tuy nhiên, Chlor cũng là một khí độc, có thể gây hại cho sức khỏe con người và môi trường nếu không được sử dụng an toàn.
Dưới đây là một số vấn đề an toàn cần lưu ý khi sử dụng Chlor:
- Độc tính:
- Chlor là khí độc, có thể gây kích ứng mắt, mũi, họng và phổi.
- Tiếp xúc với Chlor ở nồng độ cao có thể dẫn đến tử vong.
- Ảnh hưởng đến môi trường:
- Chlor có thể phá hủy tầng ozone, một lớp khí bảo vệ Trái đất khỏi tia UV của mặt trời.
- Chlor cũng có thể gây ô nhiễm nước và đất.
- Biện pháp an toàn:
- Cần cẩn thận khi sử dụng Chlor.
- Nên sử dụng Chlor trong khu vực thông gió tốt.
- Cần đeo khẩu trang và găng tay khi sử dụng Chlor.
- Tránh tiếp xúc trực tiếp với Chlor.
- Cần bảo quản Chlor đúng cách.
Chất lượng và phương thức cung cấp nguyên tố Chlor
Chất lượng
- Chlor được sản xuất theo nhiều cấp độ chất lượng khác nhau, tùy thuộc vào mục đích sử dụng.
- Cấp độ chất lượng cao nhất được sử dụng cho các ứng dụng trong ngành công nghiệp điện tử và y tế.
- Cấp độ chất lượng thấp hơn được sử dụng cho các ứng dụng khử trùng và tẩy trắng.
Phương thức cung cấp
- Chlor được cung cấp dưới dạng khí hóa lỏng trong các bình thép hoặc bồn chứa.
- Nó cũng được cung cấp dưới dạng dung dịch nước hoặc muối clorua.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Chlor mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Chlor. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







