Nguyên tố Chì: Định nghãi và vai trò trong khoa học
Hãy cùng yeuhoahoc.edu.vn khám phá định nghĩa, lịch sử và vị trí của nguyên tố chì trong bảng tuần hoàn hóa học.
Chì, một nguyên tố hóa học với một lịch sử phong phú, đã đóng vai trò quan trọng trong sự phát triển của nền văn minh nhân loại từ thời cổ đại. Dù ngày nay, chúng ta trở nên cẩn trọng hơn với việc sử dụng chì do những tác động tiêu cực đến sức khỏe và môi trường, nhưng không thể phủ nhận những đóng góp của nó trong nhiều lĩnh vực. Hãy cùng yeuhoahoc.edu.vn khám phá định nghĩa, lịch sử và vị trí của nguyên tố chì trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Chì
Định nghĩa
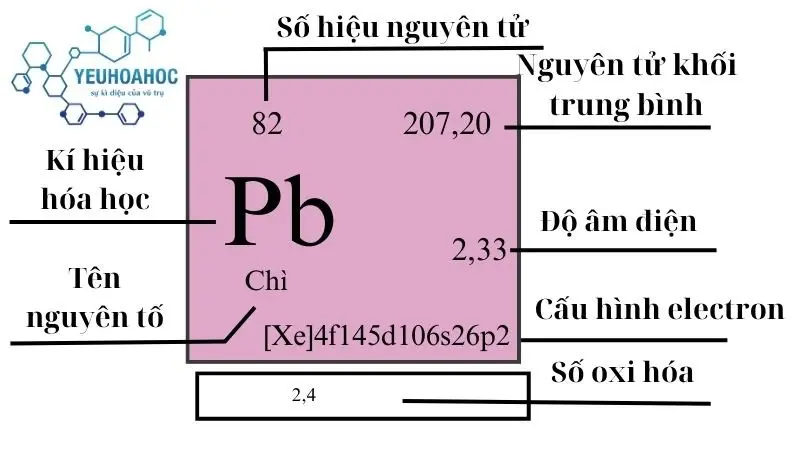
Chì, với tên tiếng Anh là “Lead” và ký hiệu hóa học là “Pb” (từ Latin “Plumbum”), là nguyên tố hóa học có số nguyên tử là 82. Chì nổi bật với đặc tính mềm, dễ uốn, và khả năng chống ăn mòn cao, cùng với độ dẫn điện và dẫn nhiệt tương đối thấp. Kim loại này tồn tại chủ yếu dưới dạng hợp chất trong tự nhiên và được sử dụng rộng rãi trong lịch sử.
Lịch sử hình thành nguyên tố Chì
- Thời tiền sử: Chì được con người sử dụng từ thời tiền sử, khoảng 6.000 năm trước Công nguyên.
- Thời cổ đại: Chì được sử dụng phổ biến trong các nền văn minh cổ đại như Ai Cập, Hy Lạp và La Mã.
- Thế kỷ 18: Chì được sử dụng để sản xuất các loại đạn dược.
- Thế kỷ 20: Chì được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất xăng, sơn và pin.
Một số mốc quan trọng trong lịch sử phát hiện:
- 3000 TCN: Chì được sử dụng ở Mesopotamia để làm đồ trang sức và đồ dùng.
- 1600 TCN: Người Ai Cập sử dụng chì để làm thuốc.
- 500 TCN: Người Hy Lạp sử dụng chì để làm ống nước.
- 100 SCN: Người La Mã sử dụng chì để làm đường ống dẫn nước và các vật liệu xây dựng.
- 1774: Benjamin Franklin phát hiện ra rằng chì có thể bảo vệ con người khỏi sét.
- 1922: Thomas Midgley Jr. phát hiện ra rằng chì có thể được sử dụng để tăng hiệu suất của xăng.
Nguyên tố Chì trong bảng tuần hoàn hóa học
- Thuộc nhóm 14 (nhóm cacbon)
- Chu kỳ 6
- Khối lượng nguyên tử: 207,2 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 14 | 6 | 207,2(1) | 11,342 | 600,61 | 2022 | 0,129 | 1,87 | 14 |
Tính chất của nguyên tố Chì
Tính chất vật lý
- Trạng thái: Rắn ở điều kiện tiêu chuẩn.
- Màu sắc: Xám.
- Mật độ: 11,34 g/cm³.
- Nhiệt độ nóng chảy: 327,4 °C.
- Nhiệt độ sôi: 1749 °C.
- Dẫn điện: Dẫn điện tốt.
- Dẫn nhiệt: Dẫn nhiệt kém.
- Đặc tính mềm dẻo: Có thể tạo thành lá mỏng hoặc kéo dài thành dây.
- Khối lượng riêng: 11,34 g/cm³.
- Độ cứng: Thấp.
Tính chất hóa học
- Tính khử: Yếu.
- Tính oxi hóa: Yếu.
- Khả năng phản ứng: Chì tương đối trơ về mặt hóa học.
- Phản ứng với oxy: Chì phản ứng với oxy ở nhiệt độ cao để tạo thành oxit chì (II) (PbO).
- Trong khi chì không tác động với axit HCl và H2SO4 loãng do các muối chì không hòa tan bám chặt vào bề mặt của kim loại, nó lại hoà tan dễ dàng trong dung dịch HNO3 và tan chậm hơn trong HNO3 đặc.
- Phản ứng với halogen: Chì phản ứng với halogen (như Cl2, Br2) để tạo thành muối halide.
- Hóa trị: Chì có hóa trị II và IV.
Lưu ý:
- Chì là một kim loại độc hại và cần được xử lý cẩn thận.
- Hơi chì có thể gây ra các vấn đề sức khỏe nghiêm trọng, bao gồm tổn thương não, thận và hệ thần kinh.
- Cần tuân thủ các biện pháp an toàn khi sử dụng và bảo quản chì.
Ứng dụng của nguyên tố Chì

Trước đây
Pin: Chì là thành phần chính trong các loại pin ắc quy chì-axit, được sử dụng cho ô tô, xe máy và các thiết bị khác.
Hợp kim: Chì được sử dụng để tạo hợp kim với các kim loại khác như thiếc, đồng và antimony để cải thiện độ bền, độ cứng và khả năng chống ăn mòn.
Vật liệu chống bức xạ: Chì có khả năng hấp thụ bức xạ tia X và tia gamma tốt nên được sử dụng để làm tấm chắn bảo vệ trong các thiết bị y tế và công nghiệp.
Xăng: Chì được sử dụng làm phụ gia trong xăng để tăng hiệu suất động cơ. Tuy nhiên, việc sử dụng chì trong xăng đã bị cấm ở nhiều quốc gia do tác hại của nó đối với môi trường và sức khỏe con người.
Sơn: Chì được sử dụng làm chất nhuộm màu trắng trong sơn. Tuy nhiên, việc sử dụng chì trong sơn đã bị cấm ở nhiều quốc gia do tác hại của nó đối với sức khỏe con người.
Hiện nay
Do tính độc hại cao, việc sử dụng chì trong nhiều ứng dụng đã bị hạn chế hoặc cấm hoàn toàn ở nhiều quốc gia.
Các ứng dụng thay thế an toàn hơn cho chì đã được phát triển và sử dụng rộng rãi.
Một số ứng dụng hiện nay của chì:
- Vật liệu chống bức xạ: Chì vẫn được sử dụng để làm tấm chắn bảo vệ trong các thiết bị y tế và công nghiệp.
Hợp kim: Chì vẫn được sử dụng trong một số hợp kim đặc biệt, ví dụ như hợp kim chì-thiếc dùng để hàn mạch điện tử.
Khai thác vàng: Chì được sử dụng để tách vàng khỏi quặng.
Nghiên cứu khoa học: Chì được sử dụng trong một số nghiên cứu khoa học, chẳng hạn như nghiên cứu về các phản ứng hóa học.
Điều chế và sản xuất nguyên tố Chì (Pb)
Điều chế
- Điều chế trong phòng thí nghiệm:
- Phương pháp nung nóng:
Phương pháp này nung nóng hợp chất của chì, ví dụ như PbO, PbS, PbCl2, để thu được Pb.
Phương trình điều chế:
PbO → Pb + O2
PbS + Fe → Pb + FeS
PbCl2 → Pb + Cl2
- Điều chế trong công nghiệp:
- Phương pháp khai thác:
Chì được khai thác từ quặng galena (PbS). Quặng galena được nghiền nhỏ và tuyển nổi để thu được tinh quặng chì. Sau đó, tinh quặng chì được nung nóng để thu được chì.
Phương trình điều chế:
PbS → Pb + S
Sản xuất
- Việc sản xuất chì ngày càng được hạn chế do tính độc hại cao.
- Một số quốc gia đã cấm hoàn toàn việc sản xuất và sử dụng chì.
- Các nhà sản xuất chì cần tuân thủ các quy định an toàn nghiêm ngặt để bảo vệ môi trường và sức khỏe con người.
Phản ứng của nguyên tố Chì (Pb)
Phản ứng với oxy
- Chì phản ứng với oxy ở nhiệt độ cao để tạo thành oxit chì (II) (PbO).
Phương trình phản ứng:
Pb + O2 → PbO
Phản ứng với axit
- Chì không phản ứng với axit HCl và H2SO4 loãng do các muối chì không tan bao bọc bên ngoài kim loại.
- Chì dễ dàng tan trong dung dịch HNO3, tan chậm trong HNO3 đặc.
Phương trình phản ứng:
Pb + 4HNO3 → Pb(NO3)2 + 2NO2 + 2H2O
Phản ứng với halogen
- Chì phản ứng với halogen (như Cl2, Br2) để tạo thành muối halide.
Phương trình phản ứng:
Pb + Cl2 → PbCl2
Phản ứng với dung dịch muối kim loại
- Chì có thể khử một số kim loại đứng sau nó trong dãy điện hóa, ví dụ như Cu, Fe.
Phương trình phản ứng:
Pb + CuSO4 → PbSO4 + Cu
Ví dụ cụ thể:
- Khi nung nóng một viên chì trong không khí, viên chì sẽ chuyển sang màu xám đen do tác dụng với oxy tạo thành oxit chì (II).
- Khi cho một mảnh chì vào dung dịch axit nitric loãng, mảnh chì sẽ tan dần và tạo ra khí nitơ dioxide màu nâu đỏ.
- Khi cho một mảnh chì vào dung dịch đồng sunfat, mảnh chì sẽ tan dần và dung dịch chuyển sang màu xanh lam do tạo thành muối chì sunfat.
Vấn đề an toàn của nguyên tố Chì
Chì là một kim loại độc hại cao và có thể gây ra nhiều vấn đề sức khỏe nghiêm trọng, bao gồm:
- Tổn thương não: Chì có thể gây tổn thương não ở trẻ em và thai nhi, dẫn đến giảm trí thông minh, rối loạn hành vi và các vấn đề học tập.
- Tổn thương thận: Chì có thể gây tổn thương thận, dẫn đến tăng huyết áp, suy thận và sỏi thận.
- Tổn thương hệ thần kinh: Chì có thể gây tổn thương hệ thần kinh, dẫn đến tê bì, ngứa ran, yếu cơ và mất khả năng phối hợp.
- Vấn đề về sinh sản: Chì có thể ảnh hưởng đến khả năng sinh sản ở cả nam và nữ.
- Ung thư: Chì có thể gây ung thư phổi, ung thư thận và ung thư máu.
Cách bảo vệ bản thân khỏi tác hại của chì:
- Tránh tiếp xúc với chì: Hạn chế tiếp xúc với chì trong môi trường, chẳng hạn như bụi bẩn, sơn chì và đồ chơi cũ.
- Rửa tay thường xuyên: Rửa tay thường xuyên bằng xà phòng và nước để loại bỏ chì khỏi da.
- Ăn một chế độ ăn uống cân bằng: Ăn nhiều thực phẩm giàu canxi, sắt và vitamin C để giúp cơ thể hấp thụ ít chì hơn.
- Uống nước sạch: Uống nước sạch để giúp cơ thể loại bỏ chì.
- Kiểm tra sức khỏe: Kiểm tra sức khỏe định kỳ để phát hiện sớm các vấn đề sức khỏe do chì gây ra.
Dưới đây là bản tóm tắt các thông tin cơ bản về nguyên tố Chì mà chúng tôi đã thu thập. Mời bạn đọc tiếp và khám phá thêm thông tin về chủ đề này!
Chúng tôi mong rằng bạn đã có được một cái nhìn toàn diện và chi tiết về nguyên tố Chì qua bài viết này. Nếu có bất cứ thắc mắc nào hoặc bạn muốn tìm hiểu thêm, hãy thoải mái để lại lời bình luận ở phía dưới!







