Nguyên tố Ceri: Khái niệm đặc điểm và phản ứng
Hãy cùng yeuhoahoc.edu.vn khám phá về nguyên tố Ceri, từ định nghĩa đến lịch sử và vị trí trong bảng tuần hoàn qua nội dung bài viết dưới đây
Trong thế giới đa dạng của bảng tuần hoàn hóa học, nguyên tố Ceri chiếm một vị trí đặc biệt, không chỉ vì tính chất độc đáo mà còn vì vai trò quan trọng của nó trong nhiều ứng dụng công nghệ hiện đại. Hãy cùng yeuhoahoc.edu.vn khám phá sâu hơn về Ceri, từ định nghĩa đến lịch sử phát hiện và vị trí của nó trong bảng tuần hoàn hóa học qua nội dung bài viết dưới đây.
Giới thiệu về nguyên tố Ceri (Cerium)
Định nghĩa
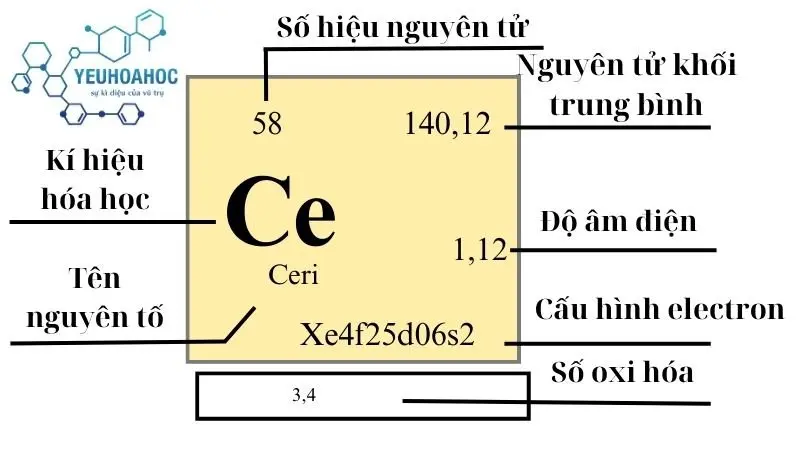
Ceri, với tên tiếng Anh là “Cerium” và kí hiệu hóa học là “Ce”, là nguyên tố hóa học có số nguyên tử 58 trong bảng tuần hoàn. Thuộc nhóm các nguyên tố đất hiếm, Ceri là một trong những thành viên sáng giá của nhóm Lanthanide. Đây là nguyên tố phổ biến nhất trong số các nguyên tố đất hiếm, nổi bật với tính chất hóa học linh hoạt và khả năng phản ứng cao.
Lịch sử hình thành nguyên tố Ceri
1751: Axel Fredrik Cronstedt phát hiện ra một loại khoáng chất mới mà sau này được gọi là Cerite.
1803: Martin Heinrich Klaproth phân lập được Ceria từ Cerite.
1826: Jöns Jacob Berzelius đặt tên cho nguyên tố mới là Ceri, theo tên Ceres, một tiểu hành tinh được phát hiện vào năm 1801.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1751: Axel Fredrik Cronstedt phát hiện ra Cerite.
- 1803: Martin Heinrich Klaproth phân lập được Ceria từ Cerite.
- 1826: Jöns Jacob Berzelius đặt tên cho nguyên tố mới là Ceri.
- 1875: Lecoq de Boisbaudran phát hiện ra Dysprosium trong Ceria.
- 1902: Carl Auer von Welsbach phát hiện ra Neodymium và Praseodymium trong Ceria.
Nguyên tố Ceri trong bảng tuần hoàn hóa học
- Thuộc nhóm 3 (kim loại chuyển tiếp)
- Chu kỳ 6
- Khối lượng nguyên tử: 140,116 u
Trong bảng tuần hoàn, Ceri được xếp vào nhóm các nguyên tố Lanthanide, đánh dấu bằng số nguyên tử 58. Đặc biệt, nó nằm gần đầu chuỗi nguyên tố đất hiếm, điều này phản ánh tính phổ biến và tầm quan trọng của nó. Với ba electron ở lớp ngoài cùng, Ceri có khả năng tạo thành một loạt các hợp chất hóa học, biểu hiện qua các trạng thái oxy hóa +3 và +4.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 6 | 140,116(1) | 6,77 | 1068 | 3716 | 0,192 | 1,12 | 66,5 |
Tính chất của nguyên tố Ceri
Tính chất vật lý
- Trạng thái: Kim loại màu trắng bạc
- Khối lượng riêng: 6,77 g/cm³
- Điểm nóng chảy: 795 °C
- Điểm sôi: 3443 °C
- Tính dẫn điện, dẫn nhiệt: Tốt
- Dẻo, dễ dát mỏng, dễ kéo sợi
- Bị oxy hóa nhanh trong không khí
- Phản ứng mãnh liệt với nước
Tính chất hóa học
- Tính khử: Mạnh
- Điện hóa: +3
- Tác dụng với nước:
- Ce + 2H2O → Ce(OH)3 + H2
- Tác dụng với axit:
- Ce + 2HCl → CeCl3 + H2
- Tác dụng với dung dịch muối:
- Ce2(SO4)3↓ + 3Na2SO4
- Tác dụng với phi kim:
- 2Ce + 3S → Ce2S3
- Hợp chất:
- Oxit: CeO2, CeO
- Hydroxit: Ce(OH)3
- Clorua: CeCl3
- Sulfat: Ce2(SO4)3
- Cacbonat: Ce2(CO3)3
Ứng dụng của nguyên tố Ceri

Hợp kim: Ceri được sử dụng để chế tạo hợp kim với các kim loại khác, ví dụ như hợp kim Ce-Fe-Ni dùng làm nam châm vĩnh cửu. Hợp kim Ceri cũng được sử dụng trong các ứng dụng khác như:
- Điện cực hàn: Ceri được sử dụng để tạo ra điện cực hàn có độ bền cao và chịu nhiệt tốt.
- Hợp kim đánh lửa: Ceri được sử dụng để tạo ra hợp kim đánh lửa cho bật lửa và các thiết bị đánh lửa khác.
- Hợp kim y tế: Ceri được sử dụng để tạo ra hợp kim y tế có khả năng chống ăn mòn tốt và tương thích sinh học.
Chất đánh bóng: Ceri oxit (CeO2) được sử dụng làm chất đánh bóng cho kính và kim loại. Ceri oxit có khả năng loại bỏ các vết xước và làm cho bề mặt sáng bóng.
Chất xúc tác: Ceri được sử dụng làm chất xúc tác trong một số phản ứng hóa học, ví dụ như:
- Phản ứng cracking dầu mỏ: Ceri được sử dụng để phá vỡ các phân tử hydrocarbon lớn thành các phân tử hydrocarbon nhỏ hơn.
- Phản ứng khử NOx: Ceri được sử dụng để khử khí NOx độc hại trong khí thải.
- Phản ứng tổng hợp amoniac: Ceri được sử dụng để tăng hiệu quả của quá trình tổng hợp amoniac.
Y tế: Ceri được sử dụng để điều trị một số bệnh, ví dụ như:
- Bệnh Gaucher: Ceri được sử dụng để điều trị bệnh Gaucher, một bệnh di truyền ảnh hưởng đến lá lách, gan và xương.
- Bệnh Paget: Ceri được sử dụng để điều trị bệnh Paget, một bệnh làm cho xương phát triển bất thường.
- Đau khớp: Ceri được sử dụng để giảm đau khớp.
Lĩnh vực khác: Ceri được sử dụng trong một số lĩnh vực khác như:
- Sản xuất pin nhiên liệu: Ceri được sử dụng để làm chất xúc tác trong pin nhiên liệu.
- Sản xuất thủy tinh: Ceri được sử dụng để làm cho thủy tinh có khả năng chống lại tia UV.
- Sản xuất gốm sứ: Ceri được sử dụng để tạo ra màu vàng cho gốm sứ.
Điều chế và sản xuất nguyên tố Ceri
Điều chế
- Trong phòng thí nghiệm:
- Phương pháp điện phân:
Phương pháp này sử dụng dòng điện để phân hủy ceri chloride (CeCl3) nóng chảy, thu được kim loại ceri và khí clo.
Phương trình phản ứng:
CeCl3 (nóng chảy) → Ce + Cl2
- Phương pháp khử:
Phương pháp này sử dụng kim loại mạnh như nhôm để khử ceri oxit (CeO2) ở nhiệt độ cao, thu được kim loại ceri và nhôm oxit.
Phương trình phản ứng:
3CeO2 + 2Al → 3Ce + Al2O3
- Trong công nghiệp:
- Phương pháp điện phân:
Đây là phương pháp chính để sản xuất ceri trong công nghiệp. Phương pháp này tương tự như phương pháp điện phân trong phòng thí nghiệm, nhưng được thực hiện ở quy mô lớn hơn.
Phương trình phản ứng:
CeCl3 (nóng chảy) → Ce + Cl2
Sản xuất
- Ceri được sản xuất thương mại bằng phương pháp điện phân ceri chloride (CeCl3) nóng chảy.
- Quá trình này được thực hiện trong lò điện chứa chất ceri chloride nóng chảy.
- Khi áp dụng dòng điện qua ceri chloride, nó sẽ phân hủy thành ceri kim loại và khí clo.
- Ceri kim loại được thu thập ở đáy lò điện.
- Khí clo được thu gom và sử dụng để sản xuất các sản phẩm khác.
Phản ứng của nguyên tố Ceri
Phản ứng với oxy
- Ceri phản ứng với oxy trong không khí ở nhiệt độ cao (khoảng 150-175 °C) để tạo thành ceri(IV) oxide (CeO2):
2Ce + O2 → 2CeO2
- Ceri(IV) oxide là một chất rắn màu trắng, không tan trong nước. Nó có tính oxy hóa mạnh và có thể được sử dụng làm chất xúc tác trong nhiều phản ứng hóa học.
Phản ứng với nước
- Ceri kim loại phản ứng chậm với nước ở nhiệt độ phòng để tạo thành ceri(III) hydroxide (Ce(OH)3):
Ce + 3H2O → Ce(OH)3 + 3/2 H2
- Ceri(III) hydroxide là một chất rắn màu trắng, không tan trong nước.
Phản ứng với axit
- Ceri kim loại phản ứng với axit loãng để tạo thành muối ceri(III):
Ce + 2HCl → CeCl3 + H2
- Muối ceri(III) thường có màu vàng hoặc cam.
Phản ứng với halogen
- Ceri kim loại phản ứng với halogen (như Cl2, Br2) ở nhiệt độ cao để tạo thành muối ceri(III) halide:
Ce + 3Cl2 → CeCl3
- Muối ceri(III) halide thường có màu trắng.
Ví dụ cụ thể:
- Đốt cháy ceri: Khi đốt cháy ceri trong không khí, nó sẽ tạo ra một ngọn lửa màu vàng sáng và tạo ra khói màu trắng. Khói này là ceri(IV) oxide.
- Phản ứng của ceri với axit hydrochloric: Cho ceri kim loại vào dung dịch axit hydrochloric loãng sẽ thấy có khí hydro thoát ra và dung dịch chuyển sang màu vàng. Dung dịch này chứa muối ceri(III) chloride.
- Phản ứng của ceri với dung dịch kiềm: Cho ceri(III) chloride vào dung dịch NaOH sẽ thấy có kết tủa màu trắng xuất hiện. Kết tủa này là ceri(III) hydroxide.
Vấn đề an toàn khi sử dụng nguyên tố Ceri
Kích ứng da và mắt
- Ceri có thể gây kích ứng da và mắt. Các triệu chứng có thể bao gồm ngứa, đỏ, sưng tấy và đau.
- Nếu tiếp xúc với ceri, cần rửa sạch da và mắt với nước ngay lập tức.
- Nên đeo găng tay, kính bảo hộ và quần áo bảo hộ khi làm việc với ceri.
Hít phải
- Hít phải bụi hoặc khói ceri có thể gây kích ứng đường hô hấp. Các triệu chứng có thể bao gồm ho, khó thở, tức ngực và đau họng.
- Nên làm việc với ceri trong khu vực thông gió tốt.
- Nên đeo khẩu trang chống bụi khi làm việc với ceri dạng bột.
Nguy cơ cháy nổ
- Ceri kim loại có thể dễ dàng bắt lửa và cháy trong không khí.
- Cần cẩn thận khi sử dụng ceri gần nguồn nhiệt.
- Nên có sẵn bình chữa cháy hoặc các phương tiện chữa cháy khác khi làm việc với ceri.
Nguy cơ độc hại
- Ceri có thể gây độc nếu nuốt phải. Các triệu chứng có thể bao gồm buồn nôn, ói mửa, tiêu chảy và đau bụng.
- Nên bảo quản ceri ở nơi an toàn, tránh xa tầm tay trẻ em và vật nuôi.
- Nên rửa tay kỹ sau khi làm việc với ceri.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Ceri mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Ceri. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







