Nguyên tố Caesi: Khái niệm.tính chất, điều chế và phản ứng
Bài viết này, yeuhoahoc.edu.vn sẽ đi sâu vào tính chất, và ứng dụng của nguyên tố Caesium, mở ra những hiểu biết mới về nguyên tố hấp dẫn
Caesi, là một nguyên tố kim loại mềm, nổi bật với màu ánh xanh đặc trưng và phản ứng nhanh chóng khi tiếp xúc với nước. Được sử dụng trong nhiều ứng dụng từ đồng hồ nguyên tử chính xác cao đến ngành y tế, Caesi mang đến một góc nhìn mới về tiềm năng của các nguyên tố hóa học. Bài viết này, yeuhoahoc.edu.vn sẽ đi sâu vào tính chất, lịch sử phát hiện và ứng dụng của nguyên tố Caesi, mở ra những hiểu biết mới về một trong những nguyên tố hấp dẫn nhất.
Giới thiệu về nguyên tố Caesi
Định nghĩa
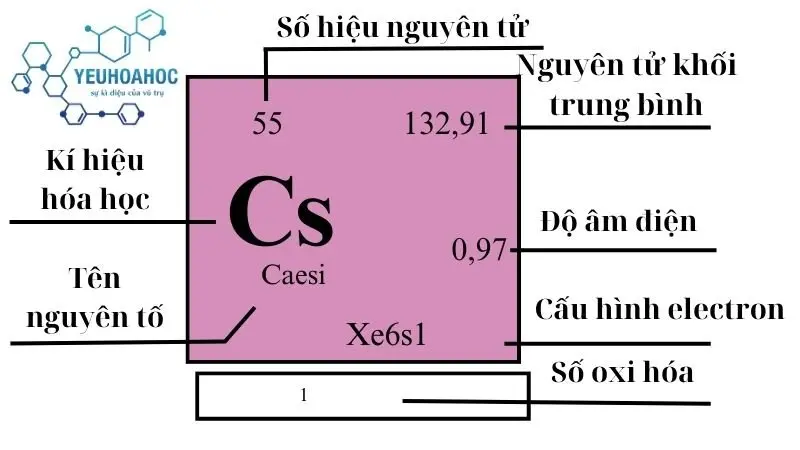
Nguyên tố Caesi (tên tiếng Anh là “Caesium” và kí hiệu hóa học là Cs), với số nguyên tử 55, là một kim loại kiềm mềm, có màu trắng bạc, và nổi bật với tính chất hóa học cực kỳ phản ứng. Nằm ở nhóm 1 của bảng tuần hoàn, Caesi dễ dàng tạo ra hợp chất với hầu hết các nguyên tố, đặc biệt là với nước, tạo ra phản ứng nhiệt động mạnh mẽ.
Lịch sử hình thành nguyên tố Caesi
1860: Robert Bunsen và Gustav Kirchhoff phát hiện ra Caesi bằng phương pháp quang phổ. Họ quan sát thấy hai vạch màu xanh lam sáng trong quang phổ của nước khoáng từ Dürkheim, Đức. Tên nguyên tố được đặt theo tiếng Latinh “caesius”, có nghĩa là “màu xanh da trời”.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1861: Bunsen và Kirchhoff cô lập thành công Caesi ở dạng kim loại.
- 1929: Caesium được sử dụng lần đầu tiên trong các tế bào quang điện.
- 1950: Caesium được sử dụng trong các đồng hồ nguyên tử.
- 1960: Caesium được sử dụng trong các động cơ đẩy ion.
Nguyên tố Caesi trong bảng tuần hoàn hóa học
- Thuộc nhóm 1 (kim loại kiềm)
- Chu kỳ 6
- Khối lượng nguyên tử: 132,905452 u
Trong bảng tuần hoàn, Caesium thuộc nhóm kim loại kiềm, nằm ở chu kỳ 6. Như mọi thành viên khác trong nhóm này, Caesium có một electron ở lớp vỏ ngoài cùng, dễ dàng mất electron này để tạo thành ion dương Cs+. Điều này giải thích tính chất hóa học cực kỳ phản ứng của Caesium.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 1 | 6 | 132,9054519(2) | 1,873 | 301,59 | 944 | 0,242 | 0,79 | 3 |
Tính chất của nguyên tố Caesi
Tính chất vật lý
- Trạng thái: Kim loại mềm, màu trắng bạc
- Điểm nóng chảy: 28 °C (thấp nhất trong số các kim loại kiềm)
- Điểm sôi: 678 °C
- Khối lượng riêng: 1,87 g/cm³
- Độ cứng: Rất mềm (độ cứng Mohs 0,2)
- Tính dẫn điện và dẫn nhiệt: Tốt
Tính chất hóa học
- Tính khử: Rất mạnh, chỉ sau Franci
- Phản ứng với nước: Phản ứng mãnh liệt, tạo ra hydro và hydroxit caesi
- Phản ứng với phi kim: Phản ứng trực tiếp với hầu hết các phi kim (trừ nitơ)
- Tính tan: Tan trong nước và các dung môi hữu cơ
- Hợp chất: CsCl, CsF, CsNO₃, Cs₂SO₄,…
Ứng dụng của nguyên tố Caesi

Đồng hồ nguyên tử
- Caesium được sử dụng trong đồng hồ nguyên tử, là loại đồng hồ chính xác nhất hiện nay.
- Đồng hồ nguyên tử dựa trên sự chuyển đổi năng lượng của nguyên tử Caesium.
- Độ chính xác của đồng hồ nguyên tử được sử dụng để điều chỉnh thời gian trên toàn thế giới.
Máy dò tia X
- Caesium iodide (CsI) được sử dụng trong các máy dò tia X.
- CsI có khả năng hấp thụ tia X và phát ra ánh sáng.
- Ánh sáng này được khuếch đại và chuyển đổi thành tín hiệu điện tử.
Chế tạo động cơ đẩy ion
- Caesium được sử dụng trong động cơ đẩy ion cho tàu vũ trụ.
- Caesium được ion hóa và sau đó được đẩy ra khỏi động cơ bằng điện trường.
- Lực đẩy này giúp tàu vũ trụ di chuyển.
Quang điện tử
- Caesium được sử dụng trong các tế bào quang điện.
- Tế bào quang điện chuyển đổi ánh sáng thành điện năng.
- Caesium có hiệu suất chuyển đổi cao và được sử dụng trong các thiết bị như máy đo quang phổ và camera hồng ngoại.
Hóa học
- Caesium được sử dụng trong một số phản ứng hóa học.
- Ví dụ, Caesium được sử dụng để khử khí trong các ống chân không.
Lưu ý:
- Caesi là kim loại nguy hiểm, cần được bảo quản cẩn thận.
- Khi tiếp xúc với Caesi, cần tuân thủ các biện pháp an toàn
Ngoài ra, Caesium còn có một số ứng dụng khác như:
- Chế tạo pin
- Chế tạo laser
- Y học
Điều chế và sản xuất nguyên tố Caesi
Điều chế trong phòng thí nghiệm
- Phương pháp điện phân:
CsCl nóng chảy được điện phân để tạo ra Cs và Cl₂.
2CsCl → 2Cs + Cl₂
- Phương pháp khử:
CsCl được khử bằng Ca hoặc Mg để tạo ra Cs và CaCl₂ hoặc MgCl₂.
CsCl + Ca → Cs + CaCl₂
CsCl + Mg → Cs + MgCl₂
Điều chế trong công nghiệp
Trong công nghiệp, Caesium và các hợp chất của nó thường được sản xuất từ khoáng vật pollucite, một silicate của caesium và aluminium với hàm lượng caesium cao.
Xử lý Khoáng Vật Pollucite:
- Pollucite được nghiền nhỏ, sau đó xử lý bằng axit sulfuric để tạo ra dung dịch caesium sulfate.
- Dung dịch này sau đó được xử lý để loại bỏ tạp chất và tách ra caesium.
Chuyển đổi thành Caesium Chloride (CsCl):
- Caesium sulfate được chuyển đổi thành caesium chloride, dễ dàng hơn trong việc điều chế caesium kim loại.
Điện Phân:
Caesium chloride được điện phân ở nhiệt độ cao trong một tế bào điện phân chứa Caesium chloride nóng chảy để sản xuất caesium kim loại.
CsCl→Cs+Cl2
Sản Xuất
Sau khi điều chế, caesium kim loại thường được bảo quản trong các chất lỏng không phản ứng như dầu khoáng để ngăn chặn sự phản ứng với hơi nước hoặc oxy trong không khí. Caesium kim loại và các hợp chất của nó có nhiều ứng dụng quan trọng, bao gồm việc sử dụng trong các đồng hồ nguyên tử, dầu khoan, và một số ứng dụng trong nghiên cứu khoa học và y tế.
Phản ứng của nguyên tố Caesi
Phản ứng với nước
Caesi phản ứng mãnh liệt với nước, tạo ra hydro và hydroxit caesi:
2Cs + 2H₂O → 2CsOH + H₂
Phản ứng này tỏa nhiệt mạnh và có thể gây nổ nếu không được kiểm soát cẩn thận.
Phản ứng với phi kim
Caesi phản ứng trực tiếp với hầu hết các phi kim (trừ nitơ) để tạo thành muối:
- Với clo:
2Cs + Cl₂ → 2CsCl
- Với brom:
2Cs + Br₂ → 2CsBr
- Với iốt:
2Cs + I₂ → 2CsI
Phản ứng với axit
Caesi phản ứng với axit để tạo thành muối và hydro:
- Với axit nitric:
Cs + HNO₃ → CsNO₃ + ½H₂
- Với axit sunfuric:
Cs + H₂SO₄ → Cs₂SO₄ + H₂
Phản ứng với dung dịch muối
Caesi có thể khử các cation kim loại khác trong dung dịch muối:
- Với dung dịch CuSO₄:
Cs + CuSO₄ → CsSO₄ + Cu
Phản ứng với oxy
Caesi phản ứng với oxy để tạo thành oxit caesi:
4Cs + O₂ → 2Cs₂O
Lưu ý:
- Caesi là kim loại nguy hiểm, cần được bảo quản cẩn thận.
- Khi tiếp xúc với Caesi, cần tuân thủ các biện pháp an toàn.
Ngoài ra:
- Caesi còn có thể tham gia vào một số phản ứng hóa học khác, tùy thuộc vào điều kiện phản ứng.
- Việc nghiên cứu và ứng dụng các phản ứng của Caesi cần được thực hiện bởi các chuyên gia có trình độ và kinh nghiệm.
Vấn đề an toàn khi sử dụng nguyên tố Caesi

Caesi là kim loại kiềm có tính khử mạnh và hoạt động hóa học cao, do đó nó có thể gây ra một số nguy hiểm cho người sử dụng.
Nguy cơ cháy nổ
Caesi phản ứng mãnh liệt với nước, tạo ra hydro và hydroxit caesi. Phản ứng này tỏa nhiệt mạnh và có thể gây nổ nếu không được kiểm soát cẩn thận. Do đó, cần tránh để Caesi tiếp xúc trực tiếp với nước.
Gây bỏng
Caesi có thể gây bỏng da nghiêm trọng nếu tiếp xúc trực tiếp. Khi tiếp xúc với da, Caesi phản ứng với nước trong da và tạo ra hydroxit caesi, có tính kiềm mạnh. Do đó, cần đeo găng tay và quần áo bảo hộ khi sử dụng Caesi.
Nguy cơ hít phải
Hít phải bụi Caesi có thể gây kích ứng hệ hô hấp. Do đó, cần sử dụng Caesi trong môi trường thông gió tốt và đeo khẩu trang.
Nguy cơ độc hại
Caesi có thể gây độc nếu nuốt phải. Do đó, cần cẩn thận để tránh nuốt phải Caesi.
Nguy cơ cháy nổ do tiếp xúc với phi kim
Caesi phản ứng trực tiếp với hầu hết các phi kim (trừ nitơ) để tạo thành muối. Phản ứng này có thể tỏa nhiệt và có thể gây cháy nổ. Do đó, cần tránh để Caesi tiếp xúc trực tiếp với các phi kim.
Lưu ý:
- Caesi là kim loại nguy hiểm, cần được bảo quản cẩn thận.
- Khi tiếp xúc với Caesi, cần tuân thủ các biện pháp an toàn sau:
- Đeo găng tay và quần áo bảo hộ.
- Sử dụng Caesi trong môi trường thông gió tốt.
- Đeo khẩu trang.
- Tránh để Caesi tiếp xúc trực tiếp với nước, da, mắt và miệng.
- Bảo quản Caesi trong hộp kín, tránh tiếp xúc với không khí và độ ẩm.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Caesi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Caesi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







