Nguyên tố Cacbon: Khái niệm, tính chất và ứng dụng
Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Cacbon, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan
Nguyên tố Cacbon (C) là một trong những nguyên tố quan trọng và phổ biến nhất trên Trái Đất. Với tính chất đặc biệt và ứng dụng đa dạng, cacbon đóng vai trò không thể phủ nhận trong cuộc sống hàng ngày của chúng ta. Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Cacbon, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan.
Giới thiệu về Nguyên Tố Cacbon
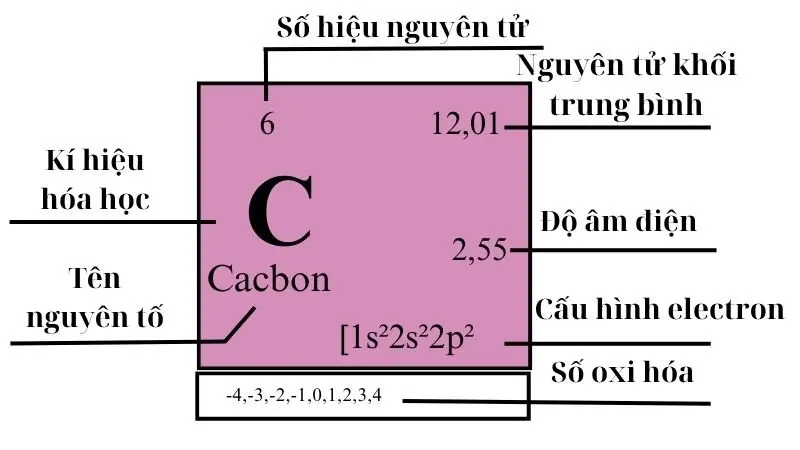
Định nghĩa: Nguyên tố Cacbon là gì ?
Cacbon là một nguyên tố phi kim phổ biến trong bảng tuần hoàn, ký hiệu C, số hiệu nguyên tử 6. Nó là một nguyên tố nhẹ, phi kim loại, có màu đen, là thành phần chính của than chì và kim cương. Cacbon có nhiều dạng thù hình khác nhau, bao gồm than chì, kim cương, fullerene và graphene.
Lịch sử
Cacbon được biết đến từ thời cổ đại. Than chì đã được sử dụng để viết và vẽ từ thời cổ đại.Kim cương được phát hiện vào thế kỷ thứ 4 trước Công nguyên. Tuy nhiên, cacbon không được công nhận là một nguyên tố cho đến thế kỷ 18.
Các mốc quan trọng trong việc hình thành nguyên tố cacbon:
- Vụ nổ Big Bang: Cacbon được hình thành trong vụ nổ Big Bang, khoảng 13,8 tỷ năm trước.
- Hình thành các ngôi sao: Cacbon được tạo ra trong các ngôi sao thông qua quá trình tổng hợp hạt nhân.
- Hình thành hệ mặt trời: Cacbon được đưa vào hệ mặt trời thông qua các sao chổi và thiên thạch.
- Hình thành sự sống: Cacbon là thành phần chính của các phân tử hữu cơ, là cơ sở của sự sống.
Tầm quan trọng
Cacbon có vai trò quan trọng trong:
- Vũ trụ: Cacbon là nguyên tố phổ biến thứ tư trong vũ trụ sau hydro, heli và oxy. Cacbon là thành phần chính của các ngôi sao, hành tinh và sao chổi.
- Đời sống con người: Cacbon là thành phần chính của các phân tử hữu cơ, là cơ sở của sự sống. Cacbon cũng là thành phần chính của các nhiên liệu hóa thạch, chẳng hạn như than đá, dầu mỏ và khí đốt tự nhiên.
- Hóa học: Cacbon là một nguyên tố hóa học quan trọng. Cacbon có thể tạo ra nhiều hợp chất khác nhau, bao gồm các hợp chất hữu cơ và vô cơ.
Nguyên tố cacbon trong bảng tuần hoàn hóa học
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 14 | 2 | 12,0112 4 9 | 2,267 | 3800 | 4300 | 0,709 | 2,55 | 200 |
Tính chất của cacbon
Tính chất vật lý
- Cacbon tồn tại dưới nhiều dạng thù hình khác nhau như kim cương, than chì, fuleren, graphene.
- Là chất rắn, không tan trong nước.
- Có khả năng dẫn điện và nhiệt tốt (trừ kim cương).
Tính chất hóa học
- Cacbon có hóa trị IV.
- Cacbon có khả năng liên kết với nhiều nguyên tố khác để tạo ra vô số hợp chất.
- Cacbon tham gia vào nhiều phản ứng hóa học quan trọng như:
- Phản ứng cháy: Cacbon phản ứng với oxy để tạo ra cacbon dioxide (CO2).
- Phản ứng thế: Cacbon có thể thay thế hydro trong một số hợp chất.
- Phản ứng cộng: Cacbon có thể cộng với một số nguyên tố khác như hydro, halogen.
Dưới đây là một số ví dụ về tính chất hóa học của cacbon:
- Phản ứng cháy:
C + O2 → CO2
- Phản ứng thế:
C + H2O → CO + H2
- Phản ứng cộng:
C + 2Cl2 → CCl4
Hợp chất của cacbon
Cacbon có thể tạo ra nhiều hợp chất khác nhau, bao gồm:
Hợp chất vô cơ
- Cacbon dioxide (CO2): Là một khí không màu, không mùi, tan ít trong nước. CO2 là một khí nhà kính quan trọng.
Cacbon monoxide (CO): Là một khí không màu, không mùi, độc. CO là một chất khử mạnh.
- Axit cacbonic (H2CO3): Là một axit yếu, không bền. H2CO3 phân hủy thành CO2 và H2O.
- Muối cacbonat: Là các muối của axit cacbonic. Muối cacbonat thường tan trong nước.
Hợp chất hữu cơ
- Hidrocacbon: Là các hợp chất chỉ chứa cacbon và hydro. Hidrocacbon được chia thành nhiều loại khác nhau, bao gồm ankan, anken, ankin, ankadien, aren.
- Dẫn xuất hidrocacbon: Là các hợp chất được tạo ra từ hidrocacbon bằng cách thay thế một hoặc nhiều nguyên tử hydro bằng các nguyên tố hoặc nhóm nguyên tử khác. Dẫn xuất hidrocacbon bao gồm rượu, ancol, axit, este, ete, amin, amit.
- Polime: Là các hợp chất có phân tử khối lớn được tạo ra từ nhiều phân tử nhỏ (monome) liên kết với nhau. Polime bao gồm nhựa, cao su, tơ.
Ứng dụng của cacbon
Cacbon là một nguyên tố có nhiều ứng dụng quan trọng trong đời sống con người. Dưới đây là một số ứng dụng của cacbon:
Nhiên liệu
Than đá: Là một nhiên liệu hóa thạch được sử dụng để sản xuất điện và nhiệt
Than chì: Là một dạng thù hình của cacbon được sử dụng làm điện cực trong pin và bút chì.
Dầu mỏ: Là một nhiên liệu hóa thạch được sử dụng để vận chuyển và sản xuất các sản phẩm hóa chất.
Khí đốt tự nhiên: Là một nhiên liệu hóa thạch được sử dụng để sưởi ấm và nấu ăn.
Vật liệu
- Kim cương: Là dạng thù hình cứng nhất của cacbon được sử dụng làm đồ trang sức và dụng cụ cắt.
- Than chì: Là một dạng thù hình của cacbon được sử dụng làm điện cực trong pin và bút chì.
- Graphene: Là một dạng thù hình mới của cacbon có nhiều ứng dụng tiềm năng trong điện tử, vật liệu tổng hợp và y học.
- Fullerene: Là một dạng thù hình mới của cacbon có nhiều ứng dụng tiềm năng trong y học và khoa học vật liệu.
Hóa chất
- Dung môi: Cacbon được sử dụng để sản xuất nhiều loại dung môi khác nhau, chẳng hạn như axeton và benzen.
- Axit: Cacbon được sử dụng để sản xuất nhiều loại axit khác nhau, chẳng hạn như axit nitric và axit sulfuric.
- Bazơ: Cacbon được sử dụng để sản xuất nhiều loại bazơ khác nhau, chẳng hạn như natri hydroxit và kali hydroxit.
- Muối: Cacbon được sử dụng để sản xuất nhiều loại muối khác nhau, chẳng hạn như natri clorua và kali clorua.
Y học
- Thuốc: Cacbon được sử dụng để sản xuất nhiều loại thuốc khác nhau, chẳng hạn như aspirin và ibuprofen.
- Dụng cụ y tế: Cacbon được sử dụng để sản xuất nhiều loại dụng cụ y tế khác nhau, chẳng hạn như van tim và khớp nhân tạo.
Vòng tuần hoàn cacbon
Vòng tuần hoàn cacbon là một quá trình sinh địa hóa, trong đó cacbon được trao đổi giữa các thành phần khác nhau của Trái đất, bao gồm:
- Khí quyển: Cacbon dioxide (CO2) là dạng cacbon phổ biến nhất trong khí quyển.
- Sinh quyển: Cacbon được lưu trữ trong các sinh vật sống như thực vật và động vật.
- Thạch quyển: Cacbon được lưu trữ trong các dạng hóa thạch như than đá, dầu mỏ và khí đốt tự nhiên.
- Thủy quyển: Cacbon được lưu trữ trong nước biển và các nguồn nước khác.
Cacbon di chuyển qua các thành phần khác nhau của Trái đất thông qua các quá trình khác nhau, bao gồm:
- Quang hợp: Thực vật sử dụng CO2 từ khí quyển để tạo ra thức ăn.
- Hô hấp: Sinh vật sống thải ra CO2 vào khí quyển khi chúng hô hấp.
- Phân hủy: Khi sinh vật sống chết đi, cacbon trong cơ thể chúng được trả lại cho đất và nước.
- Nung nóng nhiên liệu hóa thạch: Khi con người nung nóng nhiên liệu hóa thạch, cacbon được lưu trữ trong các nhiên liệu này được giải phóng vào khí quyển.
Hoạt động của con người ảnh hưởng đến vòng tuần hoàn cacbon:
Hoạt động của con người, chẳng hạn như đốt nhiên liệu hóa thạch và phá rừng, đã làm tăng lượng CO2 trong khí quyển. Điều này góp phần vào biến đổi khí hậu, một vấn đề môi trường nghiêm trọng.
Dưới đây là một số cách mà hoạt động của con người ảnh hưởng đến vòng tuần hoàn cacbon:
- Đốt nhiên liệu hóa thạch: Khi con người đốt nhiên liệu hóa thạch, cacbon được lưu trữ trong các nhiên liệu này được giải phóng vào khí quyển.
- Phá rừng: Rừng đóng vai trò quan trọng trong việc hấp thụ CO2 từ khí quyển. Khi con người phá rừng, lượng CO2 trong khí quyển sẽ tăng lên.
- Nông nghiệp: Các hoạt động nông nghiệp, chẳng hạn như sử dụng phân bón hóa học và chăn nuôi gia súc, cũng góp phần vào việc tăng lượng CO2 trong khí quyển.
Để giảm thiểu tác động của con người đến vòng tuần hoàn cacbon, chúng ta cần:
- Giảm thiểu việc sử dụng nhiên liệu hóa thạch: Chúng ta có thể sử dụng các nguồn năng lượng tái tạo như năng lượng mặt trời và năng lượng gió thay cho nhiên liệu hóa thạch.
- Trồng cây: Cây cối giúp hấp thụ CO2 từ khí quyển. Chúng ta có thể trồng cây để giúp giảm lượng CO2 trong khí quyển.
- Thay đổi chế độ ăn uống: Chúng ta có thể giảm lượng thịt tiêu thụ và ăn nhiều thực vật hơn. Điều này sẽ giúp giảm lượng khí thải nhà kính từ hoạt động nông nghiệp.
Điều chế và sản xuất nguyên tố Cacbon
Cacbon có thể được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào dạng thù hình mong muốn:
- Than chì
- Nung than đá trong điều kiện thiếu không khí: Đây là phương pháp phổ biến nhất để sản xuất than chì.
- Phân hủy khí metan (CH4) ở nhiệt độ cao: Phương pháp này tạo ra than chì có độ tinh khiết cao.
- Kim cương
- Tổng hợp từ than chì dưới áp suất và nhiệt độ cao: Đây là phương pháp phổ biến nhất để sản xuất kim cương nhân tạo.
- Cấy kim cương từ một hạt giống kim cương nhỏ: Phương pháp này tạo ra kim cương có chất lượng cao hơn.
- Graphene
- Bóc tách graphene từ than chì: Phương pháp này sử dụng băng dính để tách các lớp graphene khỏi than chì.
- Tổng hợp graphene từ khí metan (CH4): Phương pháp này tạo ra graphene có độ tinh khiết cao.
- Fullerene
- Đốt cháy hydrocarbon trong điều kiện thiếu oxy: Phương pháp này tạo ra fullerene với nhiều kích thước và cấu trúc khác nhau.
- Tổng hợp fullerene từ khí carbon monoxide (CO): Phương pháp này tạo ra fullerene với cấu trúc cụ thể.
Sản xuất nguyên tố Cacbon:
Cacbon không được sản xuất trực tiếp mà được khai thác từ các nguồn tự nhiên như:
- Than đá: Là một dạng cacbon vô định hình, được sử dụng làm nhiên liệu và nguyên liệu cho nhiều ngành công nghiệp.
- Dầu mỏ: Là một hỗn hợp các hydrocacbon, được sử dụng làm nhiên liệu và nguyên liệu cho nhiều ngành công nghiệp.
- Khí đốt tự nhiên: Là một hỗn hợp các khí, chủ yếu là metan (CH4), được sử dụng làm nhiên liệu.
Phương trình Phản ứng của nguyên tố Cacbon
Cacbon là một nguyên tố hóa học có nhiều dạng thù hình khác nhau, bao gồm than chì, kim cương, graphene và fullerene. Cacbon có thể tham gia vào nhiều phản ứng hóa học khác nhau, tùy thuộc vào dạng thù hình và điều kiện phản ứng.
Dưới đây là một số phương trình phản ứng hóa học của nguyên tố cacbon:
Phản ứng cháy
- Cacbon cháy trong khí oxi:
C + O2 → CO2
- Cacbon cháy trong không khí:
C + O2 → CO2 + N2
Phản ứng khử
- Cacbon khử oxit kim loại:
C + MO → M + CO
- Cacbon khử axit nitric:
C + 4HNO3 → CO2 + 4NO2 + 2H2O
Phản ứng cộng
- Cacbon cộng với hydro:
C + 2H2 → CH4
- Cacbon cộng với clo:
C + Cl2 → CCl4
Phản ứng thế
- Cacbon thế hydro trong axit:
C + 2HCl → CH2Cl2 + H2
- Cacbon thế kim loại trong muối:
C + 2AgNO3 → Ag2C + 2HNO3
Tồn tại và khai thác nguyên tố Cacbon
Tồn tại
Mặt Trời, sao chổi, các ngôi sao và bầu khí quyển của phần lớn các hành tinh.
Trái Đất: Cacbon chiếm khoảng 0,18% khối lượng vỏ Trái Đất. Nó có mặt trong nhiều dạng khác nhau, bao gồm:
- Vô cơ: Than đá, dầu mỏ, khí đốt tự nhiên, đá vôi, dolomit.
- Hữu cơ: Sinh vật sống, nhiên liệu sinh học.
Khai thác

Cacbon được khai thác từ các nguồn tự nhiên sau:
- Than đá: Được khai thác bằng phương pháp hầm lò hoặc lộ thiên.
- Dầu mỏ: Được khai thác bằng phương pháp khoan giếng.
- Khí đốt tự nhiên: Được khai thác cùng với dầu mỏ hoặc từ các mỏ khí đốt riêng biệt.
- Sinh vật sống: Rừng, tảo, vi sinh vật.
Phương pháp khai thác
Phương pháp khai thác cacbon phụ thuộc vào nguồn và mục đích sử dụng.
- Than đá: Khai thác bằng phương pháp hầm lò hoặc lộ thiên.
- Dầu mỏ: Khai thác bằng phương pháp khoan giếng.
- Khí đốt tự nhiên: Khai thác cùng với dầu mỏ hoặc từ các mỏ khí đốt riêng biệt.
- Sinh vật sống: Thu hoạch hoặc nuôi trồng.
Tác động môi trường
Khai thác cacbon có thể gây ra một số tác động môi trường tiêu cực, bao gồm:
- Ô nhiễm không khí: Khí thải từ khai thác và sử dụng cacbon có thể gây ô nhiễm không khí.
- Ô nhiễm nước: Nước thải từ khai thác cacbon có thể gây ô nhiễm nước.
- Biến đổi khí hậu: Sử dụng cacbon làm nhiên liệu thải ra khí nhà kính, góp phần vào biến đổi khí hậu.
Giải pháp
Để giảm thiểu tác động môi trường của việc khai thác và sử dụng cacbon, cần thực hiện các giải pháp sau:
- Sử dụng năng lượng tái tạo: Thay thế nhiên liệu hóa thạch bằng năng lượng tái tạo như năng lượng mặt trời và năng lượng gió.
- Tăng cường sử dụng phương tiện giao thông công cộng: Giảm thiểu sử dụng phương tiện giao thông cá nhân chạy bằng nhiên liệu hóa thạch.
- Trồng cây: Cây cối giúp hấp thụ CO2 từ khí quyển.
Vấn đề an toàn khi sử dụng nguyên tố Cacbon
Tiềm ẩn nguy hiểm với Cacbon Đen
- Cacbon đen, hoặc bụi than, có thể gây ra nguy hại khi hít phải. Sự tiếp xúc kéo dài với bụi cacbon đen có thể gây ra các vấn đề về hô hấp và có thể dẫn đến các vấn đề sức khỏe nghiêm trọng như viêm phổi và bệnh phổi đen.
Nguy cơ nổ khi làm việc với các hợp chất Cacbon
- Các hợp chất cacbon có thể có tính chất dễ cháy hoặc có thể tạo ra hơi hoặc khí nguy hiểm khi bị phân hủy. Việc làm việc với các hợp chất carbon đòi hỏi sự cẩn trọng đặc biệt để tránh nguy cơ nổ và cháy.
Độc tính của các hợp chất Cacbon
- Một số hợp chất cacbon có thể có tính chất độc hại và có thể gây ra nguy hiểm khi tiếp xúc với da hoặc khi hít phải. Việc sử dụng các hợp chất cacbon cần được thực hiện trong môi trường có thông gió tốt và sử dụng các biện pháp bảo vệ cá nhân phù hợp.
Nguy cơ về sự rò rỉ khí độc
- Trong quá trình sản xuất và sử dụng các hợp chất cacbon, có nguy cơ về sự rò rỉ khí độc như CO2 hoặc CO, đặc biệt là trong môi trường làm việc kín đáo hoặc thiếu thông gió.
Biện pháp an toàn
- Đảm bảo tuân thủ các quy tắc an toàn lao động và sử dụng các biện pháp bảo vệ cá nhân như đeo khẩu trang, kính bảo hộ và găng tay khi tiếp xúc với các hợp chất cacbon.
- Thực hiện kiểm tra và bảo dưỡng định kỳ các thiết bị và hệ thống làm việc để đảm bảo an toàn trong quá trình sử dụng và xử lý cacbon.
Dưới đây là tất cả những kiến thức cơ bản về nguyên tố Cacbon mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Cacbon. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







