Brom: Nguyên tố hóa học quan trọng và ứng dụng thực tiễn
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Brom, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
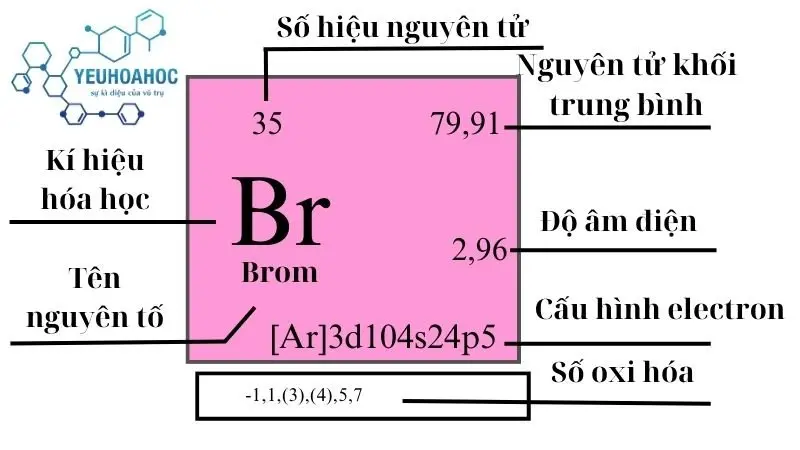
Brom là một nguyên tố hóa học đặc biệt với biểu tượng Br và số nguyên tử 35. Thuộc nhóm halogen, Brom nổi bật với tính chất hóa học đa dạng và ứng dụng rộng rãi trong nhiều lĩnh vực từ y học đến công nghiệp. Khám phá thêm về Brom và vai trò không thể thiếu của nó trong cuộc sống hàng ngày. Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Brom, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Brom
Nguyên tố Brom
Định nghĩa
Brom, được biết đến trong tiếng Anh là “Bromine”, và có ký hiệu hóa học là Br, là nguyên tố hóa học với số nguyên tử 35. Nổi bật với màu đỏ nâu và ở dạng lỏng ở nhiệt độ phòng, Bromine là một trong số ít các nguyên tố không ở dạng rắn hoặc khí trong điều kiện tiêu chuẩn.
Lịch sử hình thành nguyên tố Brom
- 1825: Antoine-Jérôme Balard, một nhà hóa học người Pháp, đã phát hiện ra Brom bằng cách cho khí clo tác dụng với nước muối.
- 1826: Balard đặt tên cho nguyên tố mới này là “Brôme”, từ tiếng Hy Lạp “bromos” có nghĩa là “hôi”, do mùi hắc của nó.
Một số mốc thời gian quan trọng trong lịch sử phát hiện nguyên tố Brom:
- 1826: Balard công bố việc phát hiện ra Brom.
- 1840: Brom bắt đầu được sử dụng trong nhiếp ảnh.
- 1900: Brom được sử dụng để sản xuất các chất chống cháy.
- 1930: Brom được sử dụng để sản xuất xăng có chì.
- 1970: Việc sử dụng Brom trong xăng có chì bị cấm do tác hại của nó đối với môi trường.
Tầm quan trọng của nguyên tố Brom trong đời sống
Brom được sử dụng trong nhiều ứng dụng khác nhau, bao gồm:
- Nước khử trùng: Brom được sử dụng để khử trùng nước bể bơi và spa.
- Chất chống cháy: Brom được sử dụng trong các chất chống cháy để ngăn chặn sự lan truyền của hỏa hoạn.
- Hóa chất dệt: Brom được sử dụng trong sản xuất thuốc nhuộm và các hóa chất dệt khác.
- Dược phẩm: Brom được sử dụng trong sản xuất một số loại thuốc.
- Nông nghiệp: Brom được sử dụng làm thuốc trừ sâu.
Nguyên tố Brom trong bảng tuần hoàn hóa học
- Nhóm: Brom thuộc nhóm 17, còn được gọi là nhóm halogen. Các nguyên tố trong nhóm này có 7 electron hóa trị và có tính phản ứng cao.
- Chu kỳ: Brom thuộc chu kỳ 4. Các nguyên tố thuộc cùng một chu kỳ trên bảng tuần hoàn đều sở hữu số lớp electron giống nhau.
- Ô: Brom nằm ở ô 35 trong bảng tuần hoàn.
- Cấu hình electron: [Ar] 3d10 4s2 4p5
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 17 | 4 | 79,9049 | 3,122 | 265,8 | 332,0 | 0,474 | 2,96 | 2,4 |
Tính chất của nguyên tố Brom (Br)
Tính chất vật lý
- Trạng thái: Dạng lỏng màu nâu đỏ ở nhiệt độ phòng.
- Mùi: Mùi hắc, khó chịu.
- Tỷ khối: 3,12 g/cm³.
- Nhiệt độ nóng chảy: -7,25 °C.
- Nhiệt độ sôi: 58,78 °C.
- Độ tan: Tan ít trong nước, tan nhiều trong các dung môi hữu cơ như etanol, ete, benzen.
- Khả năng bay hơi: Dễ bay hơi ở nhiệt độ phòng.
- Tính dẫn điện: Không dẫn điện.
Tính chất hóa học
- Tính oxi hóa: Brom là chất oxi hóa mạnh, nhưng yếu hơn clo.
- Tác dụng với kim loại: Brom tác dụng trực tiếp với nhiều kim loại và các phản ứng này đều tỏa ra một lượng nhiệt lớn. Ví dụ:
Mg + Br2 → MgBr2
2Al + 3Br2 → 2AlBr3
- Tác dụng với hidro: Brom tác dụng với hidro ở nhiệt độ cao và tạo ra bromua hydro (HBr). Khi HBr được hòa tan vào nước, nó hình thành một dung dịch axit được gọi là axit bromhidric.
H2 + Br2 → 2HBr
- Tác dụng với dung dịch kiềm: Brom tác dụng với dung dịch kiềm tạo ra muối bromua và hipobromit.
Br2 + 2NaOH → NaBr + NaOBr + H2O
- Tác dụng với dung dịch axit: Brom tác dụng với dung dịch axit khử tạo ra muối bromua và axit tương ứng.
Br2 + SO2 + 2H2O → 2HBr + H2SO4
- Tác dụng với chất hữu cơ: Brom có thể tham gia phản ứng cộng vào với các liên kết đôi C=C trong các chất hữu cơ.
Ứng dụng của nguyên tố Brom
Brom được sử dụng trong nhiều ứng dụng khác nhau, bao gồm:
Khử trùng
- Brom là một chất khử trùng hiệu quả và được sử dụng để khử trùng nước bể bơi, spa và các khu vực khác.
- Brom cũng được sử dụng để khử trùng các dụng cụ y tế và thiết bị.
Chất chống cháy
- Brom là một chất chống cháy hiệu quả và được sử dụng trong nhiều loại vật liệu khác nhau, bao gồm nhựa, dệt may và đồ nội thất.
- Brom giúp ngăn chặn sự lan truyền của hỏa hoạn và bảo vệ người và tài sản.
Hóa chất dệt
- Brom được sử dụng trong sản xuất thuốc nhuộm và các hóa chất dệt khác.
- Brom giúp cải thiện độ bền màu và độ bền của vải.
Dược phẩm
- Brom được sử dụng trong sản xuất một số loại thuốc, bao gồm thuốc an thần và thuốc giảm đau.
- Brom cũng được sử dụng trong một số loại thuốc X-quang.
Nông nghiệp
- Brom được sử dụng làm thuốc trừ sâu để kiểm soát sâu bệnh trên cây trồng.
- Brom cũng được sử dụng để khử trùng đất và ngăn ngừa nấm bệnh.
Ngoài ra, Brom còn được sử dụng trong một số ứng dụng khác, bao gồm:
- Sản xuất cao su
- Sản xuất pin
- Sản xuất kính
- Khử trùng nước thải
Điều chế và sản xuất nguyên tố Brom
Điều chế
Điều chế trong phòng thí nghiệm

Điều chế Brom trong phòng thí nghiệm
- Phương pháp 1: Cho dung dịch axit sulfuric đặc tác dụng với kali bromua:
2KBr + H2SO4 → 2KHSO4 + Br2↑
- Phương pháp 2: Cho dung dịch axit clohydric đặc tác dụng với kali bromua:
2KBr + 2HCl → 2KCl + Br2↑
Điều chế trong công nghiệp
- Brom được sản xuất trong công nghiệp bằng cách điện phân nước muối.
- Quá trình điện phân được thực hiện trong một bể điện phân chứa nước muối.
- Brom được tạo ra ở anot và hydro được tạo ra ở catot.
Phương trình điều chế:
2NaCl + 2H2O → 2Na+ + 2Cl- + 2H2↑ + Cl2↑
Cl2 + 2Br- → Br2↑ + 2Cl-
Sản xuất
- Brom được sản xuất trên quy mô lớn để sử dụng trong nhiều ứng dụng khác nhau.
- Các nhà sản xuất brom lớn nhất trên thế giới bao gồm:
- Albemarle Corporation (Hoa Kỳ)
- ICL Israel Chemicals (Israel)
- Tosoh Corporation (Nhật Bản)
Quy trình sản xuất brom:
- Nước muối được khai thác từ các mỏ muối hoặc từ nước biển.
- Nước muối được xử lý để loại bỏ các tạp chất.
- Nước muối được điện phân để tạo ra brom và hydro.
- Brom được thu gom và tinh chế.
- Brom được đóng gói và vận chuyển đến khách hàng.
Phản ứng của nguyên tố Brom

Phản ứng của nguyên tố Brom
Phản ứng với kim loại
- Brom có thể phản ứng trực tiếp với hầu hết các kim loại để tạo thành muối bromua. Ví dụ:
2Na + Br2 → 2NaBr
Mg + Br2 → MgBr2
Phản ứng với hydro
- Brom có thể phản ứng với hydro khi đun nóng để tạo thành hydro bromua (HBr).
H2 + Br2 → 2HBr
Phản ứng với dung dịch kiềm
- Brom có thể phản ứng với dung dịch kiềm để tạo thành muối bromua và hypobromit. Ví dụ:
Br2 + 2NaOH → NaBr + NaOBr + H2O
Phản ứng với các hợp chất hữu cơ
- Brom có thể tham gia vào nhiều loại phản ứng với các hợp chất hữu cơ, bao gồm phản ứng cộng, phản ứng thế và phản ứng oxy hóa khử. Ví dụ:
- Phản ứng cộng:
Br2 + C2H4 → C2H4Br2
- Phản ứng thế:
CH4 + Br2 → CH3Br + HBr
- Phản ứng oxy hóa khử:
C6H6 + 3Br2 → C6H6Br6
Phản ứng với nước
- Brom có thể phản ứng với nước một cách chậm chạp để tạo thành axit hypobromous (HBrO):
Br2 + H2O ⇌ HBrO + HBr
Tồn tại và khai thác nguyên tố Brom
Tồn tại
- Brom là một nguyên tố tương đối phổ biến trong vỏ Trái đất, với hàm lượng khoảng 260 ppm.
- Brom chủ yếu tồn tại dưới dạng muối bromua trong nước biển và các mỏ muối.
- Brom cũng được tìm thấy trong một số khoáng chất, chẳng hạn như carnallit và bromit.
Khai thác
- Brom được khai thác chủ yếu từ nước biển bằng cách điện phân.
- Quá trình điện phân được thực hiện trong một bể điện phân chứa nước muối.
- Brom được tạo ra ở anot và hydro được tạo ra ở catot.
Phương trình khai thác:
2NaCl + 2H2O → 2Na+ + 2Cl- + 2H2↑ + Cl2↑
Cl2 + 2Br- → Br2↑ + 2Cl-
- Brom được thu gom và tinh chế.
- Brom được đóng gói và vận chuyển đến khách hàng.
Vấn đề an toàn khi sử dụng nguyên tố Brom:
- Brom là một chất độc hại và có thể gây kích ứng da, mắt và hệ hô hấp.
- Các triệu chứng ngộ độc Brom bao gồm: ho, khó thở, đau ngực, buồn nôn, nôn mửa và tiêu chảy.
- Tiếp xúc lâu dài với Brom có thể dẫn đến tổn thương phổi, gan và thận.
Lưu ý:
- Cần phải cẩn thận khi sử dụng Brom và nên tuân thủ các biện pháp an toàn sau:
- Mang găng tay, kính bảo hộ và quần áo bảo hộ khi sử dụng Brom.
- Làm việc trong khu vực thông gió tốt.
- Tránh tiếp xúc trực tiếp với Brom.
- Nếu bị dính Brom, hãy rửa sạch immediately với nước và xà phòng.
- Nếu bị ngộ độc Brom, hãy liên hệ với bác sĩ ngay lập tức.
Chất lượng và phương thức cung cấp nguyên tố Brom (Br)
Chất lượng Brom
Độ tinh khiết
- Chất lượng Bromine được xác định bởi độ tinh khiết của nó. Bromine thương mại thường có độ tinh khiết từ 99% đến 99.9% tùy thuộc vào ứng dụng. Đối với các ứng dụng đặc biệt như trong dược phẩm hoặc bán dẫn, Bromine có thể cần độ tinh khiết cao hơn.
Kiểm soát tạp chất
- Các tạp chất trong Bromine có thể ảnh hưởng đến hiệu suất ứng dụng của nó. Việc kiểm soát và giảm thiểu tạp chất như nước, các ion kim loại, và các hợp chất hữu cơ là rất quan trọng.
- Brom có thể tồn tại ở dạng lỏng màu nâu đỏ.
- Chất lượng Brom được đánh giá dựa trên hàm lượng Br và tạp chất.
- Brom thương mại thường có độ tinh khiết cao, trên 99%.
Phương thức cung cấp Brom
- Brom được cung cấp bởi các nhà sản xuất hóa chất và khoáng sản.
- Các dạng cung cấp phổ biến:
- Dạng lỏng: Đóng gói trong bình hoặc can.
- Dạng dung dịch: Dung dịch Brom trong nước hoặc các dung môi khác.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Brom mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Brom. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







