Nguyên tố Bari: Đặc tính, lịch sử phát hiện và ứng dụng
Bài viết này yeuhoahoc.edu.vn sẽ cùng các bạn khám phá sâu hơn về nguyên tố Bari, từ đặc tính hóa học, lịch sử phát hiện, đến những ứng dụng.
Bari, là một kim loại kiềm thổ nặng, có vai trò quan trọng trong nhiều ngành công nghiệp từ sản xuất cao su đến y tế. Được biết đến với khả năng tạo ra màu xanh lá cây rực rỡ trong pháo hoa, Bari còn có ứng dụng rộng rãi trong việc chẩn đoán y tế và sản xuất kính. Bài viết này yeuhoahoc.edu.vn sẽ cùnga các bạn khám phá sâu hơn về Bari, từ đặc tính hóa học, lịch sử phát hiện, đến những ứng dụng và tác động của nó đến cuộc sống hàng ngày.
Giới thiệu về nguyên tố Bari
Định nghĩa
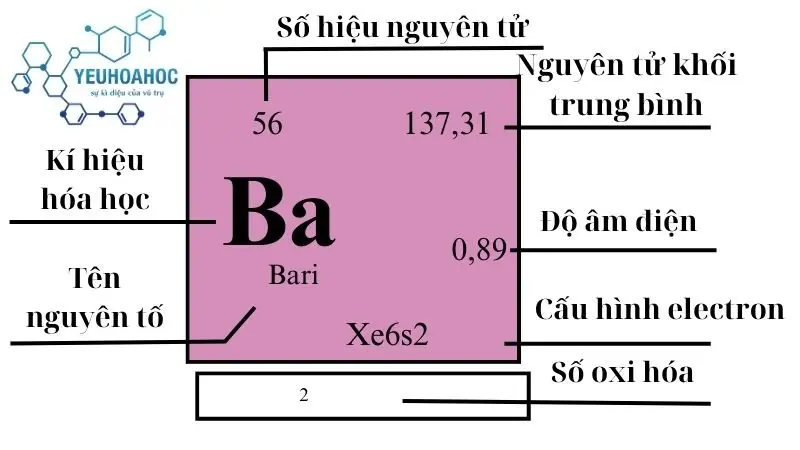
Nguyên tố Bari, với tên tiếng Anh là “Barium” và kí hiệu hóa học là Ba, là một nguyên tố hóa học với số nguyên tử 56. Bari là một kim loại kiềm thổ mềm, có màu trắng bạc, và rất phản ứng với không khí cũng như nước, tạo ra hydroxide bari và hydro.
Lịch sử hình thành nguyên tố Bari
Bari được phát hiện dưới dạng hợp chất sulfat (đá cẩm thạch nặng) trước khi được nhà hóa học người Anh Sir Humphry Davy tách biệt dưới dạng nguyên tố kim loại vào năm 1808 qua phương pháp điện phân.
Mốc thời gian quan trọng:
- 1774: Carl Wilhelm Scheele phát hiện ra baryta (BaO) trong khoáng vật barit.
- 1808: Sir Humphry Davy điện phân baryta nóng chảy để thu được kim loại bari.
- 1875: Robert Bunsen và Gustav Kirchhoff sử dụng bari trong quang phổ để phát hiện các nguyên tố khác.
Nguyên tố Bari trong bảng tuần hoàn các nguyên tố hóa học
- Thuộc nhóm 2 (IIA) – Kim loại kiềm thổ
- Nằm ở chu kỳ 6
- Có 7 đồng vị bền
- Khối lượng nguyên tử: 137,327 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 2 | 6 | 137,327(7) | 3,594 | 1000 | 2170 | 0,204 | 0,89 | 425 |
Tính chất của nguyên tố Bari
Tính chất vật lý:
- Trạng thái: Kim loại mềm, màu trắng bạc, có ánh kim
- Khối lượng riêng: 3,51 g/cm³
- Điểm nóng chảy: 727 °C
- Điểm sôi: 1640 °C
- Tính dẫn điện, dẫn nhiệt: Tốt
- Dẻo, dễ dát mỏng, dễ kéo sợi
- Bị oxy hóa nhanh trong không khí
- Phản ứng mãnh liệt với nước
Tính chất hóa học:
- Tính khử: Mạnh
- Điện hóa: +2
- Tác dụng với nước:
Ba + 2H2O → Ba(OH)2 + H2
- Tác dụng với axit:
Ba + 2HCl → BaCl2 + H2
- Tác dụng với dung dịch muối:
BaSO4↓ + Na2SO4
- Tác dụng với phi kim:
Ba + S → BaS
- Hợp chất:
- Oxit: BaO
- Hydroxit: Ba(OH)2
- Clorua: BaCl2
- Sulfat: BaSO4
- Cacbonat: BaCO3
Lưu ý:
- Bari là kim loại độc hại, cần cẩn thận khi sử dụng.
- Bari phản ứng mãnh liệt với nước, nên bảo quản bari trong môi trường khan.
Ứng dụng của nguyên tố Bari
Y tế
- Chụp X-quang: Bari sulfat (BaSO4) được sử dụng làm thuốc cản quang trong chụp X-quang hệ tiêu hóa. Chất này không tan trong nước và có khả năng hấp thụ tia X, giúp bác sĩ dễ dàng quan sát các cơ quan trong hệ tiêu hóa.
- Điều trị bệnh tim: Bari có thể được sử dụng để điều trị một số bệnh tim, chẳng hạn như nhịp tim chậm.
Công nghiệp
- Chế tạo hợp kim: Bari được sử dụng để chế tạo hợp kim với các kim loại khác, ví dụ như hợp kim Ba-Ni dùng làm điện cực pin. Hợp kim bari có độ bền cao, chịu được nhiệt độ cao và chống ăn mòn tốt.
- Sản xuất pháo hoa: Bari tạo ra màu xanh lá cây trong pháo hoa.
- Chất phụ gia trong sơn và cao su: Bari tăng độ bền và độ cứng cho sơn và cao su.
- Khoan giếng dầu: Bari sulfat được sử dụng làm chất phụ gia trong dung dịch khoan giếng dầu để giúp giảm ma sát và bôi trơn mũi khoan.
Lĩnh vực khác
- Sản xuất thủy tinh: Bari được sử dụng để sản xuất một số loại thủy tinh đặc biệt, có độ bền cao và chiết suất cao.
- Xử lý nước thải: Bari có thể được sử dụng để xử lý nước thải, loại bỏ các kim loại nặng và các chất ô nhiễm khác.
Ngoài ra, Bari còn có một số ứng dụng khác như:
- Sản xuất bóng đèn huỳnh quang: Bari được sử dụng để làm lớp phủ bên trong bóng đèn huỳnh quang, giúp tăng hiệu quả phát sáng.
- Sản xuất sứ: Bari được sử dụng để làm một số loại sứ đặc biệt, có độ bền cao và chịu nhiệt tốt.
- Sản xuất thuốc diệt chuột: Bari cacbonat (BaCO3) được sử dụng làm thuốc diệt chuột.
Điều chế và sản xuất nguyên tố Bari
Điều chế nguyên tố Bari
Điều chế trong phòng thí nghiệm
- Phương pháp điện phân:
Phương pháp này sử dụng dòng điện để phân hủy bari clorua (BaCl2) nóng chảy, thu được kim loại bari và khí clo.
Phương trình phản ứng:
BaCl2 (nóng chảy) → Ba + Cl2
- Phương pháp khử:
Phương pháp này sử dụng kim loại mạnh như nhôm để khử bari oxit (BaO) ở nhiệt độ cao, thu được kim loại bari và nhôm oxit.
Phương trình phản ứng:
3BaO + 2Al → 3Ba + Al2O3
Điều chế trong công nghiệp
- Phương pháp điện phân:
Đây là phương pháp chính để sản xuất bari trong công nghiệp. Phương pháp này tương tự như phương pháp điện phân trong phòng thí nghiệm, nhưng được thực hiện ở quy mô lớn hơn.
Phương trình phản ứng:
BaCl2 (nóng chảy) → Ba + Cl2
Sản xuất nguyên tố Bari
- Bari được sản xuất thương mại bằng phương pháp điện phân bari clorua (BaCl2) nóng chảy.
- Quá trình này được thực hiện trong lò điện chứa chất bari clorua nóng chảy.
- Khi điện phân bari clorua, quá trình sẽ tạo ra bari dưới dạng kim loại và phát sinh khí clo.
- Bari kim loại được thu thập ở đáy lò điện.
- Khí clo được thu gom và sử dụng để sản xuất các sản phẩm khác.
Phản ứng của nguyên tố Bari
Phản ứng với nước

Bari phản ứng mãnh liệt với nước, tạo thành bari hydroxit (Ba(OH)2) và khí hydro (H2).
Phương trình phản ứng:
Ba + 2H2O → Ba(OH)2 + H2
Phản ứng với axit
Bari phản ứng với axit để tạo thành muối bari và khí hydro (H2).
Ví dụ:
- Bari tác dụng với axit clohydric (HCl):
Ba + 2HCl → BaCl2 + H2
- Bari tác dụng với axit sulfuric (H2SO4):
Ba + H2SO4 → BaSO4 + H2
Phản ứng với dung dịch muối
Bari có thể phản ứng với dung dịch muối của một số kim loại khác để tạo thành kết tủa.
Ví dụ:
- Bari phản ứng với dung dịch natri sulfat (Na2SO4)::
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
- Bari tác dụng với dung dịch kali cromat (K2CrO4):
BaCl2 + K2CrO4 → BaCrO4↓ + 2KCl
Phản ứng với phi kim
Bari có thể phản ứng với một số phi kim, ví dụ như oxy, lưu huỳnh, halogen, để tạo thành hợp chất.
Ví dụ:
- Bari tác dụng với oxy:
2Ba + O2 → 2BaO
- Bari tác dụng với lưu huỳnh:
Ba + S → BaS
Phản ứng nhiệt phân
Một số hợp chất của bari có thể bị nhiệt phân để tạo thành bari oxit (BaO).
Ví dụ:
BaCO3 → BaO + CO2
Vấn đề an toàn khi sử dụng nguyên tố Bari
Độc hại
Bari là kim loại độc hại. Khi tiếp xúc với bari, đặc biệt là qua đường uống hoặc hít phải, nó có thể gây ra các triệu chứng như buồn nôn, nôn mửa, tiêu chảy, yếu cơ, tê bì, và thậm chí tử vong.
Nguy cơ cháy nổ
Bari có thể phản ứng mãnh liệt với nước, tạo thành bari hydroxit (Ba(OH)2) và khí hydro (H2). Khí hydro có thể dễ dàng bốc cháy và gây ra nguy cơ cháy nổ.
Gây kích ứng da và mắt
Bari có thể gây kích ứng da và mắt. Khi tiếp xúc với bari, cần rửa sạch da và mắt với nước ngay lập tức.
Nguy cơ hít phải
Hít phải bụi bari có thể gây ra các vấn đề về hô hấp, bao gồm viêm phổi và khí phế thũng.
Để đảm bảo an toàn khi sử dụng nguyên tố Bari, cần lưu ý những điểm sau:
- Mang trang thiết bị bảo hộ cá nhân: Khi sử dụng bari, cần mang găng tay, kính bảo hộ, và khẩu trang để tránh tiếp xúc trực tiếp với da, mắt và đường hô hấp.
- Làm việc trong môi trường thông gió tốt: Cần làm việc với bari trong môi trường thông gió tốt để tránh hít phải bụi bari.
- Bảo quản bari đúng cách: Bari cần được bảo quản trong hộp kín, tránh tiếp xúc với nước và không khí ẩm.
- Rửa tay sau khi sử dụng: Sau khi sử dụng bari, cần rửa tay kỹ lưỡng với xà phòng và nước.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Bari mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Bari. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







