Nguyên tố Astatin: Định nghĩa, tính chất và điều chế
Dưới đây là cái nhìn tổng quan mà yeuhoahoc.edu.vn đã tổng hợp được về nguyên tố Astatin, từ định nghĩa cơ bản đến lịch sử hình thành và vị trí.
Nguyên tố Astatin, một trong những nguyên tố hiếm nhất và bí ẩn nhất trên Trái Đất, làm dấy lên sự tò mò và quan tâm không chỉ trong giới khoa học mà còn trong cả cộng đồng quan tâm đến hóa học. Dưới đây là cái nhìn tổng quan mà yeuhoahoc.edu.vn đã tổng hợp được về nguyên tố Astatin, từ định nghĩa cơ bản đến lịch sử hình thành và vị trí của nó trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Astatin
Định nghĩa
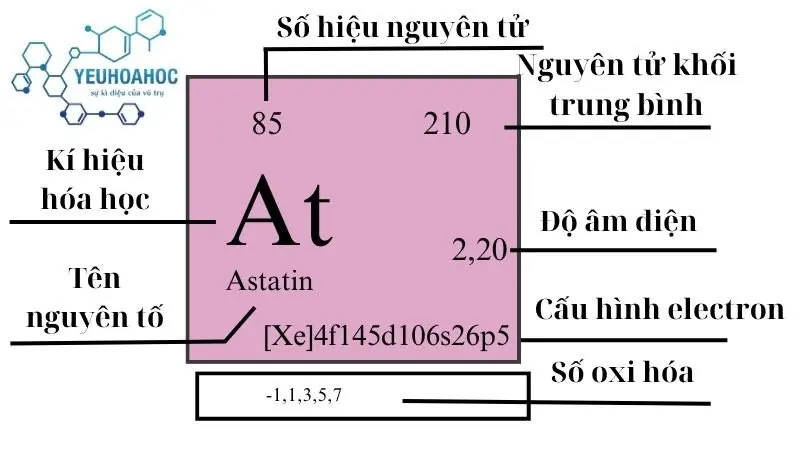
Astatin (tiếng Anh: Astatine) với kí hiệu hóa học là At, là nguyên tố hóa học có số nguyên tử 85. Nó thuộc nhóm halogen trong bảng tuần hoàn, cùng nhóm với Fluor, Clo, Brom, và Iot. Điểm đặc biệt của Astatin là tính phóng xạ cực kỳ mạnh và là một trong những nguyên tố tự nhiên hiếm nhất trên Trái Đất, với ước lượng chỉ có dưới 30g Astatin tồn tại ở bất kỳ thời điểm nào.
Lịch sử hình thành nguyên tố Astatin
Phát hiện và đặt tên
- Năm 1940: Astatin được phát hiện bởi nhóm các nhà khoa học Dale R. Corson, Kenneth Ross MacKenzie, và Emilio Segrè tại Đại học California, Berkeley. Họ tạo ra Astatin bằng cách bắn phá Bismuth với các hạt alpha.
- Ý nghĩa tên gọi: Tên “Astatin” bắt nguồn từ từ Hy Lạp “astatos”, có nghĩa là “không ổn định”, phản ánh tính chất phóng xạ và sự không ổn định của nó.
Mốc thời gian quan trọng
- 1940: Dale R. Corson, Kenneth Ross MacKenzie và Emilio Segrè phát hiện ra Astatin tại Đại học California, Berkeley.
- 1943: Astatin được đặt tên theo từ tiếng Hy Lạp “astatos”, có nghĩa là “không ổn định”, do tính chất phóng xạ của nó.
- 1949: Astatin được tổng hợp nhân tạo lần đầu tiên.
Nguyên tố Astatin trong bảng tuần hoàn hóa học
- Astatin nằm ở chu kỳ 6, nhóm 17 (Halogen) của bảng tuần hoàn hóa học.
- Nó là nguyên tố halogen nặng nhất và là nguyên tố nhân tạo đầu tiên được đưa vào bảng tuần hoàn.
- Astatin có tính chất hóa học tương tự như các halogen khác, nhưng nó ít phản ứng hơn do tính phóng xạ cao.
- Astatin có 28 đồng vị, tất cả đều không bền. Đồng vị bền nhất là At-210, có chu kỳ bán rã là 8,1 giờ.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/g.K | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 17 | 6 | [210] | 7 | 575 | 610 | – | 2,2 | <0,001 |
Tính chất của nguyên tố Astatin
Tính chất vật lý
- Astatin là một nguyên tố phi kim loại, có màu đen hoặc xám.
- Nó là chất rắn ở nhiệt độ phòng và có điểm nóng chảy thấp (khoảng 302°C).
- Astatin là chất dẫn điện và dẫn nhiệt kém.
- Astatin có độ bền cao và khó tan trong nước.
Tính chất hóa học
- Astatin có tính chất hóa học tương tự như các halogen khác, nhưng nó ít phản ứng hơn do tính phóng xạ cao.
- Astatin có thể tạo thành hợp chất với các kim loại và phi kim loại khác.
- Astatin có thể tham gia vào các phản ứng oxy hóa khử.
- Astatin có tính khử mạnh hơn so với iodine.
Dưới đây là một số ví dụ về tính chất hóa học của Astatin:
- Phản ứng với kim loại: Astatin có thể phản ứng với các kim loại để tạo thành muối astatide. Ví dụ, Astatin có thể phản ứng với natri để tạo thành natri astatide (NaAt).
- Phản ứng với phi kim loại: Astatin có thể phản ứng với các phi kim loại khác để tạo thành hợp chất. Ví dụ, Astatin có thể phản ứng với oxy để tạo thành astatide pentoxit (At2O5).
- Phản ứng oxy hóa khử: Astatin có thể tham gia vào các phản ứng oxy hóa khử, trong đó nó có thể đóng vai trò là chất khử hoặc chất oxy hóa. Ví dụ, Astatin có thể khử iodine thành ion iodide (I-).
Lưu ý:
- Astatin là một nguyên tố nguy hiểm và cần được xử lý cẩn thận bởi các chuyên gia được đào tạo.
- Tiếp xúc với Astatin có thể dẫn đến ngộ độc phóng xạ, có thể gây ra các vấn đề sức khỏe nghiêm trọng, bao gồm cả ung thư.
Ứng dụng của nguyên tố Astatin

Astatin là một nguyên tố phóng xạ hiếm và có tính không ổn định cao. Do đặc tính này, nó có một số ứng dụng hạn chế trong các lĩnh vực sau:
Y học
- Astatin-211 được sử dụng trong liệu pháp xạ trị để điều trị ung thư, đặc biệt là ung thư tuyến giáp.
- Astatin-211 cũng được sử dụng để tạo ra các nguồn bức xạ alpha để sử dụng trong chẩn đoán y tế.
Nghiên cứu khoa học
- Astatin-210 được sử dụng trong các nghiên cứu khoa học về vật liệu, hóa học và sinh học.
- Astatin-210 cũng được sử dụng để tạo ra các nguồn neutron để sử dụng trong các thí nghiệm vật lý.
Công nghiệp
- Astatin-210 được sử dụng trong các thiết bị đo độ dày và các thiết bị chống tĩnh điện.
- Astatin-210 cũng được sử dụng trong các nguồn năng lượng hạt nhân cỡ nhỏ để sử dụng trong các thiết bị vũ trụ.
Điều chế và sản xuất nguyên tố Astatin

Điều chế
Điều chế trong phòng thí nghiệm:
- Astatin có thể được điều chế bằng cách bắn phá bismuth-209 bằng neutron trong lò phản ứng hạt nhân:
209Bi + n → 210Po + γ
210Po → 206Pb + 2α
2α + 2n → 210At
- Astatin cũng có thể được điều chế bằng cách phân rã alpha của radon-222:
222Rn → 218Po + α
218Po → 214Pb + α
214Pb → 210Bi + β-
210Bi → 210Po + β-
210Po → 206Pb + 2α
2α + 2n → 210At
Điều chế trong công nghiệp:
- Astatin được sản xuất chủ yếu bằng cách bắn phá bismuth-209 bằng neutron trong lò phản ứng hạt nhân.
- Astatin cũng có thể được sản xuất bằng cách chiết xuất từ urani và thori.
Sản xuất
- Astatin được sản xuất với số lượng rất hạn chế, chỉ vài gram mỗi năm.
- Astatin được sản xuất tại một số quốc gia, bao gồm Nga, Hoa Kỳ và Pháp.
- Astatin được sử dụng trong một số ứng dụng y tế, nghiên cứu khoa học và công nghiệp.
Phản ứng của nguyên tố Astatin
Astatin là một nguyên tố phóng xạ, có tính hóa học tương tự như các halogen khác. Tuy nhiên, do tính phóng xạ cao, Astatin ít phản ứng hơn so với các halogen khác.
Phản ứng với kim loại
- Astatin có thể phản ứng với các kim loại để tạo thành muối astatide. Ví dụ:
2At + Na → 2NaAt
Phản ứng với phi kim loại
- Astatin có thể phản ứng với các phi kim loại khác để tạo thành hợp chất. Ví dụ:
At + O2 → At2O5
Phản ứng oxy hóa khử
- Astatin có thể tham gia vào các phản ứng oxy hóa khử, trong đó nó có thể đóng vai trò là chất khử hoặc chất oxy hóa. Ví dụ:
At + I2 → 2AtI
Phân rã alpha
- Astatin là một nguyên tố phóng xạ alpha, phân rã thành chì và hạt alpha:
210At → 206Pb + 2α
Ví dụ cụ thể:
- Phản ứng của Astatin với natri:
Astatin phản ứng với natri trong dung dịch ethanol để tạo thành natri astatide (NaAt) và khí hydro:
2At + 2Na + 2C2H5OH → 2NaAt + H2 + 2C2H5OH
- Phản ứng của Astatin với oxy:
Astatin phản ứng với oxy ở nhiệt độ cao để tạo thành astatide pentoxit (At2O5):
2At + 5O2 → At2O5
- Phản ứng của Astatin với iodine:
Astatin khử iodine thành ion iodide (I-) trong dung dịch nước:
At + I2 → 2AtI
Vấn đề an toàn của nguyên tố Astatin
Nguy cơ bức xạ alpha
- Astatin phát ra hạt alpha, có thể ion hóa các tế bào trong cơ thể, dẫn đến tổn thương DNA và ung thư.
- Hít phải hoặc nuốt phải Astatin có thể dẫn đến phơi nhiễm toàn thân với bức xạ alpha, ảnh hưởng đến tất cả các cơ quan trong cơ thể.
- Tiếp xúc với Astatin qua da có thể dẫn đến phơi nhiễm tại chỗ với bức xạ alpha, ảnh hưởng đến da và các mô xung quanh.
Nguy cơ hỏa hoạn
- Astatin là một kim loại dễ cháy và có thể tự bốc cháy trong không khí.
- Bụi Astatin có thể tạo thành hỗn hợp dễ nổ với không khí.
Nguy cơ ô nhiễm môi trường
- Astatin có thể dễ dàng lan truyền trong môi trường và gây ô nhiễm nguồn nước và đất.
- Tiếp xúc với Astatin trong môi trường có thể gây ra các vấn đề sức khỏe cho người và động vật.
Lưu ý an toàn:
- Cần cẩn thận khi sử dụng Astatin để tránh tiếp xúc trực tiếp với da và mắt.
- Nên đeo găng tay, khẩu trang và quần áo bảo hộ khi làm việc với Astatin.
- Cần bảo quản Astatin ở nơi khô ráo, thoáng mát, tránh xa nguồn nhiệt và tia lửa.
- Astatin thải ra cần được xử lý theo quy định của địa phương.
- Không nên vứt bỏ Astatin bừa bãi vì nó có thể gây ô nhiễm môi trường.
Dưới đây là bản tóm tắt các thông tin cơ bản về nguyên tố Astatin mà chúng tôi đã thu thập. Mời bạn đọc tiếp và khám phá thêm thông tin về chủ đề này!
Chúng tôi mong rằng bạn đã có được một cái nhìn toàn diện và chi tiết về nguyên tố Astatin qua bài viết này. Nếu có bất cứ thắc mắc nào hoặc bạn muốn tìm hiểu thêm, hãy thoải mái để lại lời bình luận ở phía dưới!







