Nguyên tố Antimon: Định nghĩa và ứng dụng trong ngành hóa
Bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá bí ẩn của nguyên tố Antimon, từ tính chất, lịch sử khám phá, đến những ứng dụng.
Antimon (Sb), một nguyên tố hóa học với số nguyên tử 51, nổi tiếng với những đặc tính độc đáo và ứng dụng đa dạng, từ công nghệ đến y tế. Dù không phải là nguyên tố phổ biến nhất, nhưng sự hiện diện của Antimon trong cuộc sống hàng ngày và ngành công nghiệp hiện đại là không thể phủ nhận. Bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá bí ẩn của nguyên tố Antimon, từ tính chất, lịch sử khám phá, đến những ứng dụng thực tế, mang lại cái nhìn tổng quan về một trong những nguyên tố thú vị nhất trên bảng tuần hoàn.
Giới thiệu về nguyên tố Antimon
Định nghĩa
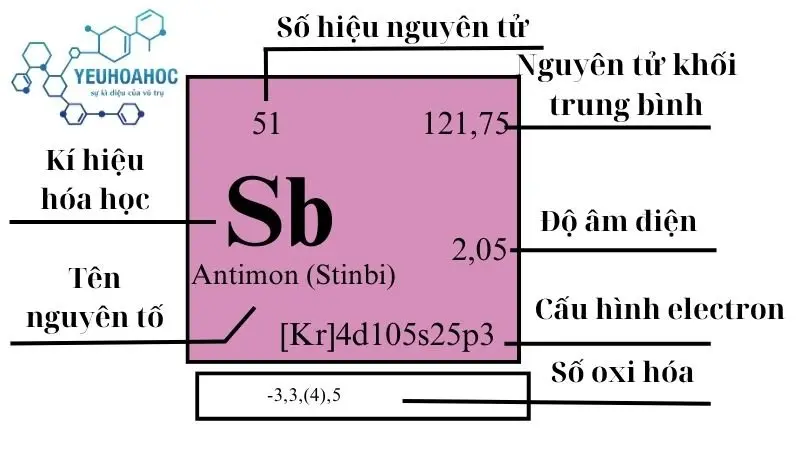
Nguyên tố Antimon, với tên tiếng Anh là Antimony và kí hiệu hóa học là Sb (từ Latin “Stibium”), là một nguyên tố hóa học phức tạp nhưng lại có vị trí đặc biệt trong bảng tuần hoàn. Thuộc nhóm 15 và chu kỳ 5, là một nguyên tố bán kim với các tính chất độc đáo, bao gồm khả năng chống ăn mòn và cứng hóa khi hợp kim hóa với các kim loại khác.
Lịch sử hình thành
Lịch sử của Antimon trải dài hàng nghìn năm, với bằng chứng sử dụng đầu tiên xuất hiện trong các nền văn minh cổ đại. Nguyên tố này đã được biết đến và sử dụng bởi người Ai Cập cổ đại, chủ yếu trong các ứng dụng mỹ phẩm và y tế.
Một số mốc thời gian quan trọng
- Khoảng 3000 trước Công Nguyên: Người Ai Cập sử dụng Antimon dưới dạng bột sulfide (Sb2S3) để kẻ mắt và như một chất dược phẩm.
- Thế kỷ 17: Phương Tây bắt đầu khai thác Antimon như một nguồn nguyên liệu quan trọng trong sản xuất hợp kim và các ứng dụng công nghiệp khác.
- Thế kỷ 18: Phát hiện ra phương pháp tinh chế Antimon, mở đường cho sự phát triển của nhiều ứng dụng mới.
Nguyên tố Antimon trong bảng tuần hoàn hóa học
Số nguyên tử: 51
Ký hiệu: Sb
Khối lượng nguyên tử: 121,76 u
Cấu hình electron: [Kr] 4d10 5s2 5p3
Nhóm: 15 (Nhóm nitơ)
Chu kỳ: 5
Khối: p
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi K | Nhiệt dung riêng J/gK | Độ âm điện | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 15 | 5 | 121,760(1) | 6,685 | 903,78 | 1860 | 0,207 | 2,05 | 0,2 |
Tính chất của nguyên tố Antimon
Tính chất vật lý
- Màu sắc: Trắng bạc
- Trạng thái: Rắn
- Khối lượng riêng: 6,697 g/cm³
- Điểm nóng chảy: 630,63 °C
- Điểm sôi: 1750 °C
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
- Độ cứng Mohs: 3
- Dễ nóng chảy: Dễ
- Dễ dát mỏng: Dễ
Tính chất hóa học
- Tính chất hóa học: Bán kim loại
- Tính khử: Yếu
- Tính oxy hóa: Yếu
- Tính oxi hóa: Antimon có thể tồn tại ở nhiều trạng thái oxi hóa, bao gồm -3, 0, +3, và +5. Trong môi trường tự nhiên, antimon thường gặp nhất ở dạng sulfide (Sb2S3) trong quặng stibnite.
- Phản ứng với chất oxi hóa: Antimon chậm chạp phản ứng với oxi ở nhiệt độ phòng nhưng có thể cháy khi được nung nóng, tạo ra oxit antimon (Sb2O3).
- Phản ứng với Axit: Nó ít phản ứng với axit clohydric (HCl), nhưng có thể tan trong axit nitric (HNO3) tạo thành axit antimonit (H[Sb(OH)6]) khi ở trạng thái oxi hóa +5.
- Tính chất với hợp chất khác: Antimon tạo thành nhiều hợp chất, từ oxit, sulfide, đến hợp chất hữu cơ và vô cơ, thể hiện sự đa dạng trong hóa học của nó.
- Trạng thái oxy hóa: +3, +5
- Hợp chất: Sb2O3, SbCl3, Sb2S3
Một số tính chất khác:
- Antimon là một nguyên tố tương đối hiếm.
- Antimon có thể được tìm thấy trong quặng stibnite.
- Antimon được sử dụng trong nhiều ứng dụng, bao gồm hợp kim, pin, và vật liệu chống cháy.
Ứng dụng của nguyên tố Antimon

Sản xuất hợp kim
- Chì-Antimon: Hợp kim chì-antimon được sử dụng trong ắc quy axit-chì, với antimon giúp tăng cường độ cứng và độ bền của các tấm chì.
- Hợp kim với Thiếc: Trong công nghiệp hàn và sản xuất thiết bị điện tử, hợp kim thiếc-antimon được sử dụng như một chất lưu huỳnh có điểm nóng chảy thấp, giúp tạo ra các mối hàn chắc chắn.
Chất bán dẫn
- Chất Bán Dẫn: Antimon được sử dụng trong sản xuất chất bán dẫn, thường là hợp chất với arsên hay indium, để tạo ra các thiết bị như điốt và transistor, cũng như trong các cảm biến nhiệt độ và đèn LED.
Chất chống cháy
- Hợp Chất Retardant Cháy: Antimon trioxide được sử dụng như một chất phụ gia retardant cháy trong nhiều loại vật liệu, bao gồm vải, nhựa, và sơn, giúp chậm quá trình bắt cháy và lan rộng của lửa.
Y tế và dược phẩm
- Điều Trị Bệnh Parasite: Một số hợp chất của antimon được sử dụng trong điều trị các bệnh nhiễm parasite, như leishmaniasis và schistosomiasis.
- Hợp Chất Hữu Cơ Antimon: Được nghiên cứu và phát triển cho các ứng dụng y tế, bao gồm cả như một phần của các loại thuốc chống ung thư.
Sản xuất kính và gốm
- Kính và Gốm: Antimon trioxide được sử dụng như một chất phụ gia trong sản xuất kính và gốm, giúp cải thiện đặc tính của sản phẩm như độ trong và độ bền cơ học.
Mỹ phẩm
- Mỹ Phẩm: Trong lịch sử, antimon đã được sử dụng làm chất nhuộm mắt. Dù hiện nay việc sử dụng nó trong mỹ phẩm đã bị hạn chế do lo ngại về độc tính.
Các ứng dụng khác
- Các Ứng Dụng Khác: Antimon cũng được sử dụng trong lĩnh vực phát triển vật liệu mới, như các loại pin năng lượng cao và vật liệu chống ăn mòn.
Điều chế và sản xuất nguyên tố Antimon
Nguyên tố Antimon (Sb) có ứng dụng rộng rãi, từ công nghiệp chế tạo hợp kim cho đến sử dụng trong chất bán dẫn và y tế. Sản xuất Antimon đòi hỏi các phương pháp điều chế cụ thể, từ phòng thí nghiệm đến quy mô công nghiệp.
Điều chế nguyên tố Antimon trong phòng thí nghiệm
Trong phòng thí nghiệm, Antimon có thể được điều chế thông qua phản ứng khử của oxit antimon bằng hydro hoặc carbon:
Phản ứng với Hydro:
- Sb2O3+3H2→2Sb+3H2O
- Trong phản ứng này, oxit antimon (III) (Sb2O3) được khử bởi hydro, tạo ra antimon kim loại và nước.
Phản ứng với Carbon:
Sb2O3+3C→2Sb+3CO
- Tương tự, oxit antimon cũng có thể được khử bằng carbon, tạo ra antimon kim loại và khí carbon monoxide.
Điều chế nguyên tố Antimon trong công nghiệp
Trên quy mô công nghiệp, Antimon chủ yếu được sản xuất từ quặng stibnite (Sb2S3) thông qua quá trình luyện kim:
Khử Quặng Stibnite bằng Sắt:
- Sb2S3+3Fe→2Sb+3FeS
- Trong quá trình này, stibnite được nung nóng với sắt để tạo ra antimon kim loại và sulfide sắt (FeS) như một sản phẩm phụ.
- Tinh Chế Antimon: Antimon thô thu được từ phản ứng trên sau đó được tinh chế, thường qua quá trình điện phân hoặc xử lý hóa học để loại bỏ các tạp chất.
Sản xuất nguyên tố Antimon
Sau khi điều chế, antimon thô được xử lý và tinh chế thêm để đạt đến độ tinh khiết cao cần thiết cho các ứng dụng cụ thể. Các bước sản xuất bao gồm:
- Luyện kim: Bao gồm việc luyện chảy và kết tinh lại antimon để tăng độ tinh khiết của kim loại.
- Hợp kim hóa: Antimon được kết hợp với các kim loại khác để tạo thành hợp kim với tính chất mong muốnnhư làm tăng độ cứng cho chì hoặc nâng cao các đặc tính vật lý của các loại kim loại khác.
Phản ứng của nguyên tố Antimon

Phản ứng với axit
- Antimon tác dụng với axit nitric và axit hydrochloric nóng, nhưng không tác dụng với axit sulfuric đậm đặc.
- Ví dụ:
Sb + 3HNO3 → Sb(NO3)3 + 3H2
Sb + 3HCl → SbCl3 + 3H2
Phản ứng với halogen
- Antimon tác dụng với halogen để tạo thành hợp chất halogenua antimon.
- Ví dụ:
Sb + 3Cl2 → SbCl3
Sb + 3Br2 → SbBr3
Phản ứng với kim loại
- Antimon tác dụng với kim loại mạnh như Mg hoặc Zn để tạo thành hợp kim.
- Ví dụ:
Sb + Mg → Mg3Sb2
Sb + 2Zn → Zn2Sb
Phản ứng oxy hóa
- Antimon có thể bị oxy hóa bởi axit nitric hoặc kali permanganat để tạo thành hợp chất antimon (V).
- Ví dụ:
3Sb + 5HNO3 → 3Sb2O5 + 5NO + 2H2O
2Sb + 3K2MnO4 + 8H2SO4 → 2Sb2(SO4)3 + 3K2SO4 + 8H2O
Phản ứng khử
- Antimon có thể khử một số hợp chất oxy hóa, ví dụ như kali dichromat.
- Ví dụ:
3Sb + 2K2Cr2O7 + 14H2SO4 → 3Sb2(SO4)3 + 2Cr2(SO4)3 + 7K2SO4 + 14H2O
Vấn đề an toàn khi sử dụng nguyên tố Antimon
Tuy nhiên, Antimon cũng có thể gây ra một số nguy cơ an toàn nếu không được sử dụng đúng cách. Dưới đây là một số vấn đề an toàn cần lưu ý khi sử dụng Antimon:
Độc tính:
- Antimon có thể gây độc nếu tiếp xúc lâu dài hoặc ở mức độ cao.
- Các triệu chứng ngộ độc Antimon bao gồm buồn nôn, nôn, tiêu chảy, đau bụng, co giật và hôn mê.
- Tiếp xúc lâu dài với Antimon có thể dẫn đến tổn thương gan, thận và tim.
Hít phải:
- Hít phải bụi Antimon có thể gây kích ứng phổi, ho và khó thở.
- Tiếp xúc lâu dài với bụi Antimon có thể dẫn đến bệnh phổi.
Tiếp xúc da:
- Tiếp xúc da với Antimon có thể gây kích ứng da, ngứa và phát ban.
Nuốt phải:
- Nuốt phải Antimon có thể gây buồn nôn, nôn, tiêu chảy và đau bụng.
Để đảm bảo an toàn khi sử dụng Antimon, cần thực hiện các biện pháp phòng ngừa sau:
- Hạn chế tiếp xúc với Antimon.
- Sử dụng thiết bị bảo hộ cá nhân khi tiếp xúc với Antimon, bao gồm găng tay, khẩu trang và kính bảo hộ.
- Rửa tay kỹ sau khi tiếp xúc với Antimon.
- Giữ cho khu vực làm việc sạch sẽ và thông gió tốt.
- Tuân thủ các quy định an toàn khi sử dụng Antimon.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Antimon mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Antimon. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!







