Metan
Bài viết này sẽ cung cấp cho bạn những thông tin chi tiết về metan, bao gồm tính chất, nguồn gốc, ứng dụng, tác động môi trường và biện pháp bảo vệ
Khám phá metan (CH4) – hợp chất hữu cơ đơn giản nhất với vai trò quan trọng trong đời sống và kinh tế. Tuy nhiên, metan cũng là một khí nhà kính mạnh, gây ra nhiều tác động tiêu cực đến môi trường. Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cho bạn những thông tin chi tiết về metan, bao gồm tính chất, nguồn gốc, ứng dụng và tác động môi trường, cùng với các giải pháp giảm thiểu phát thải metan và bảo vệ môi trường.
Định nghĩa Metan (methane)

Metan (CH4) là hidrocacbon đơn giản nhất, là thành phần chính của khí tự nhiên. Nó là một khí không màu, không mùi, không vị, nhẹ hơn không khí và ít tan trong nước.
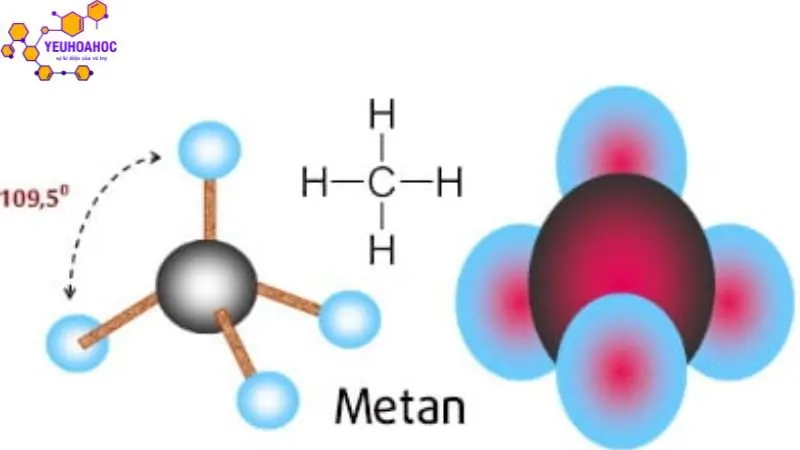
- Cấu trúc phân tử Metan (tetrahedral)
- Hình dạng: Phân tử metan có cấu trúc tứ diện đều (tetrahedral), với một nguyên tử carbon (C) ở trung tâm và bốn nguyên tử hydro (H) liên kết với nó bằng bốn liên kết cộng hóa trị C-H.
- Góc liên kết: Các liên kết C-H tạo với nhau góc 109,28°, tạo cho phân tử metan có tính đối xứng tứ diện cao.
- Độ dài liên kết: Độ dài liên kết C-H xấp xỉ 1,09 Å.
- Giải thích các liên kết hóa học trong phân tử metan
- Liên kết cộng hóa trị: Các nguyên tử C và H liên kết với nhau bằng bốn liên kết cộng hóa trị đơn.
- Sự hình thành liên kết:
- Nguyên tử C có 4 electron hóa trị, cần 4 electron để đạt cấu hình electron bền vững (ngũ phân tử).
- Mỗi nguyên tử H có 1 electron hóa trị, cần 1 electron để đạt cấu hình electron bền vững (ngũ phân tử).
- Các nguyên tử C và H chia sẻ electron với nhau để đạt cấu hình electron bền vững, hình thành bốn liên kết C-H.
- So sánh cấu trúc phân tử metan với các hidrocacbon khác
- Ankan:
- Metan là ankan đơn giản nhất, với cấu trúc tứ diện đều.
- Các ankan khác có cấu trúc tương tự metan, nhưng có nhiều nguyên tử C và H hơn.
- Các liên kết C-C và C-H trong ankan cũng là liên kết cộng hóa trị đơn.
- Anken:
- Anken chứa ít nhất một liên kết đôi C=C.
- Cấu trúc của anken phẳng hơn so với metan do ảnh hưởng của liên kết đôi.
- Các liên kết C-H trong anken cũng là liên kết cộng hóa trị đơn.
- Ankin:
- Ankin có ít nhất một liên kết ba C≡C.
- Cấu trúc của ankin thẳng hơn so với metan do ảnh hưởng của liên kết ba.
- Các liên kết C-H trong ankin cũng là liên kết cộng hóa trị đơn.
Bảng so sánh cấu trúc phân tử metan với các hidrocacbon khác:
| Loại hidrocacbon | Cấu trúc | Liên kết | Góc liên kết |
| Metan | Tứ diện đều | C-H (đơn) | 109,28° |
| Ankan | Tương tự metan | C-C (đơn), C-H (đơn) | 109,28° |
| Anken | Phẳng | C=C (kép), C-H (đơn) | 120° |
| Ankin | Thẳng | C≡C (ba), C-H (đơn) | 180° |
Tính chất vật lý và hóa học của Metan
Tính chất vật lý
- Trạng thái: Khí ở điều kiện thường
- Màu sắc: Không màu
- Mùi: Không mùi
- Vị: Không vị
- Điểm sôi: -161,5°C
- Điểm nóng chảy: -182,5°C
- Khối lượng riêng: 0,554 g/L (ở 0°C và 1 atm)
- Độ tan trong nước: Rất ít
Tính chất hóa học
Phản ứng trùng hợp: Metan có thể tham gia phản ứng trùng hợp tạo thành các polyme như polyethylene.
So sánh tính chất vật lý và hóa học của metan với các hidrocacbon khác
Tính chất vật lý
| Loại hidrocacbon | Trạng thái (điều kiện thường) | Điểm sôi | Điểm nóng chảy | Khối lượng riêng | Độ tan trong nước |
| Metan | Khí | -161,5°C | -182,5°C | 0,554 g/L | Rất ít |
| Ankan | Khí, lỏng hoặc rắn (tùy số lượng nguyên tử C) | Tăng dần theo số lượng nguyên tử C | Tăng dần theo số lượng nguyên tử C | Tăng dần theo số lượng nguyên tử C | Rất ít |
| Anken | Khí hoặc lỏng (tùy số lượng nguyên tử C) | Tăng dần theo số lượng nguyên tử C | Tăng dần theo số lượng nguyên tử C | Tăng dần theo số lượng nguyên tử C | Ít tan hơn metan |
| Ankin | Khí hoặc lỏng (tùy số lượng nguyên tử C) | Tăng dần theo số lượng nguyên tử C | Tăng dần theo số lượng nguyên tử C | Tăng dần theo số lượng nguyên tử C | Ít tan hơn metan |
Tính chất hóa học
| Loại hidrocacbon | Phản ứng cháy | Phản ứng thế | Phản ứng cộng |
| Metan | Dễ cháy | Có thể xảy ra | Có thể xảy ra |
| Ankan | Dễ cháy | Có thể xảy ra | Có thể xảy ra |
| Anken | Dễ cháy | Dễ dàng hơn metan và ankan | Dễ dàng hơn metan và ankan |
| Ankin | Dễ cháy nhất | Dễ dàng nhất | Dễ dàng nhất |
Điều chế khí metan

Trong phòng thí nghiệm
Phương pháp phổ biến:
Ưu điểm: Dễ dàng thực hiện, hiệu suất cao.
Ưu điểm: Nhanh chóng, dễ kiếm nguyên liệu.
Phương pháp khác:
Khử các dẫn xuất methyl của halogen, ancol hoặc carbonyl:
Lưu ý:
- Cần tuân thủ các quy tắc an toàn khi thực hiện thí nghiệm.
- Lựa chọn phương pháp phù hợp với mục đích và điều kiện thí nghiệm.
Trong công nghiệp
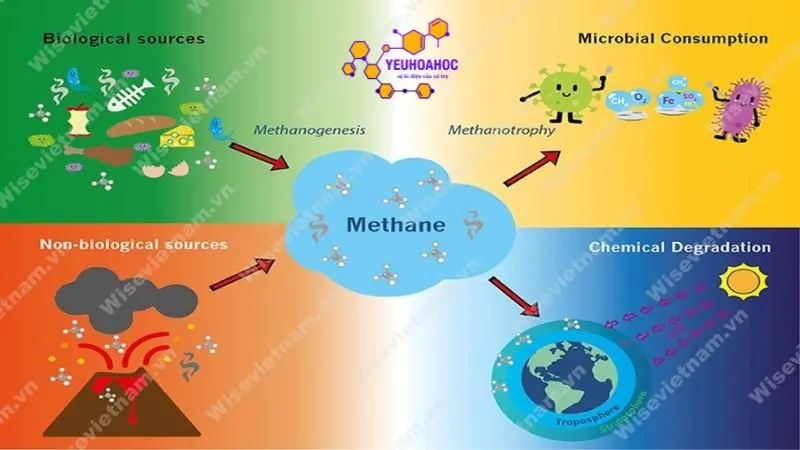
Nguồn cung cấp metan chính:
- Khí tự nhiên: Metan là thành phần chính của khí tự nhiên (chiếm khoảng 75%). Khí tự nhiên được khai thác từ các mỏ ngầm dưới lòng đất.
- Dầu mỏ: Metan được tách ra từ khí đồng hành khai thác cùng với dầu mỏ.
- Phân hủy than: Metan có thể được sản xuất từ than đá thông qua quá trình khí hóa than.
Quy trình sản xuất:
- Khí tự nhiên: Metan được tách ra khỏi các khí khác trong khí tự nhiên bằng các phương pháp như ngưng tụ, hấp thụ và màng lọc.
- Dầu mỏ: Khí đồng hành được tách ra khỏi dầu mỏ bằng các phương pháp như tách khí – lỏng và hấp thụ.
- Phân hủy than: Than đá được nung nóng trong điều kiện thiếu oxy để tạo ra khí tổng hợp (syngas), bao gồm CO, H2 và CH4. Metan sau đó được tách ra khỏi syngas bằng các phương pháp như ngưng tụ và hấp thụ.
Lưu ý:
- Quy trình sản xuất metan trong công nghiệp cần đảm bảo hiệu quả và an toàn.
- Việc khai thác và sử dụng metan cần được thực hiện một cách bền vững để giảm thiểu tác động đến môi trường.
Ứng dụng của Metan trong đời sống
Nhiên liệu
- Khí đốt: Metan là thành phần chính của khí tự nhiên, được sử dụng rộng rãi làm nhiên liệu cho nấu nướng, sưởi ấm, phát điện và vận chuyển.
- Nhiên liệu cho xe cộ: Metan có thể được nén thành khí nén CNG hoặc hóa lỏng thành LNG để sử dụng làm nhiên liệu cho xe buýt, xe tải và thậm chí cả ô tô.
- Nhiên liệu cho sản xuất: Metan được sử dụng làm nhiên liệu cho các lò nung công nghiệp và máy móc trong nhiều ngành công nghiệp.
Lợi ích:
- Sạch hơn: Metan cháy sạch hơn so với các nhiên liệu hóa thạch khác như than đá và dầu mỏ, tạo ra ít khí thải độc hại hơn.
- Dồi dào: Khí tự nhiên, nguồn cung cấp metan chính, là một nguồn tài nguyên dồi dào và được phân bố rộng khắp trên thế giới.
- Hiệu quả: Metan là một nguồn nhiên liệu hiệu quả cao, có thể chuyển đổi thành năng lượng một cách hiệu quả.
Hóa chất
- Nguyên liệu sản xuất hóa chất: Metan là nguyên liệu quan trọng cho sản xuất nhiều loại hóa chất quan trọng như amoniac, methanol, axit axetic, nhựa, v.v.
- Sản xuất nhiên liệu sinh học: Metan có thể được sử dụng để sản xuất các nhiên liệu sinh học như biodiesel và biogas.
Lợi ích:
- Đa dạng: Metan có thể được sử dụng để sản xuất nhiều loại hóa chất khác nhau, đáp ứng nhu cầu đa dạng của ngành công nghiệp.
- Thay thế nhiên liệu hóa thạch: Các hóa chất được sản xuất từ metan có thể thay thế cho các hóa chất được sản xuất từ nhiên liệu hóa thạch, góp phần giảm thiểu tác động đến môi trường.
- Phát triển bền vững: Sản xuất nhiên liệu sinh học từ metan là một giải pháp phát triển bền vững cho ngành năng lượng.
Sản xuất vật liệu
- Sản xuất nhựa: Metan được sử dụng để sản xuất các loại nhựa polyethylene, polypropylene, polystyrene, v.v.
- Sản xuất cao su tổng hợp: Metan được sử dụng để sản xuất cao su tổng hợp isobutylene isoprene rubber (IIR).
Lợi ích:
- Đa dạng: Metan có thể được sử dụng để sản xuất nhiều loại vật liệu khác nhau, đáp ứng nhu cầu đa dạng của các ngành công nghiệp.
- Bền bỉ: Các vật liệu được sản xuất từ metan thường có độ bền cao và chịu được các điều kiện khắc nghiệt.
- Thay thế vật liệu truyền thống: Các vật liệu được sản xuất từ metan có thể thay thế cho các vật liệu truyền thống như gỗ và kim loại, góp phần bảo vệ tài nguyên thiên nhiên.
So sánh ứng dụng của metan với các hidrocacbon khác:
| Loại hidrocacbon | Ứng dụng | Ưu điểm | Nhược điểm |
| Metan | Nhiên liệu, hóa chất, sản xuất vật liệu | Sạch, dồi dào, hiệu quả | Yêu cầu công nghệ cao để khai thác và sử dụng |
| Etan | Nhiên liệu, hóa chất | Dễ dàng vận chuyển và lưu trữ hơn metan | Ít dồi dào hơn metan |
| Propan | Nhiên liệu, hóa chất | Dễ dàng vận chuyển và lưu trữ hơn metan | Ít dồi dào hơn metan |
| Butan | Nhiên liệu, hóa chất | Dễ dàng vận chuyển và lưu trữ hơn metan | Ít dồi dào hơn metan |
| Etilen | Sản xuất nhựa | Nguyên liệu quan trọng cho sản xuất polyethylene | Nguy hiểm hơn metan |
| Propen | Sản xuất nhựa | Nguyên liệu quan trọng cho sản xuất polypropylene | Nguy hiểm hơn metan |
| Buten | Sản xuất nhựa | Nguyên liệu quan trọng cho sản xuất polybutylene | Nguy hiểm hơn metan |
| Acetylen | Hàn kim loại, sản xuất hóa chất | Nhiệt độ cháy cao | Nguy hiểm cao |
Tác động môi trường và giải pháp của Metan
Tác động tích cực:
- Nhiên liệu sạch: Metan cháy sạch hơn so với các nhiên liệu hóa thạch khác như than đá và dầu mỏ, tạo ra ít khí thải độc hại hơn.
- Giảm thiểu ô nhiễm không khí: Việc sử dụng metan thay thế cho các nhiên liệu hóa thạch khác có thể góp phần giảm thiểu ô nhiễm không khí, cải thiện chất lượng cuộc sống con người.
- Nguồn năng lượng dồi dào: Khí tự nhiên, nguồn cung cấp metan chính, là một nguồn tài nguyên dồi dào và được phân bố rộng khắp trên thế giới.
Tác động tiêu cực
- Hiệu ứng nhà kính: Metan là một khí nhà kính mạnh, có khả năng giữ nhiệt trong bầu khí quyển cao gấp 25 lần so với CO2.
- Biến đổi khí hậu: Việc phát thải metan vào khí quyển góp phần làm gia tăng hiệu ứng nhà kính, dẫn đến biến đổi khí hậu với những hậu quả nghiêm trọng như nước biển dâng cao, hạn hán, lũ lụt, v.v.
- Ô nhiễm môi trường: Metan có thể tham gia vào các phản ứng hóa học trong khí quyển, tạo ra các chất ô nhiễm độc hại như ozone và smog.
Các vấn đề môi trường liên quan đến khí metan.
- Rò rỉ khí metan: Khí metan có thể rò rỉ từ các giếng khí tự nhiên, đường ống dẫn khí và các cơ sở lưu trữ khí. Rò rỉ khí metan góp phần đáng kể vào lượng khí nhà kính thải ra môi trường.
- Nông nghiệp: Nông nghiệp là nguồn phát thải metan lớn thứ hai sau ngành năng lượng. Metan được thải ra từ các hoạt động chăn nuôi gia súc, canh tác lúa nước và sử dụng phân bón.
- Chất thải rắn: Chất thải rắn hữu cơ phân hủy trong các bãi chôn lấp cũng thải ra một lượng lớn khí metan.
Giải pháp giảm thiểu tác động tiêu cực của metan
- Giảm thiểu rò rỉ khí metan: Cần áp dụng các biện pháp để phát hiện và sửa chữa kịp thời các điểm rò rỉ khí metan từ các giếng khí tự nhiên, đường ống dẫn khí và các cơ sở lưu trữ khí.
- Thay đổi phương pháp chăn nuôi gia súc: Cần áp dụng các phương pháp chăn nuôi gia súc hiệu quả hơn để giảm lượng khí metan thải ra, ví dụ như sử dụng thức ăn ít metan hơn và cải thiện hệ thống quản lý chất thải.
- Sử dụng phân bón hiệu quả: Cần sử dụng phân bón hiệu quả hơn để giảm lượng khí metan thải ra từ các hoạt động canh tác lúa nước.
- Thu gom và xử lý khí metan từ chất thải rắn: Cần thu gom và xử lý khí metan từ các bãi chôn lấp chất thải rắn để giảm lượng khí thải ra môi trường.
- Phát triển các công nghệ mới: Cần phát triển các công nghệ mới để thu hồi và sử dụng khí metan một cách hiệu quả hơn, ví dụ như công nghệ sinh học và công nghệ nano.
Metan đóng vai trò quan trọng trong nhiều lĩnh vực, từ khoa học, công nghiệp đến đời sống con người. Việc sử dụng và khai thác metan hiệu quả cần đi kèm với trách nhiệm bảo vệ môi trường và phát triển bền vững. Hãy cùng chung tay nâng cao nhận thức về tầm quan trọng của metan, sử dụng hợp lý và góp phần bảo vệ môi trường cho thế hệ tương lai.







