Dãy hoạt động hóa học của kim loại
Dãy hoạt động hóa học của kim loại. Hãy khám phá cùng chúng tôi qua nội dung chi tiết của bài viết dưới đây
Dãy hoạt động hóa học của kim loại là một bảng sắp xếp các kim loại theo thứ tự giảm dần khả năng phản ứng hóa học. Nó đóng vai trò quan trọng trong hóa học, giúp dự đoán khả năng xảy ra phản ứng giữa kim loại với các chất khác, từ đó ứng dụng vào nhiều lĩnh vực. Hãy khám phá cùng chúng tôi qua nội dung chi tiết của bài viết dưới đây
Dãy hoạt động hóa học của kim loại được hiểu như thế nào

Định nghĩa
Dãy hoạt động hóa học của kim loại là chuỗi các kim loại được sắp xếp theo thứ tự từ cao xuống thấp về khả năng phản ứng hóa học của chúng. Mức độ hoạt động hóa học của kim loại được đánh giá dựa trên khả năng khử ion kim loại thành kim loại và khả năng oxi hóa nguyên tử kim loại thành ion kim loại.
Cách sắp xếp kim loại trong dãy hoạt động hóa học:
- Kim loại đứng đầu dãy hoạt động hóa học là kim loại có tính khử mạnh nhất, kim loại đứng sau có tính khử yếu hơn.
- Kim loại có khả năng khử ion kim loại đứng sau trong dãy hoạt động hóa học.
- Kim loại không khử được ion kim loại đứng trước trong dãy hoạt động hóa học.
Dưới đây là dãy hoạt động hóa học của một số kim loại phổ biến:
K, Na, Ca, Mg, Al, Zn, Fe, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
Ý nghĩa dãy hoạt động hóa học của kim loại

Dãy hoạt động hóa học của kim loại là một công cụ quan trọng giúp ta hiểu và dự đoán các phản ứng hóa học của kim loại. Nó có nhiều ý nghĩa quan trọng như sau:
Dự đoán khả năng phản ứng của kim loại với các chất khác:
- Dựa vào dãy hoạt động hóa học, ta có thể dự đoán được khả năng phản ứng của kim loại với các chất khác như axit, dung dịch muối, nước, phi kim,…
- Kim loại đứng trước trong dãy hoạt động hóa học có khả năng khử ion kim loại đứng sau trong dãy.
- Kim loại không khử được ion kim loại đứng trước trong dãy.
Ví dụ:
Xác định thứ tự hoạt động hóa học của các kim loại:
- Dựa vào vị trí của kim loại trong dãy hoạt động hóa học, ta có thể xác định được thứ tự hoạt động hóa học của các kim loại.
- Kim loại đứng đầu dãy hoạt động hóa học có tính khử mạnh nhất, kim loại đứng sau có tính khử yếu hơn.
Giải thích các quy luật chung về phản ứng hóa học của kim loại:
- Dãy hoạt động hóa học giúp ta giải thích các quy luật chung về phản ứng hóa học của kim loại như:
- Quy luật kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của nó.
- Kim loại tác dụng với axit tạo thành muối và giải phóng khí hiđrô.
- Kim loại tác dụng với phi kim tạo thành hợp chất ion.
Quy luật về vị trí các kim loại trong dãy hoạt động hóa học
Dãy hoạt động hóa học của kim loại là dãy các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học của chúng. Mức độ hoạt động hóa học của kim loại được đánh giá dựa trên khả năng khử ion kim loại thành kim loại và khả năng oxi hóa nguyên tử kim loại thành ion kim loại.
Dựa vào vị trí của kim loại trong dãy hoạt động hóa học, ta có thể rút ra một số quy luật sau:
Mức độ hoạt động hóa học của kim loại giảm dần từ trái sang phải trong dãy.
Điều này có nghĩa là kim loại đứng đầu dãy hoạt động hóa học có tính khử mạnh nhất, kim loại đứng sau có tính khử yếu hơn.
Ví dụ:
- Kali (K) là kim loại có tính khử mạnh nhất trong dãy hoạt động hóa học.
- Vàng (Au) là kim loại có tính khử yếu nhất trong dãy hoạt động hóa học.
Kim loại đứng trước trong dãy hoạt động hóa học hơn kim loại đứng sau.
Điều này có nghĩa là kim loại đứng trước có thể khử ion kim loại đứng sau trong dung dịch muối của nó.
Ví dụ:
Kim loại có thể đẩy kim loại đứng sau ra khỏi dung dịch muối của nó.
Điều này chỉ xảy ra khi kim loại đứng trước có mặt trong dung dịch muối của kim loại đứng sau.
Ví dụ:
Quy tắc alpha (α) trong dãy hoạt động hóa học của kim loại
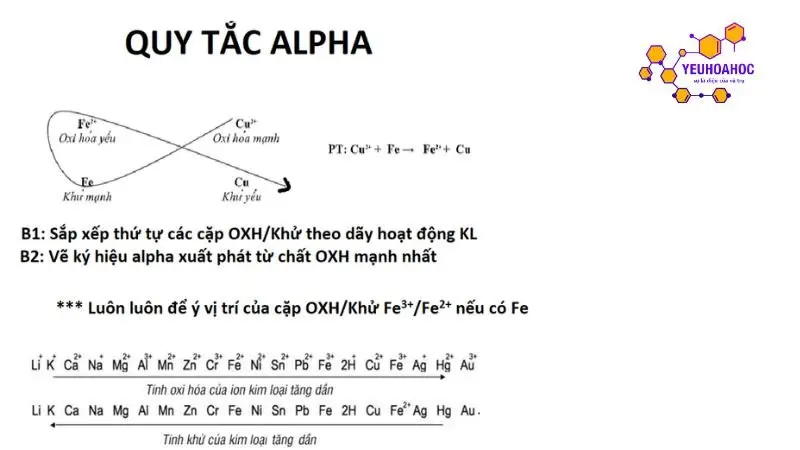
Quy tắc alpha (α) là quy tắc được sử dụng để dự đoán chiều của phản ứng hóa học giữa hai cặp oxi hóa – khử trong dãy hoạt động hóa học của kim loại. Quy tắc này dựa trên nguyên tắc sau:
Chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
Cách sử dụng quy tắc alpha:
- Xác định vị trí của hai kim loại tham gia phản ứng trong dãy hoạt động hóa học.
- So sánh vị trí của hai kim loại:
- Nếu kim loại đứng trước trong dãy hoạt động hóa học, nó sẽ oxi hóa kim loại đứng sau.
- Nếu hai kim loại đứng cạnh nhau trong dãy hoạt động hóa học, phản ứng có thể xảy ra hoặc không xảy ra. Cần xem xét thêm các yếu tố khác như nồng độ, nhiệt độ,… để xác định chính xác.
Ví dụ:
- Phản ứng xảy ra: Cho thanh kẽm (Zn) vào dung dịch CuSO4. Kẽm sẽ khử ion Cu2+ thành kim loại Cu và đẩy đồng ra khỏi dung dịch. (Zn đứng trước Cu trong dãy hoạt động hóa học)
- Phản ứng không xảy ra: Cho thanh sắt (Fe) vào dung dịch ZnSO4. Sắt không thể khử ion Zn2+ thành kim loại Zn. (Fe đứng sau Zn trong dãy hoạt động hóa học)
Ứng dụng của dãy hoạt động hóa học của kim loại
Lựa chọn kim loại phù hợp cho các mục đích sử dụng khác nhau:
- Dựa vào tính chất hóa học của kim loại, ta có thể lựa chọn kim loại phù hợp cho các mục đích sử dụng khác nhau.
- Ví dụ:
- Kim loại có tính khử mạnh (như Na, K, Mg) được sử dụng để sản xuất pin, pháo hoa.
- Kim loại có tính dẻo (như Al, Cu, Fe) được sử dụng để sản xuất dây điện, dụng cụ nấu nướng, xe cộ.
- Kim loại có tính chống ăn mòn tốt (như Au, Pt, Ag) được sử dụng để sản xuất trang sức, đồ trang trí.
Viết phương trình hóa học cho các phản ứng hóa học của kim loại:
- Dãy hoạt động hóa học giúp ta viết phương trình hóa học cho các phản ứng hóa học của kim loại một cách chính xác.
- Ví dụ:
Phản ứng giữa kim loại và axit:
Phản ứng giữa dung dịch muối và kim loại:
Giải thích các hiện tượng hóa học xảy ra trong thực tế:
- Dãy hoạt động hóa học giúp ta giải thích các hiện tượng hóa học xảy ra trong thực tế như:
- Sự ăn mòn kim loại: Kim loại bị ăn mòn do tác dụng với môi trường xung quanh, trong đó kim loại bị oxi hóa và tạo thành hợp chất ion.
- Sự điện phân: Dòng điện được sử dụng để đẩy kim loại ra khỏi dung dịch muối của nó.
- Sự han gỉ: Sắt bị han gỉ do tác dụng với oxy và hơi nước trong không khí.
Ngoài ra, dãy hoạt động hóa học của kim loại còn được sử dụng trong:
- Sản xuất hóa chất: Dựa vào dãy hoạt động hóa học, ta có thể lựa chọn phương pháp phù hợp để sản xuất hóa chất. Ví dụ, để sản xuất axit sunfuric, ta có thể sử dụng phản ứng giữa lưu huỳnh và Fe.
- Bảo vệ kim loại: Dãy hoạt động hóa học giúp ta lựa chọn phương pháp phù hợp để bảo vệ kim loại khỏi sự ăn mòn. Ví dụ, để bảo vệ sắt khỏi sự ăn mòn, ta có thể phủ lên bề mặt sắt một lớp kẽm (mạ kẽm).
Một vài ví dụ về việc sử dụng dãy hoạt động hóa học của kim loại
Sử dụng kim loại nhôm để khử oxit của một số kim loại khác:
- Dựa vào vị trí của nhôm và các kim loại khác trong dãy hoạt động hóa học, ta có thể biết được nhôm có thể khử oxit của các kim loại đứng sau nó trong dãy.
- Ví dụ:
Khử oxit sắt (Fe2O3) bằng nhôm:
Khử oxit đồng (CuO) bằng nhôm:
Dùng kim loại kẽm để tẩy rửa kim loại khỏi lớp gỉ:
- Kim loại kẽm có tính khử mạnh hơn sắt, do đó nó có thể khử ion Fe2+ trong lớp gỉ sắt thành kim loại sắt.
- Phương pháp này được gọi là mạ kẽm điện phân.
- Mạ kẽm giúp bảo vệ sắt khỏi sự ăn mòn.
Dùng kim loại sắt để sản xuất thép:
- Thép là hợp kim của sắt với cacbon và một số nguyên tố khác.
- Để sản xuất thép, người ta cho gang (hợp kim của sắt và cacbon) tác dụng với oxy trong lò luyện thép. Oxy sẽ khử bớt cacbon trong gang, tạo thành thép.
- Quá trình sản xuất thép cũng sử dụng một số kim loại khác như mangan, crom,… để tăng độ bền và độ dẻo cho thép.
Dãy hoạt động hóa học của kim loại là một công cụ thiết yếu cho người học hóa học và những ai làm việc trong lĩnh vực hóa học, luyện kim và khoa học vật liệu. Hiểu rõ dãy hoạt động này giúp ta giải thích, dự đoán và ứng dụng các phản ứng hóa học của kim loại một cách hiệu quả.







