Tinh thể phân tử: Cấu trúc, tính chất, ứng dụng và bài tập
Tinh thể phân tử được hiểu là gì? Cấy trúc tính chất ra sao, ứng dụng và bài tập như thế nào? Tất cả sẽ được giải đáp trong nội dung chi tiết của bài viết này!
Các tinh thể phân tử là nền tảng của nhiều tiến bộ khoa học và công nghệ hiện đại, từ màn hình điện thoại thông minh đến thuốc mới. Hãy cùng chúng tôi tìm hiểu cấu trúc độc đáo và vai trò của chúng trong các ứng dụng thực tế.
Giới thiệu về tinh thể phân tử
Định nghĩa:
Tinh thể phân tử là do các phân tử riêng lẻ liên kết với nhau bằng lực Van der Waals hoặc liên kết hydro, tạo thành mạng tinh thể theo trật tự nhất định. Các phân tử trong tinh thể phân tử không bị phá vỡ trong quá trình hình thành tinh thể.
Ví dụ:
Tầm quan trọng của tinh thể phân tử:
Trong hóa học:
- Giúp giải thích tính chất vật lý và hóa học của nhiều chất: Điểm nóng chảy, điểm sôi, độ tan, độ dẫn điện, …
- Là đơn vị cơ bản cấu tạo nên nhiều vật chất rắn: Kim loại, polime, …
- Tham gia vào các phản ứng hóa học: Phản ứng axit – bazơ, phản ứng oxy hóa – khử, …
Trong đời sống:
- Ứng dụng trong nhiều ngành công nghiệp: Sản xuất vật liệu, chế biến thực phẩm, y học, …
- Có vai trò quan trọng trong các hiện tượng tự nhiên: Sự hình thành tuyết, mây, nước đá, …
- Là thành phần thiết yếu của nhiều sản phẩm sinh hoạt: Nước uống, thực phẩm
Cấu trúc tinh thể phân tử
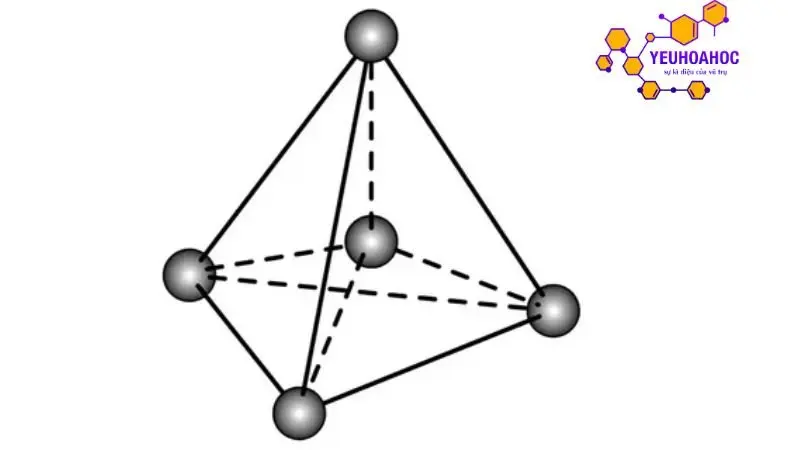
Khái niệm mạng tinh thể và ô mạng tinh thể
Mạng tinh thể: Là sự sắp xếp các điểm nút (vị trí các nguyên tử hoặc phân tử) trong không gian theo trật tự nhất định, tạo thành mạng lưới ba chiều.
Ô mạng tinh thể: Là đơn vị lặp lại cơ bản nhất của mạng tinh thể, được giới hạn bởi các đường thẳng nối các điểm nút kề nhau. Ô mạng tinh thể được xác định bởi các chiều dài cạnh và góc giữa các cạnh.
Các kiểu mạng tinh thể phân tử phổ biến
Mạng tinh thể lập phương đơn giản:
- Các điểm nút là các phân tử nằm ở các đỉnh và tâm các mặt của khối lập phương.
Ví dụ: NaCl, KCl, AgCl.
Mạng tinh thể lập phương tâm mặt:
- Các điểm nút là các phân tử nằm ở các đỉnh và tâm của khối lập phương, cùng với tâm của khối lập phương.
Mạng tinh thể lục giác:
- Các điểm nút là các phân tử xếp sát nhau theo hình lục giác.
- Ví dụ: Nước đá (lục giác đơn giản), Zn, Cd.
Mạng tinh thể lập phương tâm thể:
- Các điểm nút là các phân tử nằm ở tâm các mặt và tâm của khối lập phương.
Mối liên hệ giữa cấu trúc tinh thể và tính chất vật lý của tinh thể phân tử
Điểm nóng chảy và điểm sôi:
- Mạng tinh thể có lực liên kết mạnh hơn sẽ có điểm nóng chảy và điểm sôi cao hơn.
- Ví dụ: NaCl (mạng tinh thể lập phương đơn giản) có điểm nóng chảy cao hơn I2 (mạng tinh thể lập phương tâm thể).
Độ tan:
- Mạng tinh thể có lực liên kết yếu hơn sẽ dễ tan trong dung môi hơn.
- Ví dụ: Đường (mạng tinh thể lục giác) dễ tan trong nước hơn NaCl (mạng tinh thể lập phương đơn giản).
Dẻo, rắn:
- Mạng tinh thể có cấu trúc đối xứng cao sẽ dẻo hơn.
- Ví dụ: Kim loại (mạng tinh thể lập phương tâm mặt) dẻo hơn NaCl (mạng tinh thể lập phương đơn giản).
Tính chất lý học của tinh thể phân tử
Trạng thái:
- Tinh thể phân tử thường ở trạng thái rắn ở điều kiện nhiệt độ và áp suất thông thường.
- Một số tinh thể phân tử có thể chuyển sang trạng thái lỏng hoặc khí khi được nung nóng hoặc giảm áp suất.
- Ví dụ: Nước đá (rắn) ⇌ Nước (lỏng) ⇌ Hơi nước (khí)
Điểm nóng chảy và điểm sôi:
- Thấp hơn so với tinh thể ion do lực liên kết giữa các phân tử yếu hơn lực liên kết ion.
- Ví dụ:
Muối ăn (NaCl): Điểm nóng chảy 801°C, điểm sôi 1461°C.
Độ tan:
- Dễ tan trong dung môi không phân cực.
- Khó tan hoặc không tan trong dung môi phân cực.
- Ví dụ:
Đường (C12H22O11): Dễ tan trong nước (dung môi không phân cực).
Etanol (C2H5OH): Tan trong nước (dung môi không phân cực) và benzen (dung môi không phân cực).
Dầu ăn: Không tan trong nước (dung môi phân cực) nhưng tan trong benzen (dung môi không phân cực).
Độ cứng:
- Mềm, dễ vỡ do lực liên kết giữa các phân tử yếu.
- Dễ bị cắt, xé, dát mỏng.
- Ví dụ:
Bơ: Dễ bị cắt, xé.
I-ốt: Dễ bị nghiền thành bột mịn.
Dẫn điện:
- Không dẫn điện ở trạng thái rắn.
- Có thể dẫn điện ở trạng thái lỏng hoặc khí do có sự phân ly của các phân tử thành ion.
- Ví dụ:
Ứng dụng quan trọng của tinh thể phân tử
Trong lĩnh vực y học
Chế tạo thuốc:
- Một số loại thuốc được bào chế dưới dạng tinh thể phân tử để tăng độ tan, dễ hấp thu vào cơ thể và kiểm soát tốc độ giải phóng thuốc.
Sản xuất dụng cụ y tế:
- Một số dụng cụ y tế như ống nghiệm, pipet được làm từ tinh thể phân tử do có độ trong suốt, độ bền cao và dễ dàng khử trùng.
Ví dụ: Polymethylmethacrylate (PMMA), Polycarbonate (PC).
Chẩn đoán hình ảnh:
- Một số tinh thể phân tử được sử dụng trong kỹ thuật chụp X-quang, chụp MRI để tạo ra hình ảnh chi tiết của cơ thể.
Trong công nghiệp hóa chất
Sản xuất vật liệu:
- Tinh thể phân tử được sử dụng để sản xuất nhiều loại vật liệu như nhựa, cao su, sợi tổng hợp.
Ví dụ: Polyethylene (PE), Polyvinyl chloride (PVC), Nylon.
Chất xúc tác:
- Một số tinh thể phân tử được sử dụng làm chất xúc tác trong các phản ứng hóa học, giúp tăng tốc độ phản ứng và giảm tiêu hao năng lượng.
Chất hấp thụ:
- Một số tinh thể phân tử được sử dụng để hấp thụ các chất độc hại, khí ẩm hoặc các chất không mong muốn khác.
Trong lĩnh vực điện tử
Bán dẫn:
- Tinh thể silicon (Si) là vật liệu bán dẫn quan trọng được sử dụng để sản xuất chip điện tử, transistor và các linh kiện điện tử khác.
Chất cách điện:
- Một số tinh thể phân tử như Teflon (PTFE) được sử dụng làm chất cách điện do có độ bền cao, khả năng chống cháy và chống hóa chất tốt.
Màn hình tinh thể lỏng (LCD):
- Tinh thể phân tử được sử dụng trong màn hình LCD để tạo ra hình ảnh bằng cách thay đổi trạng thái phân cực của ánh sáng.
Nguyên tắc hoạt động của các ứng dụng:
- Tùy thuộc vào từng ứng dụng cụ thể mà nguyên tắc hoạt động sẽ khác nhau.
- Ví dụ:
- Trong trường hợp chế tạo thuốc, tinh thể phân tử được sử dụng để tăng độ tan, dễ hấp thu vào cơ thể và kiểm soát tốc độ giải phóng thuốc bằng cách điều chỉnh kích thước và hình dạng tinh thể.
- Trong trường hợp sản xuất vật liệu, tinh thể phân tử được liên kết với nhau bằng các lực liên kết hóa học hoặc lực liên kết vật lý để tạo thành vật liệu có độ bền cao, dẻo dai và có các tính chất mong muốn.
Ví dụ về các sản phẩm sử dụng tinh thể phân tử:
- Túi nilon: Được làm từ polyethylene (PE).
- Lốp xe: Được chế tạo từ cao su tổng hợp.
- Quần áo: Được làm từ sợi tổng hợp như polyester, nylon.
- Thuốc giảm đau: Aspirin (C9H8O4), Paracetamol (C8H9NO3).
- Ống nghiệm: Được làm từ polystyrene (PS).
- Chip điện tử: Được làm từ silicon (Si).
- Màn hình điện thoại thông minh: Màn hình LCD sử dụng tinh thể phân tử.
Phương pháp nghiên cứu tinh thể phân tử
Các phương pháp nghiên cứu phổ biến
Phương pháp nhiễu xạ tia X:
Nguyên tắc hoạt động: Tia X được chiếu vào mẫu tinh thể, các tia X bị nhiễu xạ bởi các nguyên tử trong tinh thể, tạo ra các vệt nhiễu xạ trên phim ảnh hoặc màn hình.
Ứng dụng:
- Xác định cấu trúc tinh thể (vị trí, khoảng cách giữa các nguyên tử).
- Nghiên cứu tính chất vật lý của tinh thể (điểm nóng chảy, độ cứng, …).
- Phân tích thành phần hóa học của tinh thể.
Phương pháp quang phổ:
Bao gồm:
- Quang phổ hồng ngoại (IR): Nghiên cứu cấu trúc và liên kết hóa học của các phân tử.
- Quang phổ Raman: Nghiên cứu cấu trúc và tính chất rung động của các phân tử.
- Quang phổ tử ngoại (UV-Vis): Nghiên cứu cấu trúc điện tử của các phân tử.
Nguyên tắc hoạt động: Mỗi loại quang phổ sử dụng một dải ánh sáng nhất định để tương tác với mẫu tinh thể, thông tin về cấu trúc và tính chất của tinh thể được thu thập từ các tín hiệu quang phổ.
Ứng dụng:
- Xác định cấu trúc và thành phần của tinh thể phân tử.
- Nghiên cứu các phản ứng hóa học xảy ra trong tinh thể.
- Xác định hàm lượng các chất trong hỗn hợp.
Phương pháp nhiệt phân tích:
Bao gồm:
- Phân tích nhiệt độ tan chảy (DSC): Xác định điểm nóng chảy và nhiệt độ chuyển pha của tinh thể.
- Phân tích nhiệt lượng (TGA): Xác định lượng nhiệt tỏa ra hoặc hấp thụ trong quá trình phân hủy tinh thể.
Nguyên tắc hoạt động: Ghi lại sự thay đổi nhiệt độ hoặc nhiệt lượng của mẫu tinh thể khi được nung nóng hoặc làm mát.
Ứng dụng:
- Nghiên cứu tính chất nhiệt của tinh thể phân tử.
- Xác định độ tinh khiết của tinh thể.
- Nghiên cứu tính ổn định nhiệt của vật liệu.
Một số thành tựu khoa học nổi bật:
- Giải mã cấu trúc DNA: Xác định cấu trúc xoắn kép của DNA, giúp mở đường cho nghiên cứu di truyền học và y học hiện đại.
- Phát triển các loại thuốc mới: Nhiều loại thuốc mới được phát triển dựa trên nghiên cứu cấu trúc và tính chất của tinh thể phân tử.
- Chế tạo các vật liệu mới: Nhiều loại vật liệu mới với tính năng ưu việt được chế tạo dựa trên nghiên cứu tinh thể phân tử.
- Phát triển các công nghệ mới: Nhiều công nghệ mới như in 3D, nano công nghệ được phát triển dựa trên nghiên cứu tinh thể phân tử.
Bài tập vận dụng của tinh thể phân tử
Bài tập: Tính toán khoảng cách giữa các ion trong tinh thể Natri Clorua (NaCl)
Đề bài: Natri Clorua (NaCl) tạo thành một tinh thể lập phương với mỗi ion natri (Na\(^+\)) được bao quanh bởi sáu ion clorua (Cl\(^-\)) và ngược lại. Giả sử rằng bán kính ion natri là 102 pm và bán kính ion clorua là 181 pm. Tính khoảng cách giữa các ion Na\(^+\) và Cl\(^-\) trong tinh thể.
Lời giải:
Bước 1: Xác định bán kính của mỗi ion
Bán kính ion Na\(^+\):
\[ r_{\text{Na}} = 102 \, \text{pm} \]
Bán kính ion Cl\(^-\):
\[ r_{\text{Cl}} = 181 \, \text{pm} \]
Bước 2: Tính khoảng cách giữa các ion
Trong tinh thể NaCl, khoảng cách giữa các ion là tổng bán kính của ion Na\(^+\) và ion Cl\(^-\) vì tinh thể này có cấu trúc lập phương trong đó các ion xếp sát nhau.
\[ d = r_{\text{Na}} + r_{\text{Cl}} \]
\[ d = 102 \, \text{pm} + 181 \, \text{pm} \]
\[ d = 283 \, \text{pm} \]
Bước 3: Chuyển đổi đơn vị từ picometre sang mét
Để có cái nhìn rõ ràng hơn về khoảng cách này ở đơn vị chuẩn, chúng ta chuyển đổi picometre sang mét.
\[ d = 283 \, \text{pm} = 283 \times 10^{-12} \, \text{m} \]
Kết luận
Khoảng cách giữa các ion Na\(^+\) và Cl\(^-\) trong tinh thể natri clorua là 283 pm, tương đương với \(2.83 \times 10^{-10}\) m. Điều này giúp hiểu rõ hơn về cấu trúc không gian của tinh thể muối ăn, cũng như tương tác giữa các ion trong tinh thể.
Việc nghiên cứu tinh thể phân tử không chỉ mở ra những hiểu biết mới về thế giới vật chất mà còn hướng đến các giải pháp sáng tạo cho thách thức trong y tế và công nghệ. Các tinh thể phân tử tiếp tục là chìa khóa cho những đột phá trong tương lai.







