Tinh thể nguyên tử: Khái niệm, cấu trúc, tính chất và bài tập
Hãy cùng chúng tôi khám phá về tinh thể nguyên tử giúp hiểu rõ hơn về các đặc tính vật lý và hóa học của vật liệu.
Tinh thể nguyên tử là dạng cấu trúc quan trọng trong khoa học, nơi các nguyên tử sắp xếp theo trật tự nhất định. Hãy cùng chúng tôi khám phá về tinh thể nguyên tử giúp hiểu rõ hơn về các đặc tính vật lý và hóa học của vật liệu.
Tinh thể nguyên tử là gì?

Định nghĩa
Tinh thể nguyên tử là những chất rắn được cấu tạo từ các nguyên tử được sắp xếp một cách đều đặn và trật tự trong không gian, tạo thành mạng tinh thể. Ở các nút mạng tinh thể, Các nguyên tử kết nối với nhau thông qua liên kết cộng hóa trị tạo nên cấu trúc vững chắc cho tinh thể.
Đặc điểm
Cấu tạo:
- Gồm các nguyên tử được sắp xếp theo mạng tinh thể.
- Các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị.
Tính chất:
- Rắn, chắc, có nhiệt độ nóng chảy và nhiệt độ sôi cao.
- Dẫn điện và nhiệt tốt.
- Không tan trong nước.
- Có tính giòn.
Ví dụ: Kim cương, Silic, Ge, …
So sánh tinh thể nguyên tử với các loại tinh thể khác
| Đặc điểm | Tinh thể nguyên tử | Tinh thể phân tử | Tinh thể phi kim loại |
| Cấu tạo | Các nguyên tử | Các phân tử | Các nguyên tử |
| Liên kết | Liên kết cộng hóa trị | Lực tương tác van der Waals | Lực liên kết kim loại |
| Tính chất | Rắn, chắc, nhiệt độ nóng chảy cao, dẫn điện, nhiệt tốt, không tan trong nước, giòn | Mềm, nhiệt độ nóng chảy thấp, dễ tan chảy, cách điện, cách nhiệt, tan trong dung môi | Dẫn điện, dẫn nhiệt, dẻo, có ánh kim |
| Ví dụ | Kim cương, Silic, Ge | Iod, Nước đá | Đồng, Vàng, Nhôm |
Giải thích
Sự khác biệt giữa tinh thể nguyên tử và tinh thể phân tử:
- Cấu tạo: Tinh thể nguyên tử do các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị, trong khi tinh thể phân tử do các phân tử liên kết với nhau bằng lực tương tác van der Waals.
- Tính chất: Tinh thể nguyên tử rắn, chắc, nhiệt độ nóng chảy cao, dẫn điện, nhiệt tốt, không tan trong nước, giòn. Tinh thể phân tử mềm, nhiệt độ nóng chảy thấp, dễ tan chảy, cách điện, cách nhiệt, tan trong dung môi.
Sự khác biệt giữa tinh thể nguyên tử và tinh thể phi kim loại:
- Cấu tạo: Tinh thể nguyên tử do các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị, trong khi tinh thể phi kim loại do các nguyên tử liên kết với nhau bằng lực liên kết kim loại.
- Tính chất: Tinh thể nguyên tử rắn, chắc, nhiệt độ nóng chảy cao, dẫn điện, nhiệt tốt, không tan trong nước, giòn. Tinh thể phi kim loại dẫn điện, dẫn nhiệt, dẻo, có ánh kim.
Cấu trúc tinh thể nguyên tử
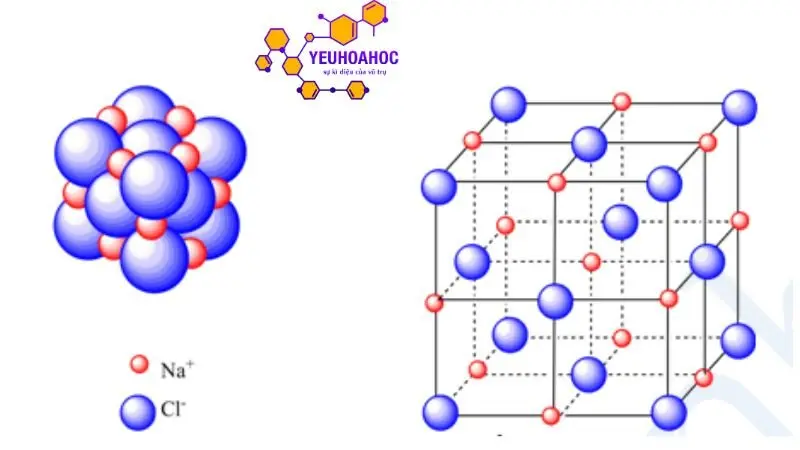
Mô tả cấu trúc mạng tinh thể nguyên tử
Mạng tinh thể nguyên tử được hình thành bởi sự sắp xếp đều đặn và trật tự của các nguyên tử trong không gian. Các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị, tạo thành các mắt lưới tinh thể. Mỗi mắt lưới tinh thể được xác định bởi các yếu tố sau:
- Mắt lưới tinh thể: Là đơn vị cơ bản lặp lại trong mạng tinh thể. Mắt lưới tinh thể được tạo thành bởi các nguyên tử ở các vị trí nút mạng.
- Bán kính nguyên tử (r): Là khoảng cách từ hạt nhân đến điểm xa nhất trên đám mây electron của nguyên tử.
- Số phối hợp (CN): Là số nguyên tử liên kết trực tiếp với một nguyên tử trong mạng tinh thể.
- Kiểu mạng tinh thể: Được xác định bởi hình dạng và cách sắp xếp các mắt lưới tinh thể trong không gian.
Ví dụ:
- Mạng tinh thể lập phương kim cương:
- Mắt lưới tinh thể: Tứ diện đều.
- Bán kính nguyên tử cacbon (r): 0,154 nm.
- Số phối hợp (CN): 4.
- Kiểu mạng tinh thể: Lập phương.
Giải thích các khái niệm
- Mắt lưới tinh thể: Là đơn vị cơ bản lặp lại trong mạng tinh thể, được tạo thành bởi các nguyên tử ở các vị trí nút mạng. Ví dụ: Tứ diện đều trong mạng tinh thể Kim cương.
- Bán kính nguyên tử (r): Là khoảng cách từ hạt nhân đến điểm xa nhất trên đám mây electron của nguyên tử. Ví dụ: Bán kính nguyên tử cacbon trong Kim cương là 0,154 nm.
- Số phối hợp (CN): Là số nguyên tử liên kết trực tiếp với một nguyên tử trong mạng tinh thể. Ví dụ: Số phối hợp của nguyên tử cacbon trong Kim cương là 4.
- Kiểu mạng tinh thể: Được xác định bởi hình dạng và cách sắp xếp các mắt lưới tinh thể trong không gian. Ví dụ: Mạng tinh thể lập phương Kim cương.
Ý nghĩa
Cấu trúc mạng tinh thể nguyên tử quyết định các tính chất vật lý và hóa học của tinh thể. Ví dụ:
- Tính rắn chắc: Do sự liên kết cộng hóa trị mạnh giữa các nguyên tử trong mạng tinh thể.
- Nhiệt độ nóng chảy và nhiệt độ sôi cao: Do cần cung cấp nhiều năng lượng để phá vỡ các liên kết cộng hóa trị.
- Dẫn điện và nhiệt: Do các electron tự do có thể di chuyển trong mạng tinh thể.
Tính chất của tinh thể nguyên tử

Các tính chất cơ bản:
- Độ cứng: Tinh thể nguyên tử thường có độ cứng cao do các nguyên tử được liên kết với nhau bằng liên kết cộng hóa trị mạnh. Ví dụ: Kim cương là chất rắn cứng nhất trong tự nhiên.
- Nhiệt độ nóng chảy và nhiệt độ sôi cao: Do cần cung cấp nhiều năng lượng để phá vỡ các liên kết cộng hóa trị mạnh giữa các nguyên tử. Ví dụ: Wolfram có nhiệt độ nóng chảy cao nhất trong các kim loại (3422°C).
- Tính dẫn điện:
- Dẫn điện tốt: Một số tinh thể nguyên tử có các electron tự do có thể di chuyển trong mạng tinh thể, dẫn đến khả năng dẫn điện tốt. Ví dụ: Đồng, Nhôm.
- Cách điện: Một số tinh thể nguyên tử không có electron tự do, do đó là chất cách điện. Ví dụ: Kim cương.
- Tính dẫn nhiệt: Do sự va chạm và truyền năng lượng giữa các nguyên tử trong mạng tinh thể. Ví dụ: Bạc là kim loại dẫn nhiệt tốt nhất.
Giải thích nguyên nhân:
- Độ cứng và nhiệt độ nóng chảy, nhiệt độ sôi cao: Do các nguyên tử được liên kết với nhau bằng liên kết cộng hóa trị mạnh, cần nhiều năng lượng để phá vỡ các liên kết này.
- Tính dẫn điện:
- Dẫn điện tốt: Các electron tự do trong mạng tinh thể có thể di chuyển dưới tác dụng của điện trường, dẫn đến dòng điện.
- Cách điện: Không có electron tự do, do đó không thể dẫn điện.
- Tính dẫn nhiệt: Năng lượng nhiệt được truyền qua mạng tinh thể do sự va chạm và truyền năng lượng giữa các nguyên tử.
Ví dụ:
- Độ cứng cao: Kim cương, Silic, …
- Nhiệt độ nóng chảy, nhiệt độ sôi cao: Wolfram, Silic carbide, …
- Dẫn điện tốt: Đồng, Nhôm, Vàng, …
- Cách điện: Kim cương, Silic, …
- Dẫn nhiệt tốt: Bạc, Đồng, Nhôm, …
Ứng dụng của tinh thể nguyên tử
Tinh thể nguyên tử sở hữu những tính chất đặc trưng như độ cứng cao, nhiệt độ nóng chảy và nhiệt độ sôi cao, tính dẫn điện và tính dẫn nhiệt, … Nhờ vậy, chúng được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau.
Sản xuất kim loại:
- Quá trình luyện kim: Tinh thể kim loại được sử dụng trong quá trình luyện kim để tạo ra các kim loại có độ bền cao, khả năng chống gỉ sét tốt và dễ gia công. Ví dụ: Thép, Nhôm, Đồng.
- Hợp kim: Tinh thể nguyên tử của các kim loại khác nhau được kết hợp để tạo thành hợp kim có tính chất ưu việt hơn so với kim loại nguyên chất. Ví dụ: Thép không gỉ, Hợp kim nhôm – magiê.
Điện tử:
- Bán dẫn: Tinh thể Silic được sử dụng để chế tạo các linh kiện bán dẫn như diode, transistor, … là nền tảng cho sự phát triển của ngành công nghiệp điện tử hiện đại.
- Chip Silic: Chip Silic là bộ não của các thiết bị điện tử như máy tính, điện thoại thông minh, … được tạo thành từ tinh thể Silic cao tinh khiết.
Quang học:
- Laser: Tinh thể nguyên tử như Ruby, Sapphire được sử dụng để chế tạo laser với khả năng phát ra chùm sáng mạnh, đơn sắc và định hướng. Laser được ứng dụng rộng rãi trong nhiều lĩnh vực như y học, gia công vật liệu, …
- Ống kính quang học: Tinh thể nguyên tử như Fluorite, Calcite được sử dụng để chế tạo ống kính quang học có độ phân giải cao, độ méo thấp và khả năng truyền sáng tốt. Ống kính quang học được sử dụng trong máy ảnh, kính viễn vọng, …
Nguyên tắc hoạt động:
- Sản xuất kim loại: Tính chất dẫn điện và nhiệt của tinh thể kim loại giúp điều khiển quá trình nung chảy và gia công kim loại.
- Điện tử: Tính chất bán dẫn của Silic giúp điều khiển dòng điện trong các linh kiện bán dẫn.
- Quang học: Tính chất khúc xạ ánh sáng của tinh thể nguyên tử giúp tạo ra chùm sáng laser hoặc hình ảnh sắc nét trong ống kính quang học.
Ví dụ:
- Sản phẩm, thiết bị: Thép không gỉ, máy tính, điện thoại thông minh, laser y tế, ống kính máy ảnh, …
- Chất liệu: Kim cương, Silic, Gallium Arsenide, …
Cách tính thể tích nguyên tử
Bài 1: Tính thể tích nguyên tử Đồng (Cu)
Giải:
Bước 1: Chuyển đổi đơn vị
Đầu tiên, chuyển đổi bán kính nguyên tử từ picometers sang meters.
\[ r = 128 \, \text{pm} = 128 \times 10^{-12} \, \text{m} \]
Bước 2: Áp dụng công thức thể tích hình cầu
Thể tích \( V \) của một hình cầu được tính bằng công thức:
\[ V = \frac{4}{3} \pi r^3 \]
Thay số vào công thức:
\[ V = \frac{4}{3} \pi (128 \times 10^{-12})^3 \]
Bước 3: Tính toán
Thực hiện phép tính:
\[ V = \frac{4}{3} \pi (2.097152 \times 10^{-33}) \]
\[ V \approx \frac{4}{3} \times 3.1416 \times 2.097152 \times 10^{-33} \]
\[ V \approx 8.792 \times 10^{-33} \, \text{m}^3 \]
Kết luận
Thể tích của một nguyên tử đồng là khoảng \(8.792 \times 10^{-33} \, \text{m}^3\).
Bài 2: Tính thể tích nguyên tử Natri (Na)
Bán kính nguyên tử Na: \( r = 1.09 \times 10^{-10} \, \text{m} \)
Thể tích nguyên tử Na:
\[ V = \frac{4}{3} \pi (1.09 \times 10^{-10} \, \text{m})^3 \approx 1.15 \times 10^{-23} \, \text{m}^3 \]
Bài 3: Tính thể tích nguyên tử Sắt (Fe)
Khối lượng mol Fe: \( M = 55.85 \, \text{g/mol} \)
Khối lượng riêng Fe: \( \rho = 7870 \, \text{g/m}^3 \) (đã chuyển đổi)
Thể tích nguyên tử Fe:
\[ V = \frac{M}{\rho \cdot N_A} \approx \frac{55.85}{7870} \times \frac{1}{6.022 \times 10^{23}} \approx 2.27 \times 10^{-23} \, \text{m}^3 \]
Thế giới tinh thể nguyên tử là một lĩnh vực khoa học đầy hấp dẫn, mở ra cánh cửa dẫn đến những khám phá khoa học đột phá và ứng dụng công nghệ tiên tiến. Việc nghiên cứu và ứng dụng tinh thể nguyên tử hứa hẹn mang lại những lợi ích to lớn cho con người trong nhiều lĩnh vực, từ y học, vật liệu khoa học đến năng lượng.







