Tinh thể ion: Định nghĩa, đặc tính và phương pháp điều chế
Tinh thể ion được định nghĩa như thế nào? Đặc tính, cấu trúc và phương pháp điều chế ra sao? Hãy cùng chúng tôi tìm hiểu ngay dưới bài viết sau đây
Bước vào thế giới vi mô kỳ diệu của tinh thể ion – Nơi lực hút tĩnh điện kết nối các ion trái dấu, tạo nên những cấu trúc tinh thể độc đáo và mang đến vô số ứng dụng quan trọng. Tinh thể ion là một phần thiết yếu trong khoa học vật liệu, đóng vai trò then chốt trong nhiều lĩnh vực như sản xuất pin, gốm sứ, chất bán dẫn,… Bài viết này, yeuhoahoc.edu.vn sẽ đưa bạn đi sâu vào khám phá thế giới fascinant của tinh thể ion, từ cấu tạo đến đặc tính, ứng dụng và tác động của chúng.
Định nghĩa và cấu tạo tinh thể ion
Tinh thể ion là những hợp chất ion ở trạng thái rắn, được cấu tạo bởi các ion dương (cation) và ion âm (anion) liên kết với nhau bằng lực hút tĩnh điện mạnh, tạo thành mạng tinh thể đều đặn, rắn chắc.
Phân biệt tinh thể ion với các loại tinh thể khác:
| Loại tinh thể | Đặc điểm | Ví dụ |
| Tinh thể ion | – Được cấu tạo bởi các ion. – Liên kết giữa các ion bằng lực hút tĩnh điện. – Rắn chắc, có độ cứng và độ bền cao. – Dẫn điện kém. – Chịu nhiệt cao, khó nóng chảy. – Tan nhiều trong nước. | NaCl, CaSO4, CaCO3 |
| Tinh thể nguyên tử | – Được cấu tạo bởi các nguyên tử. – Liên kết giữa các nguyên tử bằng liên kết cộng hóa trị hoặc liên kết kim loại. – Tồn tại ở trạng thái rắn, lỏng hoặc khí. – Có thể dẫn điện tốt hoặc kém. – Nhiệt độ nóng chảy và nhiệt độ sôi thay đổi tùy loại. – Khả năng tan trong nước khác nhau. | Kim loại (Fe, Cu, Al), kim cương, than chì |
| Tinh thể phân tử | – Được cấu tạo bởi các phân tử. – Liên kết giữa các phân tử bằng lực van der Waals hoặc liên kết hidro. – Tồn tại ở cả 3 thể rắn, lỏng hoặc khí. – Thường dẫn điện kém. – Nhiệt độ sôi và nóng chảy thấp. – Dễ tan chảy. | Nước đá, đường, I2 |
Cấu trúc tinh thể ion:
- Mạng lưới ion: Các ion trong tinh thể ion được sắp xếp theo một trật tự nhất định trong không gian, tạo thành mạng tinh thể. Mạng tinh thể có dạng ba chiều, được hình thành bởi sự lặp đi lặp lại của các ô cơ sở. Ô cơ sở là đơn vị cấu trúc nhỏ nhất của mạng tinh thể, chứa một số lượng nhất định các ion có cùng tỉ lệ số lượng và kiểu ion.
- Lực hút tĩnh điện giữa các ion: Lực hút tĩnh điện giữa các ion trái dấu liên kết chúng lại với nhau. Lực hút tĩnh điện này càng mạnh thì tinh thể ion càng rắn chắc, có độ cứng và độ bền cao hơn.
Đặc tính của tinh thể ion
Tính chất vật lý
- Trạng thái rắn: Ở điều kiện thường, tinh thể ion tồn tại ở trạng thái rắn với cấu trúc mạng tinh thể dạng lập phương, lục giác hoặc bát diện.
- Dạng tinh thể: Tinh thể ion thường có dạng khối, mảnh vụn hoặc dạng bột.
- Nhiệt độ nóng chảy và sôi cao: Do lực hút tĩnh điện mạnh giữa các ion trái dấu, tinh thể ion cần nhiều năng lượng để phá vỡ mạng lưới ion, dẫn đến nhiệt độ sôi và nóng chảy cao. Ví dụ, NaCl có nhiệt độ nóng chảy 801°C và nhiệt độ sôi 1461°C.
- Độ cứng và độ giòn: Tinh thể ion thường cứng và giòn do lực hút tĩnh điện mạnh giữ các ion trong mạng tinh thể. Khi va đập, các ion có thể bị dịch chuyển, dẫn đến gãy vỡ tinh thể.
- Khả năng dẫn điện: Khi tan trong nước hoặc nóng chảy, tinh thể ion phân ly thành các ion, tạo khả năng dẫn điện cho dung dịch. Tuy nhiên, ở trạng thái rắn, tinh thể ion dẫn điện kém do các ion cố định trong mạng tinh thể.
Tính chất hóa học
- Tính tan trong nước: Hầu hết tinh thể ion tan trong nước do có thể tương tác với các phân tử nước lưỡng cực. Nước hòa tan tinh thể ion bằng cách thu hút các ion, phá vỡ mạng lưới tinh thể.
- Phản ứng hóa học: Tinh thể ion tham gia phản ứng hóa học thông qua sự trao đổi ion giữa các dung dịch. Ví dụ, phản ứng trung hòa axit – bazơ: NaOH + HCl → NaCl + H2O.
Giải thích các đặc tính dựa trên cấu tạo:
- Cấu trúc mạng tinh thể: Các ion trong tinh thể ion được sắp xếp theo mạng tinh thể đều đặn, tạo nên lực hút tĩnh điện mạnh giữa các ion trái dấu. Lực hút tĩnh điện này chi phối hầu hết các đặc tính của tinh thể ion.
- Sự có mặt của các ion: Các ion trong tinh thể ion có kích thước và điện tích khác nhau, dẫn đến sự khác biệt về tính chất vật lý và hóa học. Ví dụ, ion với kích thước lớn hơn thường có nhiệt độ nóng chảy và sôi thấp hơn.
So sánh với các loại tinh thể khác:
| Đặc tính | Tinh thể ion | Tinh thể kim loại | Tinh thể cộng hóa trị |
| Trạng thái | Rắn | Rắn, lỏng | Rắn |
| Dạng tinh thể | Khối, mảnh vụn, bột | Khối, lá | Khối, mảnh vụn, tinh thể |
| Nhiệt độ nóng chảy, sôi | Cao | Thấp | Trung bình |
| Độ cứng, độ giòn | Cứng, giòn | Mềm, dẻo | Cứng, giòn |
| Khả năng dẫn điện | Kém (rắn), tốt (nóng chảy, dung dịch) | Tốt | Kém |
| Tan trong nước | Tan nhiều | Không tan | Tan ít |
| Phản ứng hóa học | Trao đổi ion | Phản ứng hóa học | Phản ứng cộng hóa trị |
Phân loại tinh thể ion
Phân loại theo thành phần cấu tạo:
- Tinh thể ion đơn chất: Được tạo thành từ một loại ion duy nhất. Ví dụ: NaCl (muối ăn), CaO (vôi sống).
- Tinh thể ion kép: Được tạo thành từ hai loại ion khác nhau. Ví dụ: MgCl2 (magie clorua), BaSO4 (bari sunfat).
Phân loại theo cấu trúc mạng lưới:
- Cấu trúc NaCl: Là cấu trúc phổ biến nhất, các ion được sắp xếp theo kiểu lập phương, mỗi ion được bao quanh bởi 6 ion khác có điện tích trái dấu. Ví dụ: NaCl, KCl, AgBr.
- Cấu trúc ZnS: Các ion được sắp xếp theo kiểu tứ diện, mỗi ion được bao quanh bởi 4 ion khác có điện tích trái dấu. Ví dụ: ZnS, CdS, HgS.
- Cấu trúc Wurtzite: Giống cấu trúc ZnS nhưng các ion xếp xen kẽ nhau theo chiều dọc trục c. Ví dụ: ZnO, BeO, CdSe.
Cơ sở khoa học cho việc phân loại:
- Thành phần cấu tạo: Dựa vào số lượng loại ion trong tinh thể.
- Cấu trúc mạng lưới: Dựa vào cách sắp xếp các ion trong mạng tinh thể.
Ví dụ:
- Tinh thể NaCl là tinh thể ion đơn chất có cấu trúc NaCl.
- Tinh thể MgCl2 là tinh thể ion kép có cấu trúc NaCl.
- Tinh thể ZnS là tinh thể ion đơn chất có cấu trúc ZnS.
Phương pháp điều chế tinh thể ion

Phương pháp làm nguội dung dịch bão hòa
Mô tả:
- Hòa tan một lượng lớn hợp chất ion vào nước nóng cho đến khi dung dịch bão hòa (không thể hòa tan thêm chất tan).
- Để dung dịch nguội dần theo nhiệt độ phòng hoặc trong tủ lạnh.
- Khi dung dịch nguội, độ tan của chất tan giảm, dẫn đến kết tinh và hình thành tinh thể ion.
Nguyên tắc khoa học:
- Độ tan của chất tan trong nước tăng theo nhiệt độ.
- Khi dung dịch nguội, độ tan giảm, dẫn đến kết tinh.
- Tốc độ hình thành tinh thể phụ thuộc vào tốc độ làm nguội dung dịch. Làm nguội chậm thường tạo ra tinh thể lớn hơn và hoàn hảo hơn.
Phương pháp kết tủa
Mô tả:
- Cho hai dung dịch chứa các ion trái dấu nhau phản ứng với nhau.
- Sản phẩm tạo thành là kết tủa, có thể là tinh thể ion.
- Lọc kết tủa, rửa sạch và sấy khô để thu được tinh thể ion.
Nguyên tắc khoa học:
- Khi hai dung dịch chứa các ion trái dấu nhau phản ứng, các ion trái dấu kết hợp với nhau tạo thành kết tủa.
- Kích thước và hình dạng của tinh thể kết tủa phụ thuộc vào nhiều yếu tố, bao gồm nồng độ dung dịch, tốc độ phản ứng, v.v.
Phương pháp thăng hoa
Mô tả:
- Nung nóng hợp chất ion đến nhiệt độ cao hơn nhiệt độ thăng hoa của nó.
- Hơi của hợp chất ion bay lên và bám vào thành bình lạnh hơn, tạo thành tinh thể.
Nguyên tắc khoa học:
- Ở nhiệt độ cao, một số chất có thể chuyển trực tiếp từ trạng thái rắn sang trạng thái khí mà không qua trạng thái lỏng (thăng hoa).
- Khi hơi của hợp chất ion tiếp xúc với thành bình lạnh, nó sẽ ngưng tụ và hình thành tinh thể.
Quy trình hình thành tinh thể ion
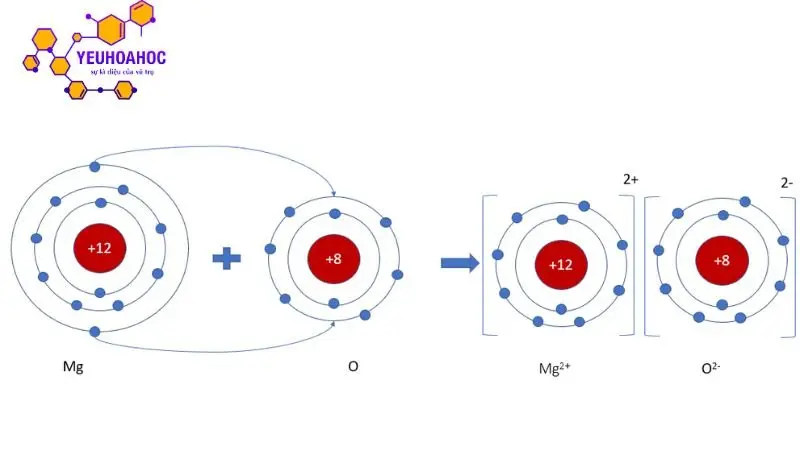
Quá trình hình thành tinh thể ion
Tinh thể ion được hình thành thông qua một loạt các bước sau:
Bước 1: Ion hóa:
- Các nguyên tử kim loại mất electron để trở thành ion dương (cation).
- Các nguyên tử phi kim nhận electron để trở thành ion âm (anion).
- Quá trình ion hóa xảy ra do lực hút tĩnh điện giữa các hạt nhân nguyên tử và electron.
Bước 2: Hình thành liên kết ion:
- Các ion trái dấu hút nhau bằng lực hút tĩnh điện mạnh.
- Lực hút tĩnh điện này cân bằng với lực đẩy tĩnh điện giữa các ion cùng dấu, dẫn đến sự sắp xếp các ion theo mạng tinh thể.
- Mạng tinh thể ion thường có cấu trúc lập phương, lục giác hoặc bát diện.
Bước 3: Phát triển tinh thể:
- Các ion tiếp tục kết hợp với nhau để tạo thành các cụm ion nhỏ.
- Các cụm ion nhỏ liên kết với nhau để tạo thành tinh thể ion lớn hơn.
- Quá trình này diễn ra liên tục cho đến khi tất cả các ion được sử dụng để tạo thành tinh thể.
Các yếu tố ảnh hưởng đến quá trình hình thành tinh thể ion
- Bản chất của các ion: Kích thước, điện tích và độ âm điện của các ion ảnh hưởng đến lực hút tĩnh điện giữa chúng, từ đó ảnh hưởng đến kích thước, hình dạng và tính chất của tinh thể ion.
- Nồng độ dung dịch: Nồng độ dung dịch cao sẽ tạo ra nhiều ion hơn, dẫn đến tốc độ hình thành tinh thể nhanh hơn và kích thước tinh thể lớn hơn.
- Nhiệt độ: Nhiệt độ cao làm tăng độ tan của chất tan, từ đó ảnh hưởng đến tốc độ hình thành tinh thể.
- Tốc độ làm nguội: Tốc độ làm nguội dung dịch ảnh hưởng đến kích thước và hình dạng của tinh thể ion. Làm nguội chậm thường tạo ra tinh thể lớn hơn và hoàn hảo hơn.
- Chất phụ gia: Một số chất phụ gia có thể ảnh hưởng đến tốc độ hình thành tinh thể và kích thước của tinh thể ion.
Ví dụ
Quá trình hình thành tinh thể muối ăn (NaCl) là một ví dụ điển hình về quá trình hình thành tinh thể ion.
- Bước 1: Nguyên tử natri (Na) mất 1 electron để trở thành ion Na+ và nguyên tử clo (Cl) nhận 1 electron để trở thành ion Cl-.
- Bước 2: Các ion Na+ và Cl- hút nhau bằng lực hút tĩnh điện mạnh và sắp xếp theo mạng tinh thể lập phương.
- Bước 3: Các ion Na+ và Cl- tiếp tục kết hợp với nhau để tạo thành các cụm ion nhỏ, sau đó liên kết với nhau để tạo thành tinh thể NaCl lớn hơn.
Ứng dụng của tinh thể ion

Sản xuất vật liệu bán dẫn
- Tính chất: Tinh thể ion có khả năng dẫn điện tốt khi ở trạng thái nóng chảy hoặc dung dịch, nhưng dẫn điện kém khi ở trạng thái rắn.
- Nguyên lý hoạt động: Do cấu trúc mạng tinh thể dạng ion, các ion trong tinh thể ion có thể di chuyển khi được cung cấp năng lượng, tạo ra dòng điện.
- Ví dụ: Silicon (Si) và Germanium (Ge) là những tinh thể ion được sử dụng phổ biến trong sản xuất vật liệu bán dẫn, đóng vai trò quan trọng trong sản xuất transistor, diode, mạch tích hợp,…
Pin điện
- Tính chất: Một số tinh thể ion có khả năng phản ứng hóa học tạo ra dòng điện.
- Nguyên lý hoạt động: Trong pin điện, tinh thể ion đóng vai trò là chất điện ly, cung cấp môi trường cho các ion di chuyển và tạo ra dòng điện.
- Ví dụ: Pin Lithium-ion (Li-ion) sử dụng hợp chất LiCoO2 làm cathode và graphite làm anode, pin Natri-ion (Na-ion) sử dụng hợp chất Na3V2(PO4)3 làm cathode và than chì làm anode.
Gốm sứ
- Tính chất: Tinh thể ion có độ cứng, độ bền cao và khả năng chịu nhiệt tốt.
- Nguyên lý hoạt động: Tinh thể ion được sử dụng làm nguyên liệu chính để sản xuất gốm sứ, tạo nên độ cứng, độ bền và khả năng chịu nhiệt cho các sản phẩm gốm sứ.
- Ví dụ: Sứ, gạch men, đồ trang trí gốm sứ,…
Chất xúc tác
- Tính chất: Một số tinh thể ion có khả năng xúc tác cho các phản ứng hóa học.
- Nguyên lý hoạt động: Tinh thể ion cung cấp bề mặt cho các phản ứng hóa học xảy ra, tăng tốc độ phản ứng và giảm năng lượng kích hoạt.
- Ví dụ: Zeolit được sử dụng làm chất xúc tác trong nhiều ngành công nghiệp, bao gồm lọc dầu, hóa chất và sản xuất thực phẩm.
Tinh thể ion – Kỳ quan của tự nhiên ẩn chứa tiềm năng to lớn trong khoa học và kỹ thuật. Hiểu rõ về tinh thể ion giúp chúng ta khai thác tối ưu lợi ích và ứng dụng của chúng, đồng thời góp phần phát triển khoa học kỹ thuật và nâng cao chất lượng cuộc sống. Hãy cùng khám phá thêm nhiều điều thú vị về tinh thể ion và mở rộng kiến thức hóa học của bạn!







