Khái niệm và bản chất của phản ứng hóa học
Khám phá sâu về phản ứng hóa học: khái niệm, phân loại và ứng dụng, cơ chế và ảnh hưởng của chúng trong cuộc sống hàng ngày và các ứng dụng công nghiệp.
Phản ứng hóa học là trái tim của nhiều quá trình tự nhiên và công nghệ, từ quang hợp đến sản xuất thuốc. Bài viết này, yeuhoahoc.edu.vn sẽ giúp bạn hiểu rõ hơn về cơ chế và tầm quan trọng của các phản ứng hóa học trong thế giới hiện đại.
Khái niệm và bản chất của phản ứng hóa học

Khái niệm về Phản ứng hóa học
Phản ứng hóa học:
- Là quá trình mà các chất tham gia (chất đầu vào) biến đổi thành các chất mới (sản phẩm) có tính chất khác hẳn với chất ban đầu.
- Có sự thay đổi về thành phần cấu tạo của chất, tức là sự thay đổi về bản chất hóa học.
- Ví dụ: đốt cháy than, đun sôi nước, tiêu hóa thức ăn.
Phân biệt phản ứng hóa học với hiện tượng vật lí
Hiện tượng vật lí:
- Là quá trình biến đổi trạng thái của chất mà không làm thay đổi bản chất hóa học của nó.
- Chỉ thay đổi về hình dạng, kích thước hoặc trạng thái tập hợp của chất.
- Ví dụ: nghiền nhỏ muối, hòa tan muối vào nước, nước đá tan chảy.
Một vài yếu tố cơ bản của phản ứng hóa học:
- Chất tham gia (chất đầu vào): Là những chất ban đầu tham gia vào phản ứng.
- Sản phẩm: Là những chất mới được tạo thành sau phản ứng.
- Điều kiện phản ứng: Là những yếu tố ảnh hưởng đến tốc độ và hiệu suất của phản ứng như nhiệt độ, áp suất, chất xúc tác,…
Bản chất của phản ứng hóa học
Bản chất của phản ứng hóa học là sự thay đổi liên kết hóa học giữa các nguyên tử, tạo thành chất mới có tính chất khác hẳn với chất ban đầu.
Sự thay đổi liên kết hóa học:
- Trong phản ứng hóa học, các liên kết hóa học giữa các nguyên tử trong chất tham gia bị phá vỡ và hình thành các liên kết hóa học mới giữa các nguyên tử khác nhau.
- Chính sự thay đổi này dẫn đến sự thay đổi về thành phần cấu tạo và tính chất hóa học của chất.
Hình thành chất mới:
- Sau phản ứng hóa học, các nguyên tử được sắp xếp lại theo cách mới, tạo thành các chất mới có tính chất khác hẳn với chất ban đầu.
- Ví dụ: trong phản ứng đốt cháy than, liên kết hóa học giữa các nguyên tử carbon và hydrogen trong than bị phá vỡ, hình thành liên kết hóa học mới giữa các nguyên tử carbon, oxygen và hydrogen, tạo thành khí carbon dioxide và nước.
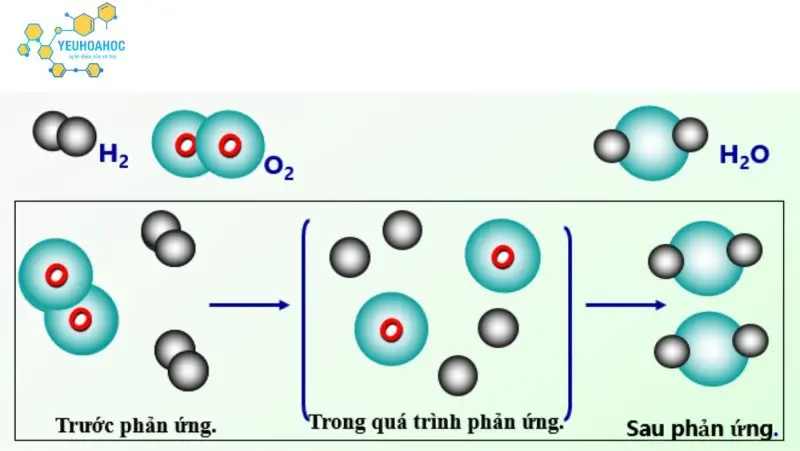
Ví dụ:
- Phản ứng đốt cháy hydro:
- Chất tham gia: H2, O2
- Sản phẩm: H2O
- Bản chất: Liên kết hóa học giữa các nguyên tử hydrogen và oxygen trong phân tử H2 và O2 bị phá vỡ, hình thành liên kết hóa học mới giữa các nguyên tử hydrogen và oxygen, tạo thành phân tử nước H2O.
Phân loại phản ứng hóa học
Dựa trên bản chất
Phản ứng hóa học oxi hóa – khử
- Đây là loại phản ứng hóa học mà trong đó cả quá trình oxi hóa và quá trình khử diễn ra cùng lúc.
- Sự oxi hóa: Là quá trình một nguyên tử, ion hoặc phân tử nhường electron, số oxi hóa của nó tăng.
- Sự khử: Là quá trình một nguyên tử, ion hoặc phân tử nhận electron, số oxi hóa của nó giảm.
Ví dụ:
- Phản ứng đốt cháy hydro: 2H2 + O2 -> 2H2O
- Trong phản ứng này, nguyên tử hydrogen bị oxi hóa (số oxi hóa tăng từ 0 lên +1), nguyên tử oxygen bị khử (số oxi hóa giảm từ 0 xuống -2).
- Phản ứng gỉ sắt: Fe + O2 -> Fe2O3
- Trong phản ứng này, nguyên tử sắt bị oxi hóa (số oxi hóa tăng từ 0 lên +3), nguyên tử oxygen bị khử (số oxi hóa giảm từ 0 xuống -2).
Phản ứng hóa học không oxi hóa – khử:
- Là phản ứng hóa học trong đó không xảy ra sự oxi hóa hoặc khử.
- Số oxi hóa của các nguyên tố trong chất tham gia và sản phẩm không thay đổi.
Ví dụ:
- Phản ứng hóa hợp hydro chloride: H2 + Cl2 -> 2HCl
- Trong phản ứng này, số oxi hóa của hydrogen giữ nguyên là +1, số oxi hóa của chlorine giữ nguyên là -1.
- Phản ứng phân hủy canxi carbonate: CaCO3 -> CaO + CO2
- Trong phản ứng này, số oxi hóa của calcium giữ nguyên là +2, số oxi hóa của carbon giữ nguyên là +4.
Ngoài ra, phản ứng hóa học còn có thể được phân loại theo các tiêu chí khác như:
- Số lượng chất tham gia và sản phẩm:
- Phản ứng hóa hợp: Từ hai hay nhiều chất ban đầu tạo thành một chất mới.
- Phản ứng phân hủy: Từ một chất ban đầu tạo thành hai hay nhiều chất mới.
- Phản ứng trao đổi: Hai chất tham gia trao đổi một số nguyên tử với nhau để tạo thành hai chất mới.
- Trạng thái tập hợp của chất tham gia và sản phẩm:
- Phản ứng đồng pha: Chất tham gia và sản phẩm đều ở cùng một trạng thái tập hợp.
- Phản ứng khác pha: Chất tham gia và sản phẩm ở hai trạng thái tập hợp khác nhau.
Dựa trên sự thay đổi số lượng chất tham gia và sản phẩm
- Phản ứng hóa hợp (kết hợp):
- Là phản ứng trong đó từ hai hay nhiều chất ban đầu tạo thành một chất mới.
- Đặc điểm:
- Số lượng chất tham gia nhiều hơn số lượng chất sản phẩm.
- Công thức hóa học: A + B -> C (A, B là các chất tham gia, C là sản phẩm).
- Ví dụ:
- Phản ứng tổng hợp nước: 2H2 + O2 -> 2H2O
- Phản ứng tổng hợp amoniac: N2 + 3H2 -> 2NH3
- Phản ứng hóa học phân hủy:
- Là phản ứng trong đó từ một chất ban đầu tạo thành hai hay nhiều chất mới.
- Đặc điểm:
- Số lượng chất tham gia ít hơn số lượng chất sản phẩm.
- Công thức hóa học: A -> B + C (A là chất tham gia, B và C là các sản phẩm).
- Ví dụ:
- Phản ứng phân hủy canxi cacbonat: CaCO3 -> CaO + CO2
- Phản ứng điện phân nước: 2H2O -> 2H2 + O2
- Phản ứng hóa học trao đổi:
- Là phản ứng trong đó hai chất tham gia trao đổi một số nguyên tử với nhau để tạo thành hai chất mới.
- Đặc điểm:
- Số lượng chất tham gia bằng số lượng chất sản phẩm.
- Chất tham gia và sản phẩm đều là hợp chất.
- Công thức hóa học: AB + CD -> AC + BD (AB và CD là các chất tham gia, AC và BD là các sản phẩm).
- Ví dụ:
- Phản ứng trung hòa axit – bazơ: NaOH + HCl -> NaCl + H2O
- Phản ứng trao đổi ion: AgNO3 + NaCl -> AgCl + NaNO3
- Phản ứng hóa học kép:
- Là phản ứng trong đó xảy ra đồng thời hai hay nhiều phản ứng hóa học đơn giản.
- Đặc điểm:
- Có thể biểu diễn bằng một phương trình hóa học.
- Gồm nhiều phản ứng hóa hợp, phân hủy hoặc trao đổi diễn ra đồng thời.
- Ví dụ:
- Phản ứng đốt cháy metan: CH4 + 2O2 -> CO2 + 2H2O
- Phản ứng sản xuất axit sunfuric: 2S + 3O2 -> 2SO2, 2SO2 + O2 -> 2SO3, SO3 + H2O -> H2SO4
Ý nghĩa của phản ứng hóa học
Giải thích các hiện tượng hóa học:
- Phản ứng hóa học giúp chúng ta hiểu rõ bản chất của các hiện tượng hóa học xảy ra trong tự nhiên và đời sống.
- Nhờ đó, chúng ta có thể dự đoán được kết quả của các phản ứng, điều khiển và ứng dụng các phản ứng hóa học vào thực tiễn.
Đóng một vai trò thiết yếu trong ngành công nghiệp sản xuất.
- Hầu hết các sản phẩm công nghiệp đều được tạo thành thông qua các phản ứng hóa học.
- Ví dụ: sản xuất thép, xi măng, hóa chất, dệt may, thực phẩm,…
Có vai trò quan trọng trong nông nghiệp:
- Phản ứng hóa học đóng vai trò quan trọng trong việc cung cấp dinh dưỡng cho cây trồng, bảo vệ thực vật khỏi sâu bệnh, cải tạo đất,…
- Ví dụ: sử dụng phân bón hóa học, thuốc trừ sâu, thuốc bảo vệ thực vật,…
Có vai trò quan trọng trong y học:
- Phản ứng hóa học được ứng dụng trong sản xuất thuốc chữa bệnh, chẩn đoán bệnh, điều trị bệnh,…
- Ví dụ: sản xuất thuốc kháng sinh, thuốc giảm đau, thuốc hạ huyết áp,…
Có vai trò quan trọng trong đời sống:
- Phản ứng hóa học diễn ra trong mọi hoạt động của đời sống như nấu ăn, tiêu hóa thức ăn, hô hấp,…
- Ví dụ: quá trình lên men thực phẩm, quá trình hô hấp tế bào,…
Ứng dụng của phản ứng hóa học

Sản xuất các hóa chất, vật liệu mới:
- Phản ứng hóa học được sử dụng để sản xuất ra các hóa chất, vật liệu mới có tính năng vượt trội so với các vật liệu truyền thống.
- Ví dụ: sản xuất nhựa, cao su, sợi tổng hợp, pin, chất bán dẫn,…
biến thực phẩm, bảo quản thực phẩm:
- Phản ứng hóa học được sử dụng để chế biến thực phẩm thành các sản phẩm có hương vị, màu sắc, giá trị dinh dưỡng cao hơn.
- Phản ứng hóa học cũng được sử dụng để bảo quản thực phẩm, giúp kéo dài thời gian sử dụng của thực phẩm.
- Ví dụ: lên men sữa chua, sản xuất bia, rượu, nước ngọt, đóng hộp thực phẩm,…
Luyện kim, sản xuất kim loại:
- Phản ứng hóa học được sử dụng để khai thác quặng kim loại, tinh chế kim loại và sản xuất các sản phẩm từ kim loại.
- Ví dụ: khai thác quặng đồng, luyện thép, sản xuất nhôm, chế tạo máy móc, thiết bị,…
Sản xuất thuốc men, hóa chất y tế:
- Phản ứng hóa học được sử dụng để sản xuất thuốc men, hóa chất y tế có tác dụng chữa bệnh, phòng ngừa bệnh tật và chăm sóc sức khỏe.
- Ví dụ: sản xuất thuốc kháng sinh, thuốc giảm đau, thuốc hạ huyết áp, vắc-xin,…
Xử lý nước thải, bảo vệ môi trường:
- Phản ứng hóa học được sử dụng để xử lý nước thải, biến đổi các chất ô nhiễm trong nước thải thành những chất không độc hại, góp phần bảo vệ môi trường.
- Phản ứng hóa học cũng được sử dụng để sản xuất các sản phẩm thân thiện với môi trường như pin năng lượng mặt trời, xe điện,…
Từ những thông tin trên, chúng ta có thể thấy rằng phản ứng hóa học không chỉ là một phần của sách giáo khoa mà còn ảnh hưởng trực tiếp đến mọi khía cạnh của cuộc sống hàng ngày. Hiểu biết về chúng giúp chúng ta phát triển nhiều giải pháp khoa học và công nghệ hiệu quả hơn.







