Phân tử: Định nghĩa cấu tạo và một vài ví dụ tiêu biểu
Phân tử là gì? Trong bài biết này yeuhoahoc.edu.vn mong muốn mang đến cho bạn những thông tin sâu sắc và thú vị về thế giới kỳ diệu của phân tử
Trong thế giới của hóa học, phân tử đóng vai trò quan trọng trong việc hiểu về cấu trúc và tính chất của các chất. Trong bài biết này yeuhoahoc.edu.vn mong muốn mang đến cho bạn những thông tin sâu sắc và thú vị về thế giới kỳ diệu của phân tử. Hãy cùng chúng tôi khám phá và khai phá vẻ đẹp và sức mạnh ẩn sau mỗi phân tử!
Phân tử là gì
Phân tử là hai hay nhiều nguyên tử (nguyên tố) tạo thành bằng các liên kết hoá học và là nhóm trung hoà điện tích, được phân biệt với các ion do thiếu điện tích giữa các nguyên tử.
Phân tử là đơn vị cơ bản nhất của một chất, giữ lại tất cả các tính chất của chất đó. Nó được tạo thành từ các nguyên tử liên kết với nhau thông qua các liên kết hóa học, bao gồm liên kết cộng hóa trị, liên kết ion, hoặc các loại liên kết khác tùy thuộc vào loại chất cụ thể.
Phân tử có thể là các hợp chất hóa học, như nước (H2O), đường (C6H12O6), hoặc cả những phân tử đơn như oxy (O2) và nitơ (N2)
Ở lĩnh vực động học chất khí, thuật ngữ “phân tử” được sử dụng để mô tả bất kỳ hạt khí nào, không phụ thuộc vào thành phần cụ thể. Theo định nghĩa này, ngay cả các nguyên tử của khí trơ cũng được xem xét như là các phân tử đơn.
Cấu tạo phân tử
Cấu tạo của một phân tử xác định bằng các nguyên tử tương tác và kết hợp với nhau. Điều này được xác định bởi sự sắp xếp và loại liên kết hóa học giữa các nguyên tử trong phân tử. Dưới đây là một số khía cạnh quan trọng về cấu tạo phân tử:
Nguyên tử và liên kết hóa học
- Nguyên Tử: Các nguyên tử trong một phân tử có thể thuộc các nguyên tố khác nhau, với số lượng và loại nguyên tử đóng vai trò quan trọng trong tính chất của phân tử.
- Liên Kết Hóa Học: Liên kết giữa các nguyên tử trong phân tử có thể là liên kết cộng hóa trị, liên kết ion, liên kết phân tử, hoặc các loại liên kết khác. Sức mạnh của liên kết này ảnh hưởng đến tính chất vật lý và hóa học của phân tử.
Hình dạng và cấu trúc phân tử
- Hình Dạng: Cấu trúc không gian của phân tử được mô tả bằng các khái niệm như góc liên kết và đối xứng. Hình dạng này quyết định tính chất hóa học và tương tác của phân tử với các chất khác.
- Cấu Trúc: Cấu trúc phân tử bao gồm vị trí chính xác của các nguyên tử và góc liên kết giữa chúng. Điều này ảnh hưởng đến tính chất hóa học và vật lý của phân tử.
Phân tử đa nguyên tử và tính đa dạng
- Trong phân tử đa nguyên tử, các nhóm nguyên tử có thể lặp lại hoặc kết hợp với nhau để tạo thành một cấu trúc phức tạp, như các hợp chất hữu cơ, protein, và DNA.
- Sự đa dạng này cung cấp cho phân tử khả năng thực hiện nhiều chức năng và tương tác đa dạng trong môi trường hóa học và sinh học.
Tác động của điện tử
- Điện tử trong phân tử tham gia vào các quá trình hóa học và tác động lên cấu trúc và tính chất của phân tử. Sự chuyển động của điện tử quyết định khả năng dẫn điện và hoạt động hóa học của phân tử.
Tóm lại, cấu tạo phân tử không chỉ xác định hình dạng và tính chất của chúng mà còn quyết định cách chúng tương tác với môi trường xung quanh và thực hiện các chức năng hóa học quan trọng.
Liên kết hóa học
Liên kết hóa học là sự tương tác giữa các nguyên tử trong phân tử để tạo ra cấu trúc của chất. Các loại liên kết hóa học chủ yếu bao gồm liên kết cộng hóa trị, liên kết ion, và liên kết phân tử.
Liên kết cộng hóa trị
- Đặc Điểm Chính: Liên kết cộng hóa trị xảy ra khi các nguyên tử chia sẻ các cặp electron để đạt được cấu hình electron bền nhất.
- Ví Dụ: Trong phân tử nước (
), nguyên tử hydro chia sẻ electron với nguyên tử oxy để tạo ra liên kết cộng hóa trị. Mỗi nguyên tử hydro đóng góp một electron, trong khi nguyên tử oxy đóng góp hai electron.
Liên kết ion
- Đặc Điểm Chính: Liên kết ion xảy ra khi một nguyên tử nhường electron cho nguyên tử khác, tạo ra các ion dương và âm.
- Ví Dụ: Trong muối natri clorua (NaCl), nguyên tử natri (Na) nhường electron cho nguyên tử clo (Cl), tạo ra ion Na+ và Cl- có liên kết ion.
Liên kết phân tử
- Đặc Điểm Chính: Liên kết phân tử xảy ra khi các nguyên tử chia sẻ electron để tạo ra các phân tử đơn độc lập.
- Ví Dụ: Trong phân tử methane
), bốn nguyên tử hydro chia sẻ electron với nguyên tử cacbon để tạo ra liên kết phân tử, tạo thành một phân tử methane.
Ví dụ về phân tử
Dưới đây là một số ví dụ về phân tử đặc trưng trong thế giới xung quanh chúng ta:
Nước (
)
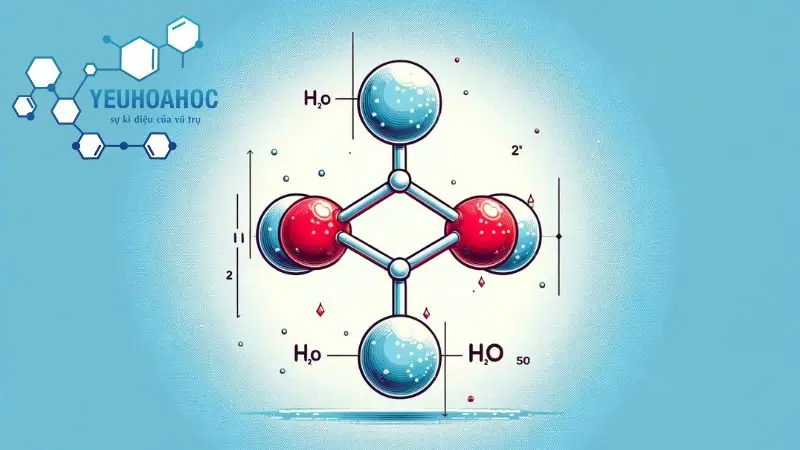
- Cấu Trúc Phân Tử: Nước là một phân tử được tạo thành bởi hai nguyên tử hydro (H) và một nguyên tử oxy (O), liên kết với nhau thông qua liên kết cộng hóa trị.
- Tính Chất Quan Trọng: Cấu trúc phân tử nước tạo ra tính chất đặc biệt như khả năng dung nạp nhiệt, nước có nhiệt động học cao và làm nền tảng cho sự sống.
Oxi (
)
- Cấu Trúc Phân Tử: Oxi là một phân tử được tạo thành bởi hai nguyên tử oxy (O), liên kết với nhau thông qua liên kết phân tử.
- Tính Chất Quan Trọng: Oxi là phân tử quan trọng trong quá trình hô hấp và sự đốt cháy, đóng vai trò quan trọng trong nhiều quá trình hóa học và sinh học.
Đường Glucose (
)
- Cấu Trúc Phân Tử: Đường glucose là một phân tử đa nguyên tử được tạo thành từ sáu nguyên tử cacbon (C), mười hai nguyên tử hydro (H), và sáu nguyên tử oxy (O), liên kết với nhau qua liên kết cộng hóa trị.

- Tính Chất Quan Trọng: Glucose là một loại đường quan trọng trong sinh học, cung cấp năng lượng cho tế bào và tham gia vào nhiều quá trình chuyển hóa.
Điện giải natri clorua (NaCl)
- Cấu Trúc Phân Tử: Trong điện giải, phân tử natri clorua được tạo thành từ ion natri (Na+) và ion clorua (Cl-), tạo ra liên kết ion.
NaCl → Na + + Cl –
- Tính Chất Quan Trọng: Natri clorua là một loại muối quan trọng, đóng vai trò trong cân bằng nước và điện giải trong cơ thể.
Mêtan (
)
- Cấu Trúc Phân Tử: Metan là một phân tử đơn, được tạo thành từ một nguyên tử cacbon (C) và bốn nguyên tử hydro (H), liên kết với nhau qua liên kết phân tử.

- Tính Chất Quan Trọng: Metan là một khí thiên nhiên, cũng là một khí nhà kính, đóng vai trò quan trọng trong vận động học khí quyển và nhiệt độ trái đất.
Công thức phân tử
Công thức phân tử là một dạng ký hiệu hóa học biểu thị thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố trong một phân tử hợp chất.
Công thức phân tử khác với công thức cấu tạo, công thức cấu tạo không chỉ cho biết số lượng và loại nguyên tử, mà còn mô tả cách thức các nguyên tử liên kết với nhau trong phân tử thông qua các liên kết hoá học
Ví dụ:
- Ethanol có công thức phân tử là C₂H₆O, nhưng công thức cấu tạo của nó cung cấp thông tin chi tiết hơn về việc một nhóm hydroxyl (-OH) liên kết với một chuỗi carbon.
 .
.
Cách viết công thức phân tử
Cách viết:
- Xác định các nguyên tố cấu tạo nên hợp chất.
- Xác định số nguyên tử của các nguyên tố trong một phân tử.
- Viết ký hiệu hóa học của các nguyên tố theo thứ tự: C, H, O, N, P, S,…
- Ghi chỉ số dưới mỗi ký hiệu cho biết số nguyên tử của nguyên tố tương ứng.
Lưu ý:
- Công thức phân tử chỉ thể hiện thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố trong một phân tử.
- Không thể dựa vào công thức phân tử để xác định cấu trúc phân tử.
Ví dụ
- Nước (H₂O): Có 2 nguyên tử Hydro (H) và 1 nguyên tử Oxy (O).
- Glucose (C₆H₁₂O₆): Có 6 nguyên tử Cacbon (C), 12 nguyên tử Hydro (H), và 6 nguyên tử Oxy (O).
- Axit sunfuric (
): Có 2 nguyên tử H, 1 nguyên tử S và 4 nguyên tử oxy
Tóm lại hiểu biết về cấu trúc và tính chất của phân tử giúp chúng ta phát triển các ứng dụng mới từ dược phẩm đến vật liệu tiên tiến và năng lượng tái tạo. Qua việc khám phá và nghiên cứu về phân tử, chúng ta có thể thúc đẩy sự tiến bộ và phát triển toàn diện trong tương lai.







