Nhiệt động hóa học
Hãy cùng chúng tôi khám phá về nhiệt động hóa học: khái niệm, đại lượng và nguyên lý cùng với những điều kỳ diệu mà nhiệt động hóa học mang lại!
Bước vào thế giới vi mô của nguyên tử và phân tử, nơi nhiệt lượng và năng lượng ẩn chứa những bí ẩn thú vị. Nhiệt động hóa học, ngành khoa học đầy mê hoặc này, hé mở cánh cửa dẫn bạn đến với những nguyên lý chi phối sự chuyển hóa năng lượng trong các phản ứng hóa học. Hãy cùng chúng tôi khám phá những điều kỳ diệu mà nhiệt động hóa học mang lại!
Định nghĩa cơ bản về nhiệt động hóa học
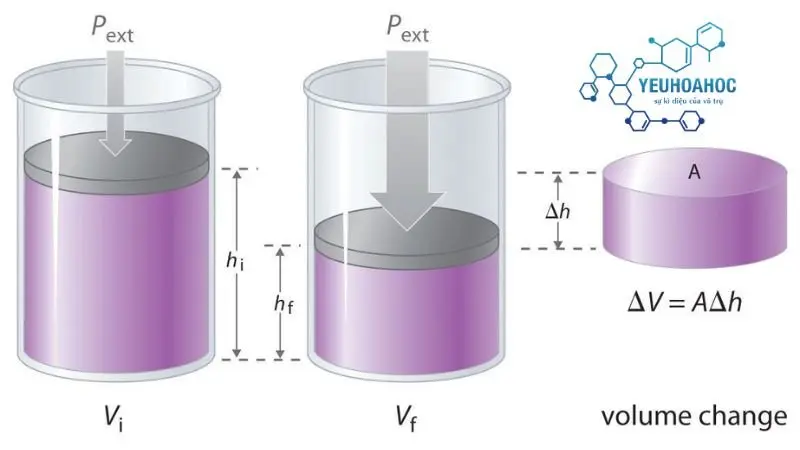
Hệ, pha, trạng thái của hệ
- Hệ: Là một vật thể hoặc nhóm vật thể được xem xét trong một quá trình nhiệt động học. Hệ có thể được giới hạn bằng ranh giới tưởng tượng hoặc thực tế.
- Pha: Là một phần đồng nhất của hệ, có các tính chất vật lý và hóa học giống nhau. Ví dụ: nước có thể tồn tại ở ba pha: rắn (đá), lỏng (nước) và khí (hơi nước).
- Trạng thái của hệ: Được xác định bởi các đại lượng nhiệt động học như nhiệt độ, áp suất, thể tích, v.v. của hệ. Hai trạng thái khác nhau được phân biệt bởi sự khác biệt về giá trị của ít nhất một đại lượng nhiệt động học.
Năng lượng nội, công, nhiệt
- Năng lượng nội (U): Là tổng năng lượng của các phần tử cấu tạo nên hệ, bao gồm năng lượng động học và năng lượng tiềm năng của các phần tử. Năng lượng nội được đo bằng đơn vị J (Joule).
- Công (W): Là năng lượng được truyền từ hệ sang môi trường hoặc ngược lại do sự chênh lệch áp suất. Công được đo bằng đơn vị J (Joule).
- Nhiệt (Q): Là năng lượng được truyền từ hệ sang môi trường hoặc ngược lại do sự chênh lệch nhiệt độ. Nhiệt được đo bằng đơn vị J (Joule).
Định luật bảo toàn năng lượng trong quá trình hóa học
Năng lượng không thể tự sinh ra hay mất đi, nó chỉ có thể chuyển đổi từ dạng này sang dạng khác. Trong một quá trình hóa học kín, tổng năng lượng của hệ (bao gồm năng lượng nội và năng lượng của môi trường xung quanh) luôn được bảo toàn.
Khái niệm về entanpi (H) và entropi (S)
- Entanpi (H): Là tổng năng lượng nội của hệ cộng với tích của áp suất và thể tích của hệ. Entanpi được đo bằng đơn vị J (Joule).
- Entropi (S): Là thước đo mức độ rối loạn hoặc mất trật tự của một hệ. Entropi được đo bằng đơn vị J/K (Joule/Kelvin).
Sự thay đổi entanpi (ΔH) và entropi (ΔS) trong phản ứng hóa học:
- ΔH: Là lượng nhiệt được trao đổi giữa hệ và môi trường trong quá trình phản ứng. ΔH > 0 khi phản ứng tỏa nhiệt, ΔH < 0 khi phản ứng thu nhiệt, ΔH = 0 khi phản ứng không tỏa cũng không thu nhiệt.
- ΔS: Là sự thay đổi mức độ rối loạn của hệ trong quá trình phản ứng. ΔS > 0 khi phản ứng tiến tới trạng thái rối loạn hơn, ΔS < 0 khi phản ứng tiến tới trạng thái trật tự hơn, ΔS = 0 khi phản ứng không thay đổi mức độ rối loạn.
Ứng dụng của nhiệt động hóa học:
Nhiệt động hóa học được ứng dụng rộng rãi trong nhiều lĩnh vực như:
- Dự đoán khả năng xảy ra của phản ứng hóa học
- Thiết kế lò phản ứng hóa học và các quy trình công nghiệp
- Phân tích thành phần và cấu trúc của vật liệu
- Nghiên cứu khoa học về các quá trình sinh học
Các đại lượng nhiệt động hóa học quan trọng
Biến thiên entanpi (ΔH) và biến thiên entropi (ΔS):
- ΔH: Như đã đề cập ở trên, ΔH là lượng nhiệt được trao đổi giữa hệ và môi trường trong quá trình phản ứng. ΔH > 0 khi phản ứng tỏa nhiệt, ΔH < 0 khi phản ứng thu nhiệt, ΔH = 0 khi phản ứng không tỏa cũng không thu nhiệt.
- ΔS: ΔS là sự thay đổi mức độ rối loạn của hệ trong quá trình phản ứng. ΔS > 0 khi phản ứng tiến tới trạng thái rối loạn hơn, ΔS < 0 khi phản ứng tiến tới trạng thái trật tự hơn, ΔS = 0 khi phản ứng không thay đổi mức độ rối loạn.
Năng lượng tự do Gibbs (ΔG) và tiêu chuẩn Gibbs (ΔG⁰):
- ΔG: ΔG là đại lượng nhiệt động học quan trọng nhất, thể hiện khả năng tự diễn ra của một phản ứng hóa học ở điều kiện nhất định (áp suất và nhiệt độ nhất định). ΔG < 0 khi phản ứng tự diễn ra thuận lợi, ΔG > 0 khi phản ứng tự diễn ra ngịch, ΔG = 0 khi phản ứng đạt trạng thái cân bằng.
- ΔG⁰: ΔG⁰ là năng lượng tự do Gibbs của phản ứng ở điều kiện tiêu chuẩn (áp suất 1 atm và nhiệt độ 25⁰C). ΔG⁰ < 0 khi phản ứng thuận lợi ở điều kiện tiêu chuẩn, ΔG⁰ > 0 khi phản ứng ngịch ở điều kiện tiêu chuẩn.
Mối liên hệ giữa ΔG và ΔH, ΔS:
ΔG được liên hệ với ΔH và ΔS bằng phương trình Gibbs-Helmholtz:
ΔG = ΔH – TΔS
với T là nhiệt độ tuyệt đối (K).
Hằng số cân bằng (K) và mối liên hệ với ΔG⁰:
Hằng số cân bằng (K) là tỷ số giữa tích nồng độ của các sản phẩm ở trạng thái cân bằng và tích nồng độ của các chất tham gia phản ứng ở trạng thái cân bằng. K có giá trị lớn khi phản ứng thuận lợi ở trạng thái cân bằng, K có giá trị nhỏ khi phản ứng ngịch ở trạng thái cân bằng.
Mối liên hệ giữa K và ΔG⁰ được biểu thị bởi phương trình Van’t Hoff:
ln K = (-ΔG⁰) / (RT)
với R là hằng số khí lý tưởng (8,314 J/mol.K).
Các nguyên lý nhiệt động học
Nguyên lý I nhiệt động học: Định luật bảo toàn năng lượng
- Nội dung: Năng lượng không thể tự sinh ra hay mất đi, nó chỉ có thể chuyển đổi từ dạng này sang dạng khác. Trong một quá trình nhiệt động học kín, tổng năng lượng của hệ (bao gồm năng lượng nội và năng lượng của môi trường xung quanh) luôn được bảo toàn.
- Công thức: ΔU = Q + W
- ΔU: Biến thiên năng lượng nội của hệ
- Q: Nhiệt lượng truyền vào hoặc truyền ra khỏi hệ
- W: Công thực hiện bởi hệ hoặc lên hệ
Nguyên lý II nhiệt động học: Định luật về entropi
- Nội dung: Trong một hệ kín, entropi (S) của hệ luôn tăng dần theo thời gian. Trong một quá trình tự diễn ra, entropi tổng cộng của hệ và môi trường luôn tăng.
- Công thức: ΔS ≥ 0
- ΔS: Biến thiên entropi của hệ
Ứng dụng của các nguyên lý nhiệt động học trong dự đoán chiều hướng và giới hạn của phản ứng hóa học
Dự đoán chiều hướng:
Dựa trên ΔG:
- ΔG < 0: Phản ứng tự diễn ra thuận lợi
- ΔG > 0: Phản ứng tự diễn ra nghịch
- ΔG = 0: Phản ứng đạt trạng thái cân bằng
Dựa trên ΔS:
- ΔS > 0: Phản ứng thuận lợi
- ΔS < 0: Phản ứng nghịch
- ΔS = 0: Phản ứng không thay đổi mức độ rối loạn
Dự đoán giới hạn:
Dựa trên ΔG⁰:
- ΔG⁰ < 0: Phản ứng có thể tiến hành hoàn toàn về phía thuận
- ΔG⁰ > 0: Phản ứng không thể tiến hành hoàn toàn về phía thuận
- ΔG⁰ = 0: Phản ứng đạt trạng thái cân bằng ở bất kỳ tỉ lệ nào
Dựa trên hằng số cân bằng (K):
- K lớn: Phản ứng có thể tiến hành khá hoàn toàn về phía thuận
- K nhỏ: Phản ứng không thể tiến hành hoàn toàn về phía thuận
Một số ứng dụng của nhiệt động hóa học
- Tính toán hiệu suất phản ứng hóa học:
Nhiệt động hóa học cung cấp cho chúng ta các công cụ để tính toán hiệu suất chuyển đổi của các chất tham gia phản ứng thành sản phẩm. Hiệu suất chuyển đổi này là rất quan trọng trong các quy trình công nghiệp, vì nó ảnh hưởng trực tiếp đến năng suất và chi phí sản xuất.
Phương pháp:
- Sử dụng ΔG⁰ để dự đoán khả năng xảy ra của phản ứng.
- Tính toán hằng số cân bằng (K) ở điều kiện phản ứng thực tế.
- Sử dụng K để tính toán tỷ lệ mol của các chất ở trạng thái cân bằng.
- Từ tỷ lệ mol cân bằng, có thể tính toán hiệu suất chuyển đổi của phản ứng.
- Thiết kế và tối ưu hóa quy trình sản xuất hóa chất:
Nhiệt động hóa học có thể được sử dụng để thiết kế các quy trình sản xuất hóa chất hiệu quả và tiết kiệm năng lượng. Bằng cách sử dụng các nguyên lý nhiệt động học, các nhà khoa học và kỹ sư có thể:
- Chọn điều kiện phản ứng tối ưu (nhiệt độ, áp suất, chất xúc tác) để tăng hiệu suất chuyển đổi và giảm chi phí sản xuất.
- Thiết kế các hệ thống thu hồi nhiệt để tận dụng năng lượng nhiệt thải ra trong quá trình phản ứng.
- Phát triển các quy trình sản xuất thân thiện với môi trường bằng cách giảm thiểu lượng chất thải và khí thải.
- Phân tích và đánh giá tính bền vững của các quá trình hóa học:
Nhiệt động hóa học có thể được sử dụng để đánh giá tính bền vững của các quy trình hóa học. Bằng cách phân tích ΔG, ΔH và ΔS của phản ứng, có thể đánh giá được mức độ tiêu thụ năng lượng, sinh ra chất thải và ảnh hưởng đến môi trường của quá trình.
Tiêu chí đánh giá:
- ΔG: Phản ứng có ΔG⁰ âm là phản ứng tự diễn ra thuận lợi và có khả năng xảy ra cao hơn.
- ΔH: Phản ứng tỏa nhiệt (ΔH < 0) thường dễ xảy ra hơn phản ứng thu nhiệt (ΔH > 0).
- ΔS: Phản ứng có ΔS⁰ dương thường có khả năng xảy ra cao hơn phản ứng có ΔS⁰ âm.
- Nghiên cứu và phát triển vật liệu mới:
Nhiệt động hóa học đóng vai trò quan trọng trong nghiên cứu và phát triển vật liệu mới. Bằng cách sử dụng các nguyên lý nhiệt động học, các nhà khoa học có thể:
- Dự đoán tính chất và cấu trúc của các vật liệu mới.
- Thiết kế các vật liệu có tính năng mong muốn như độ bền cao, dẫn điện tốt, dẫn nhiệt tốt, v.v.
- Phát triển các phương pháp tổng hợp vật liệu mới hiệu quả và tiết kiệm năng lượng.
Ví dụ:
- Sử dụng nhiệt động hóa học để dự đoán tính ổn định của các hợp kim mới.
- Thiết kế pin lithium-ion có dung lượng cao và tuổi thọ dài hơn.
- Phát triển các vật liệu xúc tác mới để tăng hiệu quả của các phản ứng hóa học.
Bài tập áp dụng nhiệt động hóa học
Bài tập hóa học về nhiệt động hóa học: ΔH, ΔG, ΔS và hằng số K
Ví dụ:
Phản ứng:
H2(g) + I2(g) ⇌ 2HI(g)
Điều kiện:
- Nhiệt độ:25⁰C (298 K)
- Áp suất:1 atm
Tính:
- Biến thiên entanpi (ΔH)
- Biến thiên năng lượng tự do Gibbs (ΔG)
- Biến thiên entropi (ΔS)
- Hằng số cân bằng (K)
Giải:
- Tính toán ΔH:
Sử dụng dữ liệu năng lượng liên kết trung bình (E(liên kết)) từ sách giáo khoa hoặc tài liệu tham khảo:
- E(HH) = 436 kJ/mol
- E(II) = 244 kJ/mol
- E(HI) = 310 kJ/mol
Áp dụng định luật Hess:
ΔH = Σ E(liên kết trong sản phẩm) – Σ E(liên kết trong chất tham gia)
ΔH = (2 * E(HI)) – (E(HH) + E(II))
ΔH = (2 * 310 kJ/mol) – (436 kJ/mol + 244 kJ/mol)
ΔH = -150 kJ/mol
Kết luận: Phản ứng này là phản ứng tỏa nhiệt với ΔH = -150 kJ/mol.
- Tính toán ΔS:
Sử dụng dữ liệu entropi chuẩn (S⁰) từ sách giáo khoa hoặc tài liệu tham khảo:
- S⁰(H2(g)) = 130,6 J/(mol·K)
- S⁰(I2(g)) = 218,6 J/(mol·K)
- S⁰(HI(g)) = 228,6 J/(mol·K)
Áp dụng công thức:
ΔS = Σ S⁰(sản phẩm) – Σ S⁰(chất tham gia)
ΔS = (2 * S⁰(HI(g))) – (S⁰(H2(g)) + S⁰(I2(g)))
ΔS = (2 * 228,6 J/(mol·K)) – (130,6 J/(mol·K) + 218,6 J/(mol·K))
ΔS = -12 J/K
Kết luận: Phản ứng này là phản ứng giảm entropi với ΔS = -12 J/K.
- Tính toán ΔG:
Sử dụng phương trình Gibbs-Helmholtz:
ΔG = ΔH – TΔS
ΔG = (-150 kJ/mol) – (298 K * (-12 J/(mol·K)) * (1 kJ/1000 J))
ΔG = -127,2 kJ/mol
Kết luận: Phản ứng này tự diễn ra thuận lợi ở điều kiện tiêu chuẩn với ΔG = -127,2 kJ/mol.
- Tính toán hằng số cân bằng (K):
Sử dụng phương trình Van’t Hoff:
ln K = (-ΔG⁰) / (RT)
ln K = (-(-127,2 kJ/mol) * (1000 J/kJ)) / (8,314 J/(mol·K) * 298 K)
ln K = 54.3
K = e^(54.3)
K ≈ 1.72 x 10^24
Nhiệt động hóa học không chỉ là một lĩnh vực khoa học, mà còn là chìa khóa mở ra cánh cửa giải quyết vô vàn vấn đề thực tiễn. Từ dự đoán chiều hướng phản ứng, tính toán nhiệt lượng tỏa ra, đến nghiên cứu cân bằng hóa học và ứng dụng trong công nghiệp, nhiệt động hóa học đóng vai trò thiết yếu trong sự phát triển của khoa học và đời sống. Hãy tiếp tục khám phá và chinh phục những đỉnh cao mới trong thế giới fascinant của nhiệt động hóa học!







