Lớp electron: Khái niệm, cấu trúc và tính chất đặc trưng
Khái niệm về lớp electron được hiểu như thế nào? Cấu trúc và tính chất đặc trung được hiểu ra sao? Tất cả sẽ được giải đáp chi tiết nhất qua bài viết dưới đây
Trong thế giới vi mô của hạt nhân và electron, việc hiểu rõ về lớp electron đóng vai trò quan trọng trong việc giải mã các tính chất hóa học của nguyên tử. Bài viết này sẽ cung cấp cái nhìn sâu sắc về khái niệm lớp electron, cách xác định số lượng lớp, và vai trò của lớp electron ngoài cùng trong các phản ứng hóa học.
Lớp electron là gì?
Lớp electron, hay còn gọi là quỹ đạo electron, là không gian xung quanh hạt nhân nguyên tử nơi electron có khả năng tồn tại và di chuyển. Các electron trong một nguyên tử được sắp xếp theo lớp, với mỗi lớp có thể chứa một số lượng hạn định electron theo quy tắc xác định.
Số lớp electron
Trong cấu trúc của một nguyên tử, electron được tổ chức thành các lớp khác nhau, với mỗi lớp nằm xa dần ra từ hạt nhân. Electron trong cùng một lớp có mức năng lượng tương đối giống nhau.
Các electron thuộc lớp gần hạt nhân nhất có mối liên kết mạnh mẽ hơn so với các electron ở các lớp xa hạt nhân hơn. Do đó, electron ở những lớp gần hạt nhân có mức năng lượng thấp hơn so với những electron ở các lớp xa hơn. Mức năng lượng của electron chủ yếu được xác định bởi vị trí lớp của chúng trong nguyên tử.
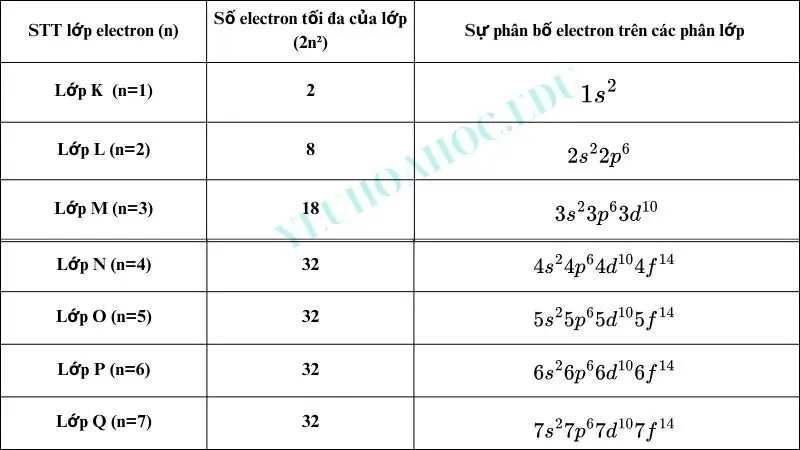
Trong nguyên tử bao gồm 7 lớp e . Các lớp electron được đánh số theo dãy số nguyên từ n = 1,2,3,…,7,
| Mức năng lượng n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Tên lớp | K | N | M | L | O | P | Q |
Trong đó, lớp K với n=1 là lớp gần hạt nhân nhất và lớp Q với n=7 là lớp xa hạt nhân nhất.ư
Bảng tổng hợp electron Max trong mỗi lớp
Phân lớp electron
Cấu trúc lớp electron

Lớp electron là vùng không gian bao quanh hạt nhân nguyên tử, nơi các electron di chuyển. Lớp electron được phân chia thành các phân lớp, được kí hiệu bằng các chữ cái viết thường: s, p, d, f. Các electron trên cùng một phân lớp có năng lượng bằng nhau.
Số phân lớp của mỗi lớp bằng số thứ tự của lớp đó. Lớp thứ nhất là một phân lớp s, lớp thứ hai có phân lớp s và p, lớp thứ ba có phân lớp s, p và d,… Trên thực tế, với các nguyên tố đã biết, chỉ có số e điền vào 4 phân lớp: s, p, d và f.
| Phân lớp | s | d | p | f |
| Số e tối đa | 2 | 6 | 10 | 14 |
| Ký hiệu | s2 | d6 | d10 | f14 |
Tên gọi các electron
Các electron ở phân lớp s được gọi là các electron s, các electron ở phân lớp p được gọi là các electron p,…
Bảng tóm tắt
| Lớp | n | Phân lớp |
| K | 1 | phân lớp 1: 1s |
| N | 2 | phân lớp 2: 2s,2p |
| M | 3 | phân lớp 3: 3s,3p,3d |
| L | 4 | phân lớp 4: 4s,4p,4d,4f |
| O | 5 | phân lớp 5: 5s,5p,5d,5f, |
| P | 6 | phân lớp 6: 6s,6p,6d,6f |
| Q | 7 | phân lớp 7: 7s,7p,7d,7f |
Các electron thuộc vào phân lớp s được gọi là electron s, trong khi đó, những electron thuộc vào phân lớp p được gọi là electron p, và cứ theo đó mỗi phân lớp có tên gọi tương ứng dựa trên ký tự đại diện.
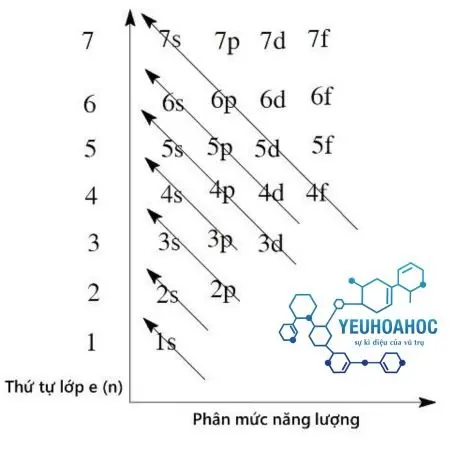
Sơ đồ tư duy mẹo nhớ cấu hình electron
Cách xác định số lớp electron

Xác định số lớp electron trong một nguyên tử dựa trên số hiệu nguyên tử (Z), tức là số lượng proton trong hạt nhân, cũng chính là số lượng electron trong một nguyên tử trung hòa về điện. Số lớp electron có thể được xác định theo các bước sau:
Xem xét số hiệu nguyên tử (Z): Số hiệu nguyên tử cho biết tổng số electron trong nguyên tử. Số này cũng giúp xác định vị trí của nguyên tố trong bảng tuần hoàn.
Sử dụng bảng tuần hoàn: Vị trí của nguyên tố trong bảng tuần hoàn cung cấp thông tin về số lớp electron. Các nguyên tố ở chu kỳ 1 chỉ có 1 lớp, chu kỳ 2 có 2 lớp, và cứ thế tiếp tục đến chu kỳ 7.
Áp dụng quy tắc 2n²: Quy tắc này cho biết mỗi lớp electron có thể chứa tối đa electron, trong đó n là số thứ tự của lớp.
Bằng cách sử dụng quy tắc này, bạn có thể xác định số lớp bằng cách điền electron vào mỗi lớp cho đến khi đạt số lượng tổng cộng bằng số hiệu nguyên tử.
Xem xét cấu hình electron: Cấu hình electron của một nguyên tử, mô tả cách electron được phân bổ trong các lớp và phân lớp, cũng giúp xác định số lớp electron. Cấu hình bắt đầu từ lớp thấp nhất (n=1) và tiếp tục đến khi tất cả các electron đã được phân bổ.
Số electron = số hiệu nguyên tử Z
Ví dụ, nguyên tử Oxy (Z=8) có cấu hình electron là 1s² 2s² 2p⁴, cho thấy nó có 2 lớp electron: lớp thứ nhất chứa 2 electron và lớp thứ hai chứa 6 electron.
Như vậy, qua việc xem xét số hiệu nguyên tử, sử dụng bảng tuần hoàn, áp dụng quy tắc 2n², và phân tích cấu hình electron, bạn có thể xác định số lớp electron của bất kỳ nguyên tử nào.
Lớp electron ngoài cùng

Lớp electron ngoài cùng là lớp electron có năng lượng cao nhất trong nguyên tử nó quyết định tính chất hóa học của nguyên tố hóa học.
Các nguyên tố có cùng số electron ở lớp electron ngoài cùng được xếp vào cùng một nhóm trong bảng tuần hoàn hóa học. Ví dụ, các nguyên tố có 1 electron ở lớp electron ngoài cùng được xếp vào nhóm IA, các nguyên tố có 2 electron ở lớp electron ngoài cùng được xếp vào nhóm IIA,…
Số electron ở lớp electron ngoài cùng cũng quyết định số lượng liên kết hóa học mà nguyên tố đó có thể tạo thành. Các nguyên tố có 1 electron ở lớp electron ngoài cùng có thể tạo thành 1 liên kết hóa học, các nguyên tố có 2 electron ở lớp electron ngoài cùng có thể tạo thành 2 liên kết hóa học,…
Tính chất của lớp electron ngoài cùng
Mọi nguyên tử đều hướng tới trạng thái ổn định với 8 electron ở lớp ngoài cùng, ngoại trừ Helium chỉ cần 2 electron để đạt trạng thái bền.
- Lớp electron ngoài cùng là yếu tố chính xác định tính chất hóa học của nguyên tử:
Khi lớp electron ngoài cùng có dưới 4 electron (1, 2, hoặc 3 electron), nguyên tử sẽ dễ dàng nhường electron, => tính chất của kim loại.
Ngược lại, khi lớp electron ngoài cùng chứa trên 4 electron (5, 6, hoặc 7 electron), nguyên tử có xu hướng thu nhận thêm electron, => tính chất của phi kim.
Nguyên tử với 4 electron ở lớp ngoài cùng có thể biểu hiện cả tính chất kim loại lẫn phi kim.
Nguyên tử với lớp electron ngoài cùng đầy đủ 8 electron (ngoại trừ Helium chỉ cần 2 electron) thì ổn định về mặt hóa học và thường là khí hiếm.
⟹ Như vậy, từ cấu hình electron của nguyên tử, có thể dự đoán được loại nguyên tố của nó.
Lớp electron đóng vai trò thiết yếu trong việc giải thích các tính chất hóa học của nguyên tố. Hiểu biết về lớp electron giúp con người ứng dụng vào nhiều lĩnh vực khác nhau như hóa học, vật liệu khoa học, và khoa học nano. Hãy cùng yeuhoahoc.edu khám phá những điều bí ẩn và thú vị hơn nữa từ hoá học nhé!







