Giải đề thi tốt nghiệp THPT quốc gia 2022 - mã đề 204
Kỳ thi tốt nghiệp THPT quốc gia 2022 đã kết thúc, môn Hóa học là một trong những môn thi quan trọng trong tổ hợp Khoa học Tự nhiên.
Kỳ thi tốt nghiệp THPT quốc gia 2022 đã kết thúc, môn Hóa học là một trong những môn thi quan trọng trong tổ hợp Khoa học Tự nhiên. Đề thi môn Hóa học năm nay được đánh giá có độ khó vừa phải, bám sát chương trình học và có tính phân hóa cao. Dưới đây là một số lời giải chi tiết cho các câu hỏi trong đề thi, giúp các thí sinh có thể tham khảo và củng cố kiến thức của bản thân.
Đề thi tốt nghiệp THPT quốc gia 2022 – mã đề 204



Giải chi tiết Đề thi tốt nghiệp THPT quốc gia 2022 – mã đề 204
Câu 41: Kim loại nào sau đây có tính khử mạnh hơn kim loại Zn?
Trong số các kim loại được đưa ra, natri (Na) là kim loại có tính khử mạnh nhất. Điều này được phản ánh trong dãy hoạt động hóa học của kim loại, trong đó Na đứng trước Zn và các kim loại khác như Ag, Cu và Au đều có tính khử yếu hơn Zn.
– Đáp án: D. Na
Câu 42: Polime nào sau đây có chứa nguyên tố nitơ?
Poliacrilonitrin là một polime chứa nitơ trong nhóm nitril của nó. Công thức của poliacrilonitrin thường chứa nhóm -C≡N, là nguồn gốc của nguyên tố nitơ trong cấu trúc polime.
– Đáp án: A. Poliacrilonitrin
Câu 43: Chất nào sau đây có khả năng làm mềm được nước cứng vĩnh cửu?
Na2CO3 (natri cacbonat) có khả năng làm mềm nước cứng vĩnh cửu bằng cách tạo thành kết tủa với các ion canxi và magiê dưới dạng cacbonat không tan. Nó là một phương pháp hiệu quả để loại bỏ tính cứng do các ion Ca2+ và Mg2+ gây ra.
– Đáp án: D. Na2CO3
Câu 44: Kim loại Fe tác dụng với dung dịch H2SO4 loãng sinh ra khí H2 và muối nào sau đây?
Khi sắt (Fe) tác dụng với dung dịch H2SO4 loãng, sắt được oxi hóa thành ion Fe2+ và hydro được khử thành khí hydro (H2). Muối được tạo thành là FeSO4 (sắt(II) sulfat).
– Đáp án: D. FeSO4
Câu 45: Thủy phân este nào sau đây trong dung dịch NaOH thu được natri fomat?
Thủy phân este HCOOC2H5 (etyl fomat) trong dung dịch NaOH sẽ thu được natri fomat (HCOONa) và ancol (C2H5OH). Đây là một phản ứng este hóa cổ điển trong đó este của axit fomic khi thủy phân cung cấp muối của axit fomic.
– Đáp án: C. HCOOC2H5
Câu 46: Chất X có công thức CH3NH2. Tên gọi của X là
Chất X có công thức CH3NH2, được biết đến là metylamin, một amin đơn giản nhất trong số các amin được nêu.
– Đáp án: A. metylamin
Câu 47: Kim loại nào sau đây có độ cứng lớn nhất?
Kim loại có độ cứng lớn nhất
Phân tích:
Trong các kim loại được đưa ra, Crom (Cr) được biết đến là có độ cứng cao hơn so với Bạc (Ag), Vàng (Au), và Nhôm (Al).
Đáp án: :D. Cr.
Câu 48: Chất nào phản ứng với H2SO4 đặc, nóng sinh ra SO2?
Phân tích:
– FeO (oxit sắt(II)) khi phản ứng với H2SO4 đặc, nóng có thể bị oxi hoá thành Fe2(SO4)3 và giải phóng khí SO2.
Đáp án: :D. FeO.
Câu 49: Đồng phân của glucozơ
Phân tích:
– Glucozơ và Fructozo là hai đồng phân của nhau, thuộc loại monosaccharide. Cả hai đều có công thức phân tử là C6H12O6 nhưng khác nhau về cấu trúc.
– Tinh bột, Saccarozo và Xenlulozo không phải là đồng phân của glucozơ.
Đáp án: :C. Fructozo.
Câu 50: Kim loại Al tác dụng với dung dịch nào sinh ra AlCl3?
Phân tích:
– Khi kim loại Al tác dụng với dung dịch HCl, phản ứng sẽ tạo ra AlCl3 và H2.
– Các lựa Đáp án: khác không tạo thành AlCl3 khi tác dụng với Al.
Đáp án: :A. HCl.
Câu 51: Công thức của metan
Phân tích:
– Metan là hydrocarbon đơn giản nhất, với công thức hóa học CH4.
Đáp án: :D. CH4.
Câu 52: Số liên kết peptit trong phân tử peptit Gly-Ala-Gly
– Trong một chuỗi peptit, mỗi liên kết peptit được hình thành giữa nhóm cacboxyl của một axit amin với nhóm amino của axit amin tiếp theo. Gly-Ala-Gly là một tripeptide, vì vậy sẽ có hai liên kết peptit: một giữa Gly và Ala, và một giữa Ala và Gly.
– Đáp án: C. 2.
Câu 53: Dung dịch chất nào làm quỳ tím chuyển thành màu đỏ?
– Quỳ tím chuyển màu đỏ trong môi trường axit.
– NaCl không làm thay đổi pH.
– H2SO4 (axit sulfuric) là axit mạnh và sẽ làm quỳ tím chuyển màu đỏ.
– C2H5OH (ethanol) không đủ tính axit để làm thay đổi màu quỳ.
– KOH (kali hydroxide) là một bazơ mạnh và làm quỳ tím chuyển thành màu xanh.
– Đáp án: B. H2SO4.
Câu 54: Kim loại nào sau đây không phản ứng được với dung dịch CuSO4?
– Kim loại phải có tính khử mạnh hơn đồng (Cu) để phản ứng và thay thế Cu trong dung dịch CuSO4. Bạc (Ag) kém phản ứng hơn đồng và không phản ứng được với CuSO4.
– Đáp án: B. Ag.
Câu 55: Ở trạng thái cơ bản, số electron lớp ngoài cùng của nguyên tử kim loại kiềm là
– Các nguyên tố trong nhóm kim loại kiềm (nhóm 1 của bảng tuần hoàn) có một electron ở lớp ngoài cùng.
– Đáp án: B. 1.
Câu 56: Công thức cấu tạo thu gọn của anđehit fomic là
– Anđehit fomic hay còn gọi là formaldehyde có công thức hóa học là HCHO, đây là công thức đơn giản nhất mô tả cấu trúc của nó.
– Đáp án: C. HCHO.
Câu 57: Chất nào sau đây là chất béo?
– Chất béo là ester của glixerol và các axit béo. Triolein là một loại triglyceride, được tạo từ glixerol và ba gốc axit oleic.
– Đáp án: A. Triolein.
Câu 58: Kim loại kiềm thổ là những kim loại thuộc nhóm 2 của bảng tuần hoàn. Trong các lựa chọn được đưa ra, canxi (Ca) là kim loại kiềm thổ.
– Đáp án: B. Ca
Câu 59: Trong số các chất được liệt kê, nhôm (Al) phản ứng với dung dịch NaOH tạo ra khí hydro:
\( 2Al + 2NaOH + 6H_2O \rightarrow 2NaAl(OH)_4 + 3H_2 \)
– Đáp án: A. Al
Câu 60: Đồng (Cu) là kim loại không phản ứng được với dung dịch HCl do nó đứng sau hydro trong dãy hoạt động hóa học của kim loại và không có khả năng khử ion H+ trong dung dịch HCl để tạo ra khí hydro.
– Đáp án: D. Cu
Câu 61: Trong các thí nghiệm được liệt kê:
– A: Cho CaCO3 vào dung dịch HCl sinh ra khí CO2 (đơn chất).
– B: Cho Zn vào dung dịch CuSO4 sinh ra Cu kim loại (đơn chất).
– C: Cho Mg vào dung dịch HCl sinh ra H2 (đơn chất).
– D: Cho Cu vào dung dịch AgNO3 sinh ra Ag kim loại (đơn chất).
Câu 62: Công thức phân tử C3H6O2 có thể tạo ra một số este khác nhau tùy thuộc vào cấu trúc của acid và ancol tham gia. Các este có thể có từ C3H6O2 bao gồm methyl acrylate, ethyl formate, và propyl formate, v.v. Có tổng cộng 3 este chính được biết đến từ công thức này.
– Đáp án: C. 3
Câu 63: Phản ứng của hỗn hợp Fe và FeO với HNO3 đặc, nóng
Phân tích:
– Khi Fe và FeO phản ứng với HNO3 đặc, nóng, cả hai sẽ bị oxi hóa, sinh ra muối sắt(III) nitrat (Fe(NO3)3).
– Lựa chọn A, C, D không phù hợp vì các sản phẩm không phản ánh đúng bản chất của phản ứng với HNO3.
Đáp án: B. Fe(NO3)3.
Câu 64: Phát biểu sai về loại tơ
Phân tích:
– A. Đúng: Tơ nitron là loại tơ tổng hợp.
– C. Đúng: Tơ axetat là loại tơ bán tổng hợp.
– D. Đúng: Tơ nilon-6,6 thuộc loại tơ tổng hợp.
– B. Sai: Tơ visco là loại tơ tái chế từ cellulose tự nhiên, được xếp vào loại tơ bán tổng hợp chứ không phải tơ thiên nhiên.
Đáp án: B. Tơ visco thuộc loại tơ thiên nhiên.
Câu 65
Bài toán:
Hòa tan hết 1,19 gam hỗn hợp gồm Al và Zn trong dung dịch H2SO4 loãng để tạo ra muối sunfat trung hòa và khí H2.
Các phản ứng xảy ra:
– \( \text{Al} + 3\text{H}_2\text{SO}_4 \rightarrow \text{Al}_2(\text{SO}_4)_3 + 3\text{H}_2 \)
– \( \text{Zn} + \text{H}_2\text{SO}_4 \rightarrow \text{ZnSO}_4 + \text{H}_2 \)
Tính toán:
- Đầu tiên, ta tính tổng khối lượng các muối sunfat:
– \( \text{M}_\text{Al2(SO4)3} = 342 \text{ g/mol} \)
– \( \text{M}_\text{ZnSO4} = 161 \text{ g/mol} \)
- Giả sử có \( a \) mol Al và \( b \) mol Zn tham gia phản ứng:
– Tổng khối lượng Al và Zn: \( 27a + 65b = 1.19 \) (g)
– Tổng khối lượng muối: \( 342 \cdot \frac{a}{2} + 161b = 5.03 \) (g)
- Khí hydro sinh ra:
– Từ Al: \( 1.5a \) mol \( \text{H}_2 \)
– Từ Zn: \( b \) mol \( \text{H}_2 \)
\( V_{H_2} = 22.4 \times (1.5a + b) \) (lít)
Hệ phương trình:
27a + 65b = 1.19
171a + 161b &= 5.03
Giải hệ phương trình này để tìm giá trị của \( a \) và \( b \) và sau đó tính \( V_{H_2} \).
Từ giải pháp phương trình, ta có:
– \( a = 0.02 \) mol Al
– \( b = 0.01 \) mol Zn
Tính thể tích khí Hidro (H2) sinh ra:
– Tổng số mol H2 từ Al: \( 1.5 \times 0.02 = 0.03 \) mol
– Tổng số mol H2 từ Zn: \( 0.01 \) mol
– Tổng số mol H2: \( 0.03 + 0.01 = 0.04 \) mol
Biết rằng 1 mol khí chiếm 22.4 lít ở điều kiện tiêu chuẩn, ta có:
\( V_{H_2} = 0.04 \times 22.4 = 0.896 \text{ lít} \)
Đáp án: A. 0.896 lít.
Câu 66: Tính khối lượng đồng thu được khi 11,2 gam sắt tác dụng với dung dịch CuSO4 dư.
– Phản ứng hóa học giữa Fe và CuSO4:
\( \text{Fe} + \text{CuSO}_4 \rightarrow \text{FeSO}_4 + \text{Cu} \)
– Tính số mol Fe:
\(n_{\text{Fe}} = \frac{11.2 \, \text{g}}{55.85 \, \text{g/mol}} \approx 0.2 \, \text{mol}
\)
– Mỗi mol Fe giải phóng 1 mol Cu, vì vậy:
\( n_{\text{Cu}} = 0.2 \, \text{mol} \)
– Tính khối lượng Cu:
\( m_{\text{Cu}} = 0.2 \, \text{mol} \times 63.55 \, \text{g/mol} = 12.71 \, \text{g} \)
– Đáp án gần nhất: D. 12,8 g
Câu 67: Tính khối lượng bạc thu được khi phản ứng 180 gam dung dịch glucozơ 1% với dung dịch AgNO3 trong NH3.
– Tính khối lượng glucozơ:
\( m_{\text{glucozơ}} = 180 \, \text{g} \times 0.01 = 1.8 \, \text{g}\)
– Số mol glucozơ:
\(n_{\text{glucozơ}} = \frac{1.8 \, \text{g}}{180 \, \text{g/mol}} = 0.01 \, \text{mol} \)
– Phản ứng của glucozơ với AgNO3 trong NH3 là phản ứng Tollens:
\( \text{C}_6\text{H}_{12}\text{O}_6 + 2\text{Ag}^+ \rightarrow 2\text{Ag} + \text{C}_6\text{H}_{12}\text{O}_7\)
– Mỗi mol glucozơ tạo ra 2 mol Ag, vì vậy:
\(n_{\text{Ag}} = 0.01 \, \text{mol} \times 2 = 0.02 \, \text{mol}\)
– Khối lượng Ag:
\(m_{\text{Ag}} = 0.02 \, \text{mol} \times 107.87 \, \text{g/mol} = 2.1574 \, \text{g}\)
– Đáp án: B. 2,16 g
Câu 68: Tính khối lượng ban đầu của metyl axetat nếu thủy phân hoàn toàn sinh ra 8,2 gam muối.
– Phản ứng thủy phân:
\( \text{CH}_3\text{COOCH}_3 + \text{NaOH} \rightarrow \text{CH}_3\text{COONa} + \text{CH}_3\text{OH}\)
– Số mol muối (CH3COONa):
\(n_{\text{CH}_3\text{COONa}} = \frac{8.2 \, \text{g}}{82.03 \, \text{g/mol}} \approx 0.1 \,\text{mol}\)
– Metyl axetat có cùng số mol với muối trong phản ứng:
\(m_{\text{metyl axetat}} = 0.1 \, \text{mol} \times 74.08 \, \text{g/mol} = 7.408 \, \text{g}\)
– Đáp án gần nhất: B. 7,4 g
Câu 69: Đánh giá khả năng thủy phân trong môi trường axit của các chất.
– Saccarozơ và xenlulozơ đều thủy phân trong môi trường axit.
– Đáp án: A. Saccarozơ và xenlulozơ.
Câu 70: Để tính m gam muối của axit glutamic sau phản ứng với NaOH dư, chúng ta cần xác định công thức phân tử của axit glutamic và muối natri của nó.
Axit glutamic (C5H9NO4) có phân tử khối là:
\( M_{C5H9NO4} = 5 \times 12 + 9 \times 1 + 14 + 4 \times 16 = 147 \text{ g/mol} \)
Khi phản ứng với NaOH, axit glutamic sẽ tạo ra muối natri glutamat (C5H8NO4Na):
\( M_{C5H8NO4Na} = 147 + 22 – 1 = 168 \text{ g/mol} \)
(Giảm 1 đơn vị H, thêm 1 đơn vị Na)
Tính khối lượng của muối:
\( m = 0.1 \times 168 = 16.8 \text{ g} \)
Lựa chọn gần nhất với kết quả tính toán là D. 16,9 g.
Câu 71: Để tính số mol H2 phản ứng với chất béo X, ta cần xem xét phản ứng hiđro hóa các liên kết không bão hòa trong các triglixerit.
Mỗi mol glixerol sinh ra từ phản ứng xà phòng hóa cho biết đã có 1 mol triglixerit tham gia phản ứng (do mỗi triglixerit tạo ra 1 mol glixerol). Số mol glixerol là:
\( n_{glixerol} = \frac{8.096}{92} \approx 0.088 \text{ mol} \)
Như vậy, 0.088 mol triglixerit đã tham gia phản ứng xà phòng hóa. Giả sử mỗi triglixerit có 3 nhóm axit béo, mỗi nhóm có thể chứa không hoặc một số liên kết C=C không bão hòa.
Các muối được hình thành là:
– C17H35COONa (không chứa C=C)
– C17H33COONa (1 liên kết C=C)
– C17H31COONa (2 liên kết C=C)
Từ thông tin về lượng H2 tiêu thụ:
– Mỗi liên kết C=C trong axit béo sẽ tiêu thụ 1 mol H2 để hiđro hóa.
– Giả sử mỗi triglixerit có thể có tối đa 3 liên kết C=C (tối đa 3 nhóm C17H33COONa hoặc C17H31COONa), thì tổng số liên kết C=C trong 0.088 mol triglixerit là \(0.088 \times 3 = 0.264\) mol.
Tuy nhiên, vì mỗi mol C17H31COONa chứa 2 liên kết C=C, số lượng H2 tiêu thụ có thể cao hơn số liên kết C=C tối đa tính toán đơn giản. Nếu tất cả các triglixerit đều chứa 3 liên kết C=C, thì:
\( y = 3 \times n_{glixerol} = 3 \times 0.088 = 0.264 \text{ mol} \)
Vì có ba loại muối, số mol H2 thực tế có thể cao hơn, phụ thuộc vào phân phối của các axit béo không bão hòa.
Lựa chọn gần nhất là C. 0,592 mol, với giả định rằng mỗi triglixerit có 2 liên kết C=C trung bình. Điều này cho thấy rằng tính toán thực tế có thể đòi hỏi thông tin cụ thể hơn về tỷ lệ các loại axit béo trong mẫu X.
Câu 72:
Để giải quyết câu hỏi này, chúng ta cần xem xét từng thí nghiệm để xác định có tạo thành kết tủa hay không:
a) Cho dung dịch NaHSO4 vào dung dịch BaCl2.
– Phản ứng: \( \text{NaHSO}_4 + \text{BaCl}_2 \rightarrow \text{BaSO}_4 \downarrow + \text{NaCl} + \text{HCl} \)
– Sản phẩm kết tủa là BaSO4, vì BaSO4 là một chất kết tủa không tan.
b) Cho dung dịch NaOH vào nước cứng tạm thời.
– Phản ứng nước cứng tạm thời thường chứa các ion canxi và magiê dưới dạng bicarbonate. Khi cho NaOH vào:
\( \text{Ca(HCO}_3)_2 + 2\text{NaOH} \rightarrow \text{CaCO}_3 \downarrow + \text{Na}_2\text{CO}_3 + 2\text{H}_2\text{O} \)
– Sản phẩm kết tủa là CaCO3.
c) Cho dung dịch AlCl3 dư vào dung dịch NaOH.
– Phản ứng: \( \text{AlCl}_3 + 3\text{NaOH} \rightarrow \text{Al(OH)}_3 \downarrow + 3\text{NaCl} \)
– Sản phẩm kết tủa là Al(OH)3.
d) Cho bột kim loại Cu vào dung dịch Fe2(SO4)3 dư.
– Cu không đủ mạnh để khử ion Fe3+ thành Fe kim loại, do đó không có kết tủa được tạo ra ở đây vì Cu không phản ứng trong trường hợp này.
e) Cho dung dịch (NH4)2HPO4 vào nước vôi trong dư.
– Phản ứng: \( \text{(NH}_4)_2\text{HPO}_4 + \text{Ca(OH)}_2 \rightarrow \text{CaHPO}_4 \downarrow + 2\text{NH}_3 + 2\text{H}_2\text{O} \)
– Sản phẩm kết tủa là CaHPO4.
Từ những phân tích trên, có tổng cộng 4 thí nghiệm tạo ra kết tủa:
– Đáp án: A. 4.
Câu 73: Để giải bài toán hóa học này, chúng ta cần phân tích các phản ứng và xác định các chất Z và T sao cho chúng phù hợp với tất cả các phản ứng trong sơ đồ đã cho.
Phân tích:
- X + Ba(OH)2 –> Y + Z
– Phản ứng này cho thấy X tác dụng với Ba(OH)2 tạo ra chất Y và Z. Vì sản phẩm bao gồm Z và Ba(OH)2 được sử dụng, Z có thể là một loại muối của bari.
- X + T –> MgCl2 + Z
– Phản ứng này cho thấy T tác dụng với X tạo ra MgCl2 và Z. Điều này cho thấy T là một chất có khả năng phản ứng tạo ra MgCl2, đồng thời Z được tạo ra ở đây phải giống như trong phản ứng đầu tiên.
- MgCl2 + Ba(OH)2 –> Y + T
– Ở phản ứng này, T được tạo ra từ phản ứng giữa MgCl2 và Ba(OH)2, điều này cho thấy T cũng có thể là muối của bari và MgCl2 chuyển thành một muối khác.
Giả thuyết các chất:
– Giả sử X là H2SO4, khi đó:
– (1) H2SO4 + Ba(OH)2 → BaSO4 + H2O (Z là BaSO4, Y là H2O)
– (2) H2SO4 + BaCl2 → MgCl2 + BaSO4 (đây không thể xảy ra vì H2SO4 không tạo MgCl2, loại C và D)
– (3) MgCl2 + Ba(OH)2 → BaCl2 + H2O (đây không phù hợp với giả thiết T là BaCl2 tạo ra từ MgCl2)
Nếu ta giả sử X là một dung dịch chứa MgSO4:
– (1) MgSO4 + Ba(OH)2 → BaSO4 + Mg(OH)2 (Z là BaSO4, Y là Mg(OH)2)
– (2) MgSO4 + BaCl2 → MgCl2 + BaSO4 (phù hợp, Z là BaSO4, T là BaCl2)
– (3) MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2 (phù hợp, T là BaCl2)
Cả ba phản ứng đều thỏa mãn với giả thiết Z là BaSO4 và T là BaCl2.
Chọn: B. BaSO4, BaCl2.
Câu 74:
Để giải quyết bài toán này, chúng ta sẽ phân tích từng chất và phản ứng, rồi đánh giá các phát biểu.
Giả định về Cấu Trúc
E (C3H6O3) và F (C4H6O4) là các este của axit cacboxylic và ancol, nghĩa là:
– E có thể là este của một axit cacboxylic đơn giản (ví dụ axit lactic từ axit lactic) hoặc một dạng glyceride đơn giản.
– F có thể là este của một axit đicacboxylic (ví dụ malic acid hoặc succinic acid).
Phân Tích Phản Ứng
(1) và (2) E và F khi tác dụng với NaOH đều tạo ra cùng các sản phẩm X và Y, cho thấy X và Y là các ion hoặc các hợp chất từ các nhóm chức cơ bản trong cấu trúc của E và F. Có thể suy đoán X và Y là các muối natri của axit và ancol ban đầu.
(3) X + HCl –> Z + NaCl, cho thấy Z là sản phẩm acid hóa của X hoặc Y.
Đánh giá các phát biểu
(a) Phân tử chất E có một liên kết π. Không chắc chắn nếu không rõ cấu trúc cụ thể của E, nhưng nếu E là một este của một ancol no và axit no (ví dụ glycerol và axit lactic), thì không có liên kết π. → Không chắc
(b) Chất Y có thể được tạo ra trực tiếp từ etilen. Nếu Y là một ancol hoặc axit mà không có nhóm CH3, điều này khó xảy ra, vì etilen thường dẫn đến các sản phẩm có nhóm metyl khi tiến hành các phản ứng hóa học. → Sai
(c) Chất F có khả năng tham gia phản ứng tráng bạc. Nếu F là este của axit đicacboxylic có nhóm aldehyde (như malic acid), thì có thể tham gia phản ứng tráng bạc. → Có thể đúng
(d) Chất Z có số nguyên tử oxi bằng số nguyên tử hiđro. Không thể khẳng định mà không biết cấu trúc cụ thể của Z. → Không chắc
(e) Đốt cháy hoàn toàn chất X bằng O2 dư thu được Na2CO3, CO2 và H2O. Nếu X là một muối của axit hữu cơ, điều này đúng. → Đúng
Kết Luận
Chỉ có (e) là chắc chắn đúng. Phát biểu (c) có thể đúng tùy thuộc vào cấu trúc chính xác của F. Các phát biểu khác không chắc chắn hoặc sai. Như vậy, có 2 phát biểu đúng.
– Đáp án: A. 2.
Câu 76:
Đáp án D
Hướng dẫn:
19,36 gam E + 0,245 mol O2 → X + 0,15 mol SO2.
→ Bảo toàn khối lượng ta có ngày mX = 19,36 + 0,245 × 32 – 0,15 × 64 = 17,6 gam.
Xét toàn bộ quá trình X (Fe, O) + HCl, sau đó AgNO3 dư → (Ag, AgCl)] + Fe(NO3)3 + H2↑ + H2O.
Gọi nFeX = a mol và nOx = b mol thì 56a + 16b = 17,6.
Bảo toàn electron: 3nFe = 2nH2 + 2nOx + nAg → nAg = (3a – 2b – 0,15) mol.
Lại có nH2O = b mol ⇒ nHCl = (2b + 0,15) mol theo bảo toàn O và H.
→ nAgCl = nCl- = (2b + 0,15) mol ⇒ ∑m↓ = 143,5 × (2b + 0,15) + 108 × (3a – 2b – 0,15) = 102,3.
→ Giải hệ các phương trình ta được: a = 0,25 mol và b = 0,225 mol.
Vậy, kết tủa gồm 0,15 mol Ag và 0,6 mol AgCl.
→ Trước tiếp sinh ra Ag là do 0,15 mol FeCl2 trong Y.
Lại có ∑nHCl = 0,6 mol ⇒ m dung dịch HCl = 375 gam.
→ m dung dịch Y = m dung dịch HCl + mX – mH2↑ = 392,45 gam.
→ Yêu cầu C%FeCl2 trong Y = 0,15 × 127 ÷ 392,45 × 100% ≈ 4,85%.
Đáp án: D
Câu 77:
nC phần ứng = 0.23 – 0.15 = 0.08
Bảo toàn electron: 4nC phần ứng = 2nCO + 2nH2
→ nCO2 + nH2 = 0.16 → nHCO2 = 0.23 – 0.16 = 0.07
nHCl = 0.03 → nCO2 < nHCl < 2nCO2 nên Y chứa CO32-, HCO3- và Na+
Đặt u, v là số mol CO32- và HCO3- đã phản ứng
→ nHCl = 2u + v = 0.03 và nCO2 = u + v = 0.025
→ u = 0.005 và v = 0.02
Tỉ lệ nCO32- phản ứng : nHCO3- phản ứng = 1 : 4 → Y chứa Na+ (0.06), CO32- (a), HCO3- (4a)
Bảo toàn điện tích → a = a = 0.01
Bảo toàn C → nBaCO3 = 0.07 – 5a = 0.02
→ mBaCO3 = 3.94 gam
Đáp án : B
Câu 78:
Để xác định số phát biểu đúng, chúng ta cần phân tích từng phát biểu:
a) Alanin phản ứng được với dung dịch HCl.
– Đúng. Alanin là một amino acid có nhóm amino (-NH2) và nhóm carboxyl (-COOH). Nhóm amino có thể phản ứng với axit (như HCl) để tạo thành muối, ví dụ alanin hydrochloride.
b) Oxi hóa glucozơ bằng H2 (xúc tác Ni, to) thu được sobitol.
– Sai. Việc dùng H2 với xúc tác Ni ở nhiệt độ cao là phản ứng khử, không phải oxi hóa. Khi khử glucozơ, thu được sobitol (đường rượu), không phải oxi hóa.
c) Phenol (C6H5OH) tan trong dung dịch NaOH loãng, dư.
– Đúng. Phenol là một axit yếu và có thể phản ứng với dung dịch NaOH để tạo thành muối phenolate, do đó tan trong dung dịch kiềm.
d) Đồng trùng hợp buta-1,3-đien với stiren (xúc tác Na) thu được cao su buna-S.
– Đúng. Đây là phản ứng đồng trùng hợp của buta-1,3-đien (một loại monome của cao su buna) và stiren, sử dụng xúc tác Na để tạo cao su buna-S, một loại cao su tổng hợp.
e) Đun nóng tripanmitin với dung dịch H2SO4 loãng sẽ xảy ra phản ứng thủy phân.
– Đúng. Tripanmitin là một triglyceride, và có thể thủy phân trong môi trường axit như H2SO4 loãng để tạo glycerol và axit béo (ở đây là axit palmitic).
Tổng số phát biểu đúng là 4.
Đáp án: D. 4.
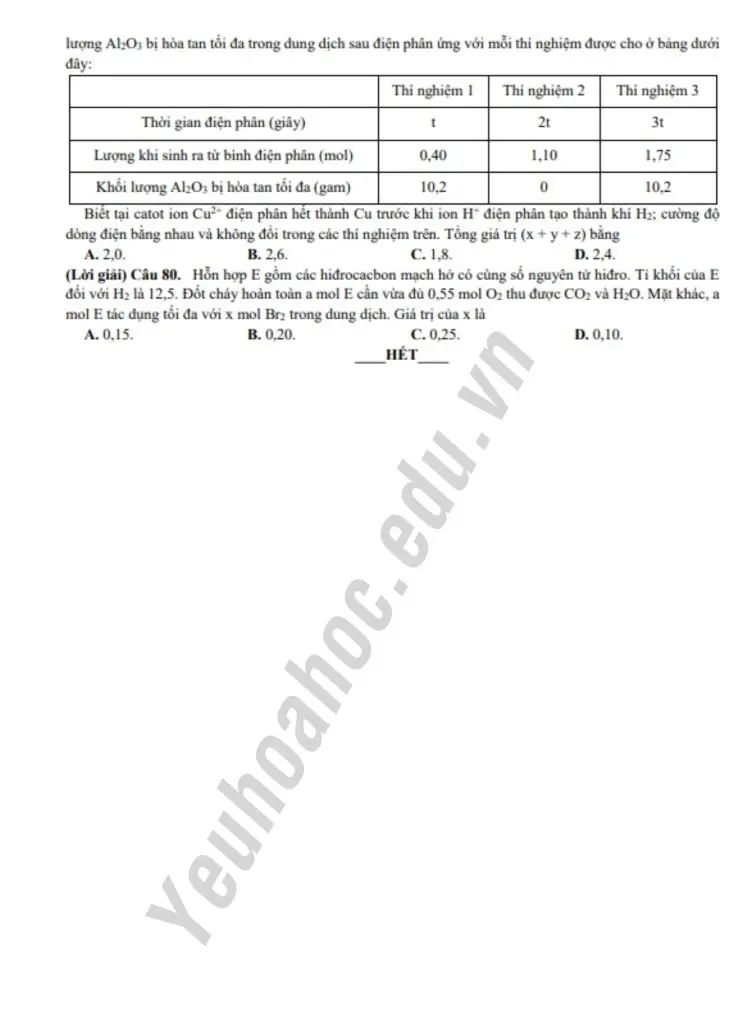
Câu 79:
Thử từ catot bởi điện phân: Cu^2+ + H^+ axit → H_2O.
* Thử từ anot bởi điện phân: Cr → H_2O.
Bắt đầu từ thí nghiệm 2: dùng dịch sau điện phân không phản ứng với Al_2O_3.
→ Dung dịch chỉ chứa Na_2SO_4, hoặc (Na_2SO_4 và NaCl).
→ Nếu chỉ chứa Na_2SO_4, thì thoát giản 3t sau đó dung dịch sau phản ứng cũng chỉ chứa Na_2SO_4 → làm sạch hoàn toàn được Al_2O_3 (bởi thực chất chỉ là quá trình điện phân nước).
→ Như vậy, dung dịch chứa Na_2SO_4 và NaCl, thoát giản 3t sau đó NaCl điện phân tạo NaOH hoàn toàn 0,1 mol Al_2O_3 tạo 0,2 mol NaAlO_2 → số mol NaCl là 0,2 mol.
→ Như vậy, ở thí nghiệm 1, hòa tan 0,1 mol Al_2O_3 là do 0,6 mol H^+.
→ Xét TH1: tỉ giá chưa thoát ra khí H_2 = nCl_2 = ∑nkhí = 0,40 mol
→ số mol e trao đổi (t giây) là 0,8 mol.
→ 2t giây tương ứng có số mol e trao đổi (2t giây) là 1,6 mol và anot ra 0,8 mol Cl_2.
Tổng khí 2 cực là 1,0 mol → số mol H_2 ra bên catot là 0,2 mol → y = 0,2.
Bên catot ra x mol Cu và 0,2 mol H_2 → 2x + 0,2 x 2 = 1,6 → x = 0,6.
0,8 mol Cl_2 thoát ra, dung dịch còn 0,2 mol Cl trong NaCl.
→ Tổng số mol Cl bằng 0,8 x 2 + 0,2 = 1,8 mol = z = 1,8.
3t giây tương ứng có số mol e trao đổi (3t giây) là 2,4 mol
→ anot ra 0,9 mol Cl_2 và \( \frac{2,4 – 0,9 \times 2}{4} \) = 0,15 mol O_2.
Bên catot ra 0,6 mol Cu và \( \frac{2,4 – 0,6 \times 2}{2} \) = 0,6 mol.
→ Tổng mol khí thu được sau 3t giây là 0,9 + 0,15 + 0,6 = 1,65 mol (không thoả mãn).
→ Xét TH2: tỉ giây đã có khí H_2 thoát ra bên catot.
→ t = t1 (giây) → 2t1 (giây) chỉ xảy ra đến phần 2HCl → H_2 + Cl_2.
→ khí tăng 1,0 – 0,4 = 0,6 mol = n_treo đổi (t giây) = 0,6 mol.
→ \( t_1(giây) / dấu : \) bên anot ra 0,3 mol Cl_2, nH_2 = 0,1 mol = nCu = 0,2 mol x = 0,2.
→ 2t giây: trao đổi 1,2 mol e → bên anot ra 0,6 mol Cl_2 → nh
_2 = 0,4 mol → y = 0,4.
→ 3t giây: trao đổi \( 1,8 mol \times 3 = 1,8 \) mol e → anot ra 0,7 mol Cl_2 và 0,1 mol O_2.
catot ra 0,2 mol Cu và 0,7 mol H_2 → ∑nkhí = 0,7 + 0,1 + 0,7 = 1,5 (thoả mãn).
Yêu cầu tổng giá trị (x + y + z) là 0,2 + 0,4 + 1,8 = 2,4.
Đáp án: D
Câu 80:
Giả thiết \( d_{\text{C}_7\text{H}_8} = 12,5 \) \( \Rightarrow M_e = 25 \).
– Chỉ có metan \( \text{CH}_4 \), \( C_0 \) \( M = 16 < 25 \) nên E chứa \( \text{CH}_4 \).
mà “E gồm các hidrocarbon mạch hở có cùng số nguyên tử hidro”
→ E có dạng \( C_nH_{4n} = 12n + 4 = 25 \) \( \Rightarrow n = 1.75 \).
* Giải đốt: a mol \( C_1.75H_4 \) + 0,55 mol \( O_2 \) \( \Rightarrow \) 1,75a mol \( CO_2 \) + 2a mol \( H_2O \).
→ Bảo toàn nguyên tố O: \( 0.175a \times 2 + 2a = 0.55 \times 2 \) \( \Rightarrow a = 0.2 \) mol.
→ đốt 0,2 mol E thu được 0,35 mol \( CO_2 \) + 0,4 mol \( H_2O \).
Tương quan đốt: \( \Sigma n_{CO2} – \Sigma n_{H2O} = n_{B2} \) phản ứng \( = n_e \).
→ \( 0.35 – 0.4 \times \frac{1}{2} = 0.2 \times x = 0.15 \) mol \( \Rightarrow \)
Chọn đáp án A.
Với những lời giải chi tiết được trình bày ở trên, hy vọng các thí sinh đã có thể hiểu rõ hơn về cách giải các câu hỏi trong đề thi môn Hóa học THPT quốc gia 2022. Từ đó, các thí sinh có thể rút ra kinh nghiệm cho bản thân để ôn tập hiệu quả hơn cho những kỳ thi tiếp theo.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.







