Ethanol là chất gì? Khám phá tính chất và ứng dụng của ethanol
Ethanol là một hợp chất hóa học phổ biến, được biết đến nhiều trong ngành công nghiệp, y học và thậm chí trong đời sống hàng ngày. Ethanol là thành phần chính trong đồ uống có cồn, nhưng nó còn được sử dụng làm chất khử trùng
Ethanol là một hợp chất hóa học phổ biến, được biết đến nhiều trong ngành công nghiệp, y học và thậm chí trong đời sống hàng ngày. Ethanol là thành phần chính trong đồ uống có cồn, nhưng nó còn được sử dụng làm chất khử trùng, dung môi và nhiên liệu. Vậy ethanol là chất gì mà lại có nhiều ứng dụng như vậy? Hãy cùng khám phá những đặc tính độc đáo và vai trò quan trọng của ethanol trong các phản ứng hóa học.
Ethanol là gì?
Ethanol là thành viên thứ hai của dãy đồng đẳng của rượu có thành viên đầu tiên là methanol. Ethanol còn được gọi là rượu Ethyl, là loại đồ uống có cồn phổ biến và được sử dụng rộng rãi nhất, do đó đôi khi nó được gọi đơn giản là rượu.
Ethanol được sản xuất ở quy mô lớn bằng cách lên men carbohydrate (phương pháp được sử dụng cho đồ uống có cồn) và hydrat hóa ethylene. Trong quá trình lên men, nấm men được sử dụng để chuyển đổi carbohydrate (mía, củ cải đường, lúa mì, ngô, v.v.) thành ethanol, và trong phương pháp hydrat hóa ethylene, ethanol được sản xuất bằng cách truyền hỗn hợp ethylene và hơi nước qua chất xúc tác có tính axit ở nhiệt độ và áp suất.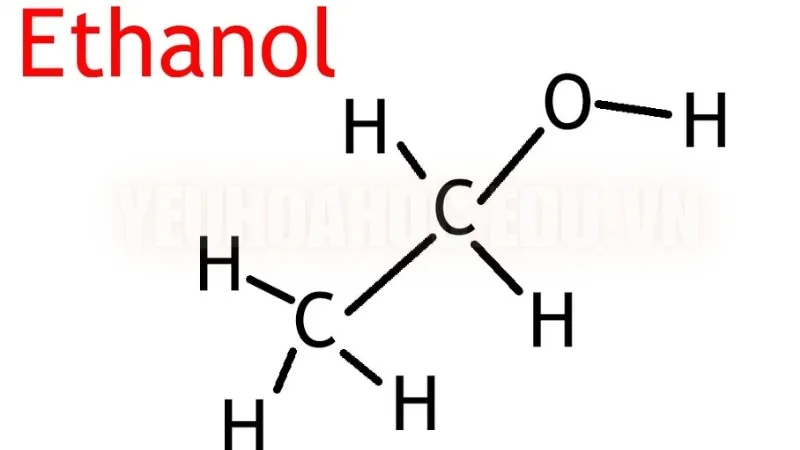
Các loại Ethanol
Do ethanol nguyên chất (dùng trong đồ uống có cồn) bị đánh thuế cao vì nó được coi là chất có tác dụng hướng thần, nên người ta sản xuất ra nhiều loại ethanol khác nhau để phục vụ các mục đích khác nhau:
Ethanol tinh khiết
Đây là loại ethanol đạt độ tinh khiết cao và thường được sử dụng trong công nghiệp, y tế, và nghiên cứu. Nó có thể dùng để sản xuất thuốc, mỹ phẩm hoặc làm dung môi cho các ứng dụng hóa học. Ethanol tinh khiết có thể uống được nhưng thường không dành cho mục đích giải trí vì chi phí cao.
Rượu biến tính
Loại ethanol này được trộn thêm các chất phụ gia, thường là các chất tạo vị đắng hoặc độc hại, để ngăn ngừa việc tiêu thụ như rượu uống. Vì đã được “biến tính” nên rượu này không bị đánh thuế như rượu uống và thường được sử dụng trong công nghiệp, làm dung môi, hoặc cho các mục đích tẩy rửa.
Cồn tuyệt đối
Đây là loại ethanol có độ tinh khiết cao nhất, gần như không chứa nước (gần 100% ethanol). Nó thường được sử dụng trong nghiên cứu và công nghiệp, nơi cần loại bỏ hoàn toàn nước trong dung môi. Do độ tinh khiết cao, cồn tuyệt đối không thích hợp cho tiêu thụ và có thể gây nguy hiểm nếu uống.
Rượu tinh cất
Đây là hỗn hợp ethanol với tỷ lệ 96% ethanol và 4% nước. Đây là nồng độ cao nhất mà ethanol có thể đạt được thông qua chưng cất do đặc tính azeotropic (khiến hỗn hợp ethanol-nước sôi và bay hơi cùng nhau ở tỷ lệ này). Loại rượu này thường được sử dụng trong phòng thí nghiệm và công nghiệp, nhưng không dành cho mục đích tiêu thụ trực tiếp.
Công thức của Ethanol
Ethanol có công thức phân tử là C₂H₆O, cho thấy nó chứa hai nguyên tử carbon, sáu nguyên tử hydro và một nguyên tử oxy. Công thức cấu tạo của ethanol, C₂H₅OH, cung cấp thêm thông tin về cấu trúc phân tử của nó: ethanol có một chuỗi hai nguyên tử carbon với một nhóm hydroxyl (-OH) gắn ở cuối. Chính nhóm -OH này tạo ra đặc tính cồn của ethanol và ảnh hưởng đến cách thức hoạt động của nó trong các dung môi và phản ứng hóa học.
Các phản ứng liên quan đến Ethanol
Phản ứng của Ethanol với Natri
Xem thêm: Natri và các phản ứng liên quan đến Natri
Khi ethanol phản ứng với natri, sản phẩm thu được là khí hydro và natri etoxide. Phương trình phản ứng như sau:
\[2 \text{Na} + 2 \text{C}_2\text{H}_5\text{OH} \rightarrow 2 \text{C}_2\text{H}_5\text{ONa} + \text{H}_2\]
Trong phản ứng này, natri (Na) phản ứng với ethanol (\(\text{C}_2\text{H}_5\text{OH}\)) tạo ra khí hydro (\(\text{H}_2\)) và hợp chất natri etoxide (\(\text{C}_2\text{H}_5\text{ONa}\)).
Phản ứng tách nước của Ethanol xúc tác bằng axit
Khi đun nóng ethanol ở nhiệt độ khoảng 443K với lượng axit sulfuric đặc, sản phẩm thu được là anken (ethylene) và nước. Phương trình phản ứng như sau:
\[\text{C}_2\text{H}_5\text{OH} \xrightarrow{\text{H}_2\text{SO}_4} \text{C}_2\text{H}_4 + \text{H}_2\text{O}\]
Trong phản ứng này, nước được tách ra khỏi ethanol nhờ sự có mặt của axit sulfuric đặc (\(\text{H}_2\text{SO}_4\)), đóng vai trò chất xúc tác.
Dưới đây là phần giải thích chi tiết và dễ hiểu hơn về các tính chất vật lý và hóa học của ethanol.
Tính chất vật lý của Ethanol
Trạng thái và màu sắc: Ethanol là chất lỏng không màu ở nhiệt độ phòng, có mùi dễ chịu và vị cay nhẹ.
Độ bay hơi: Ethanol dễ bay hơi với nhiệt độ sôi thấp, khoảng 78,5°C, nên có thể bay hơi nhanh khi tiếp xúc với không khí.
Điểm nóng chảy: Ethanol có điểm nóng chảy thấp là -114°C, tức là ở nhiệt độ rất thấp, ethanol sẽ chuyển sang trạng thái rắn.
Trọng lượng riêng và khối lượng riêng: Ethanol có trọng lượng riêng là 0,8, nhẹ hơn nước nên không nổi lên khi hòa tan trong nước.
Khả năng hòa tan: Ethanol tan hoàn toàn trong nước và có thể hòa trộn với nước ở mọi tỷ lệ. Điều này làm cho ethanol trở thành dung môi lý tưởng trong nhiều ứng dụng.
Tính chất trung tính: Ethanol không làm đổi màu giấy quỳ, nghĩa là nó có tính chất trung tính, không phải là axit hay bazơ.
Liên kết cộng hóa trị: Ethanol là một hợp chất cộng hóa trị với các liên kết hóa học mạnh giữa các nguyên tử trong phân tử.
Tính chất hóa học của Ethanol
Phản ứng đốt cháy: Ethanol là chất rất dễ cháy. Khi cháy trong không khí, nó phản ứng với oxy để tạo ra carbon dioxide (CO₂), hơi nước (H₂O), nhiệt và ánh sáng:
\[\text{C}_2\text{H}_5\text{OH} + 3\text{O}_2 \rightarrow 2\text{CO}_2 + 3\text{H}_2\text{O} + \text{nhiệt} + \text{ánh sáng}\]
Đây là phản ứng tỏa nhiều nhiệt, nên ethanol thường được sử dụng làm nhiên liệu.
Phản ứng oxy hóa: Khi đun nóng ethanol với dung dịch kali permanganat (KMnO₄) hoặc kali dicromat trong môi trường axit, ethanol bị oxy hóa thành axit etanoic (axit acetic):
\[\text{C}_2\text{H}_5\text{OH} + 2[\text{O}] \rightarrow \text{CH}_3\text{COOH} + \text{H}_2\text{O}\]
Phản ứng này thường được sử dụng trong phòng thí nghiệm để kiểm tra sự có mặt của ethanol.
Phản ứng tách nước: Khi đun nóng ethanol ở 170°C với axit sulfuric đặc (\(\text{H}_2\text{SO}_4\)), ethanol mất nước để tạo thành eten (ethylene):
\[\text{C}_2\text{H}_5\text{OH} \rightarrow \text{C}_2\text{H}_4 + \text{H}_2\text{O}\]
Axit sulfuric trong phản ứng này đóng vai trò là chất khử nước, giúp tách nước ra khỏi ethanol.
Phản ứng với Natri: Khi ethanol phản ứng với kim loại natri, nó tạo ra natri etoxide và khí hydro:
\[2\text{C}_2\text{H}_5\text{OH} + 2\text{Na} \rightarrow 2\text{C}_2\text{H}_5\text{ONa} + \text{H}_2\]
Phản ứng này thường được dùng để nhận biết sự có mặt của nhóm hydroxyl (-OH) trong rượu.
Phản ứng este hóa: Ethanol phản ứng với axit etanoic (axit acetic) khi có mặt axit sulfuric đặc làm chất xúc tác, tạo thành etyl etanoat (ethyl acetate), một este có mùi ngọt:
\[\text{C}_2\text{H}_5\text{OH} + \text{CH}_3\text{COOH} \rightarrow \text{CH}_3\text{COOC}_2\text{H}_5 + \text{H}_2\text{O} \]
Phản ứng này là một ví dụ điển hình của quá trình este hóa, được ứng dụng để sản xuất các hợp chất có hương thơm trong công nghiệp.
Ethanol có nhiều tính chất vật lý và hóa học quan trọng, giúp nó được ứng dụng rộng rãi trong các ngành như y học, công nghiệp hóa chất, thực phẩm và sản xuất nhiên liệu.
Lợi ích của Ethanol
Ethanol là một hợp chất hóa học phổ biến và có nhiều lợi ích trong các lĩnh vực khác nhau:
Trong y học: Ethanol được sử dụng như một chất khử trùng mạnh, dùng để làm sạch bề mặt phẫu thuật và vết thương, tiêu diệt hầu hết các loại vi sinh vật gây bệnh. Ngoài ra, ethanol cũng được dùng để sản xuất các loại thuốc chiết xuất và thuốc nhỏ giọt.
Lợi ích đối với sức khỏe (khi sử dụng đúng liều lượng): Ở liều lượng nhỏ, ethanol có thể giúp cải thiện tuần hoàn máu, giãn mạch máu và hỗ trợ chức năng tiêu hóa. Trong một số trường hợp, ethanol còn có tác dụng giảm đau tạm thời và được sử dụng trong phòng ngừa các bệnh tim mạch.
Trong thẩm mỹ: Do tính chất sát trùng, ethanol là thành phần chính trong nhiều sản phẩm làm sạch da, đặc biệt là các loại kem dành cho da dầu hoặc da dễ bị mụn.
Ứng dụng của Ethanol
Ethanol có mặt trong hầu hết các ngành công nghiệp nhờ tính chất đa năng của nó:
- Sản xuất dược phẩm: Là thành phần chính trong thuốc sát trùng, thuốc giảm đau và các dung dịch chiết xuất.
- Sản phẩm thẩm mỹ: Làm nguyên liệu cho các sản phẩm chăm sóc da, giúp khử trùng và làm sạch.
- Trong ngành công nghiệp thực phẩm: Ethanol được sử dụng làm dung môi cho hương liệu và các chất bảo quản.
- Trong sản xuất nhiên liệu sinh học: Ethanol là thành phần quan trọng của xăng sinh học (E10, E85), giúp giảm khí thải độc hại và bảo vệ môi trường.
Tác hại của Ethanol
Mặc dù ethanol có nhiều lợi ích, nhưng việc lạm dụng hoặc sử dụng không đúng cách có thể gây ra nhiều tác hại:
- Ngộ độc: Sử dụng ethanol quá liều có thể dẫn đến ngộ độc nghiêm trọng, gây tổn thương hệ thần kinh và thậm chí hôn mê.
- Phụ thuộc vào rượu: Ethanol là thành phần chính của đồ uống có cồn và gây ra sự phụ thuộc tâm lý và thể chất. Nghiện rượu là một bệnh lý nghiêm trọng, ảnh hưởng xấu đến sức khỏe thể chất và tinh thần.
- Tác động lâu dài lên cơ thể: Sử dụng ethanol thường xuyên và quá mức có thể gây tổn thương cho nhiều cơ quan như não, gan, thận, tim và hệ tiêu hóa. Tác hại bao gồm suy giảm trí nhớ, suy nhược thần kinh, các bệnh về gan, mạch máu và giảm khả năng sinh lý ở nam giới.

Tóm lại, ethanol là một chất có vai trò quan trọng trong cả công nghiệp và đời sống. Từ việc là thành phần chính trong các loại đồ uống có cồn, chất khử trùng, đến dung môi và nhiên liệu, ethanol đã chứng minh tính đa năng và hữu ích của mình. Tuy nhiên, việc hiểu rõ ethanol là chất gì sẽ giúp chúng ta sử dụng nó một cách an toàn và hiệu quả nhất, tận dụng tối đa lợi ích và tránh được những tác hại tiềm ẩn.
Bài Viết Liên Quan
P.GS Kiều Oanh với kinh nghiệm hơn 20 năm trong vực hóa học và giảng dạy cùng với niềm đam mê nghiên cứu khoa học. Các bài viết của tác giả mang tính chuyên sâu, cung cấp thông tin dễ hiểu, chính xác và cập nhật. Với phong cách diễn đạt rõ ràng, bà giúp người đọc nắm bắt các khái niệm khoa học một cách dễ dàng và sinh động.







