Đồng vị: Khái niệm, phân loại, ứng dụng và bài tập
Hãy cùng chúng tôi bước vào hành trình khám phá bản chất, phân loại, vai trò và ứng dụng đa dạng của đồng vị, mở ra cánh cửa tri thức về thế giới vi mô.
Đồng vị – những phiên bản khác nhau của cùng một nguyên tố, mang trong mình sức mạnh phi thường, góp phần kiến tạo nên vạn vật xung quanh ta. Hãy cùng chúng tôi bước vào hành trình khám phá bản chất, phân loại, vai trò và ứng dụng đa dạng của đồng vị, mở ra cánh cửa tri thức về thế giới vi mô đầy tiềm năng và hứa hẹn.
Khái niệm đồng vị
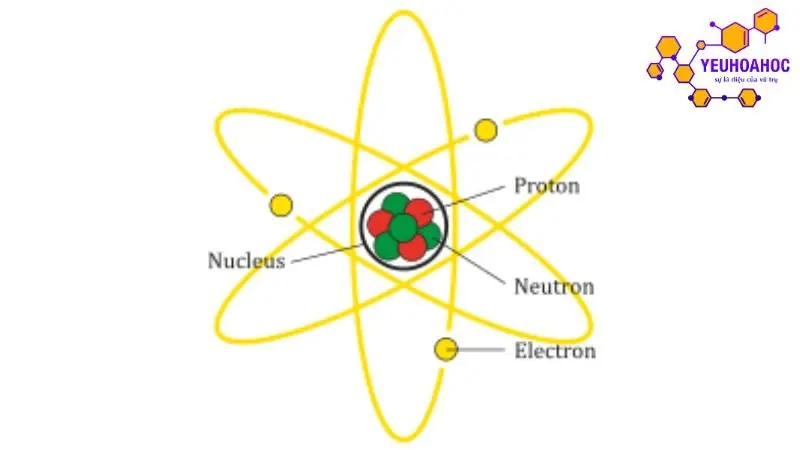
Đồng vị là các dạng biến thể của một nguyên tố hóa học, trong đó hạt nhân nguyên tử có cùng số hiệu nguyên tử (Z) nhưng khác nhau về số nơtron (N) và do đó có số khối (A) khác nhau.
Số hiệu nguyên tử (Z): Là số proton trong hạt nhân nguyên tử. Xác định vị trí nguyên tố trong bảng tuần hoàn các nguyên tố hóa học. Ví dụ: Carbon (C) có Z = 6, nghĩa là có 6 proton trong hạt nhân.
Số khối (A): Là tổng số proton và nơtron trong hạt nhân nguyên tử. Ví dụ: Carbon-12 (¹²C) có A = 12, nghĩa là có 6 proton và 6 nơtron trong hạt nhân.
Số nơtron (N): Là số nơtron trong hạt nhân nguyên tử. Tính bằng N = A – Z. Ví dụ: Carbon-12 (¹²C) có N = 12 – 6 = 6 nơtron.
Ví dụ:
- Nguyên tố Hydro (H): Có 3 đồng vị phổ biến:
- Hydro-1 (¹H): 1 proton, 0 nơtron (nhẹ nhất)
- Hydro-2 (²H): 1 proton, 1 nơtron (deuterium)
- Hydro-3 (³H): 1 proton, 2 nơtron (tritium, phóng xạ)
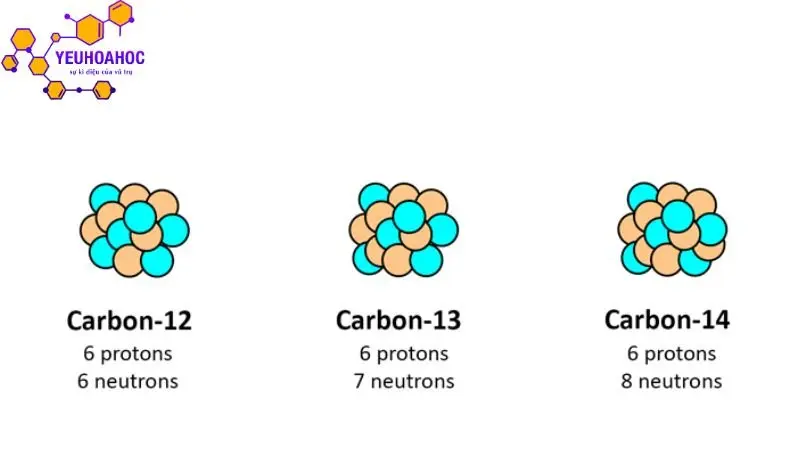
- Nguyên tố Carbon (C): Có 15 đồng vị đã biết, trong đó phổ biến nhất là:
- Carbon-12 (¹²C): 6 proton, 6 nơtron (chiếm 98,89% tự nhiên)
- Carbon-13 (¹³C): 6 proton, 7 nơtron (chiếm 1,11% tự nhiên)
- Carbon-14 (¹⁴C): 6 proton, 8 nơtron (phóng xạ, dùng để xác định niên đại)
Sự khác biệt giữa đồng vị và nguyên tố hóa học:
- Đồng vị: Là các dạng biến thể của cùng một nguyên tố, có cùng số hiệu nguyên tử (Z) nhưng khác nhau về số nơtron (N) và số khối (A).
- Nguyên tố hóa học: Là tập hợp các nguyên tử có cùng số hiệu nguyên tử (Z). Ví dụ: Oxygen (O) có Z = 8, là một nguyên tố hóa học bao gồm tất cả các nguyên tử có 8 proton trong hạt nhân.
Ví dụ minh họa
Giả sử ta có hai nguyên tử Carbon:
- Nguyên tử thứ nhất: ¹²C (Carbon-12)
- Số hiệu nguyên tử (Z): 6
- Số nơtron (N): 6
- Số khối (A): 12
- Nguyên tử thứ hai: ¹³C (Carbon-13)
- Số hiệu nguyên tử (Z): 6
- Số nơtron (N): 7
- Số khối (A): 13
Phân loại đồng vị
Đồng vị bền
Đặc điểm:
-
- Không tự phân rã phóng xạ.
- Có cấu trúc hạt nhân ổn định.
- Chiếm phần lớn trong tự nhiên.
Tính chất:
-
- Tham gia vào các phản ứng hóa học theo quy luật hóa học.
- Ví dụ: Carbon-12 (¹²C), Oxygen-16 (¹⁶O), Iron-56 (⁵⁶Fe).
Đồng vị phóng xạ
Đặc điểm:
-
- Tự phân rã phóng xạ, giải phóng năng lượng và biến đổi thành nguyên tố khác.
- Có cấu trúc hạt nhân không ổn định.
- Một số tồn tại trong tự nhiên, một số được tạo ra nhân tạo.
Tính chất:
-
- Phát ra các tia phóng xạ α, β, γ.
- Có thể sử dụng trong y học, công nghiệp, khảo cổ học,…
- Ví dụ: Uranium-238 (²³⁸U), Iodine-131 (¹³¹I), Cesium-137 (¹³⁷Cs).
Đồng vị kích thích
Đặc điểm:
-
- Là trạng thái kích thích của đồng vị bền.
- Có năng lượng cao hơn trạng thái cơ bản.
- Tồn tại trong thời gian ngắn và chuyển về trạng thái cơ bản bằng cách phát ra photon (tia gamma).
Tính chất:
-
- Được tạo ra do sự hấp thụ bức xạ hoặc va chạm hạt nhân.
- Tham gia vào các phản ứng hạt nhân.
- Có ứng dụng trong y học, chẩn đoán hình ảnh,…
- Ví dụ: Technetium-99m (⁹⁹mTc), Cobalt-60 (⁶⁰Co).
Bảng tóm tắt:
| Loại đồng vị | Đặc điểm | Tính chất | Ví dụ |
| Đồng vị bền | Không phóng xạ | Tham gia phản ứng hóa học | ¹²C, ¹⁶O, ⁵⁶Fe |
| Đồng vị phóng xạ | Phân rã phóng xạ | Phát ra tia phóng xạ | ²³⁸U, ¹³¹I, ¹³⁷Cs |
| Đồng vị kích thích | Trạng thái kích thích của đồng vị bền | Phát ra photon | ⁹⁹mTc, ⁶⁰Co |
Nguồn gốc hình thành đồng vị
Phân rã hạt nhân
Quá trình: Hạt nhân nguyên tử tự phân rã thành một hoặc nhiều hạt nhân khác, giải phóng năng lượng và bức xạ.
Loại đồng vị hình thành: Đồng vị phóng xạ.
Ví dụ:
Phân rã alpha: Phân rã alpha (α) xảy ra khi 2 proton và 2 nơtron được tách ra khỏi hạt nhân, tạo thành hạt nhân con và hạt alpha (helium-4). Ví dụ: Phân rã alpha của Uranium-238 (²³⁸U) thành Thorium-234 (²³⁴Th) và hạt alpha.
Phân rã beta: Phân rã beta (β) xảy ra khi một nơtron biến đổi thành proton hoặc ngược lại, đồng thời phát ra tia beta (electron hoặc positron) và antineutrino. Ví dụ: Phân rã beta trừ của Carbon-14 (¹⁴C) thành Nitrogen-14 (¹⁴N) và tia beta trừ.
Phân rã gamma: Phân rã gamma (γ) xảy ra khi hạt nhân chuyển từ trạng thái năng lượng cao sang trạng thái năng lượng thấp hơn, phát ra tia gamma (photon). Ví dụ: Phân rã gamma của Technetium-99m (⁹⁹mTc) thành Technetium-99 (⁹⁹Tc) và tia gamma.
Phân hạch hạt nhân
Quá trình: Hạt nhân nặng (như Uranium-235) bị vỡ thành hai hoặc nhiều hạt nhân nhẹ hơn, giải phóng một lượng lớn năng lượng và neutron.
Loại đồng vị hình thành: Đồng vị mới của các nguyên tố nhẹ hơn.
Ví dụ:Phản ứng phân hạch hạt nhân Uranium-235 (²³⁵U) tạo ra Barium-141 (¹⁴¹Ba), Krypton-92 (⁹²Kr), và 3 neutron.
Tổng hợp hạt nhân
- Quá trình: Hai hoặc nhiều hạt nhân nhẹ kết hợp với nhau để tạo thành một hạt nhân nặng hơn, giải phóng năng lượng.
- Loại đồng vị hình thành: Đồng vị mới của các nguyên tố nặng hơn.
- Ví dụ:Tổng hợp hạt nhân Helium-4 (⁴He) từ Hydrogen-1 (¹H) trong lòng Mặt Trời.
Vai trò của đồng vị phóng xạ
Nghiên cứu khoa học:
- Sử dụng đồng vị phóng xạ để đánh dấu các phân tử sinh học, theo dõi quá trình trao đổi chất trong cơ thể, và chẩn đoán bệnh.
- Xác định niên đại của các mẫu vật cổ đại bằng phương pháp phân tích carbon-14 (¹⁴C).
Ứng dụng thực tế:
- Sử dụng đồng vị phóng xạ trong điều trị ung thư (xạ trị).
- Khử trùng thực phẩm và dụng cụ y tế bằng tia gamma.
- Phát hiện rò rỉ trong đường ống và bể chứa bằng đồng vị phóng xạ.
Ứng dụng của đồng vị
Y học
Chẩn đoán bệnh:
- Sử dụng đồng vị phóng xạ để đánh dấu các phân tử sinh học, theo dõi quá trình trao đổi chất trong cơ thể, và chẩn đoán bệnh. Ví dụ: Sử dụng Iod-131 (¹³¹I) để chẩn đoán và điều trị bệnh tuyến giáp.
- Chụp X-quang y tế sử dụng các đồng vị phóng xạ như Technetium-99m (⁹⁹mTc) và Thallium-201 (²⁰¹Tl).
Điều trị bệnh:
- Xạ trị sử dụng các đồng vị phóng xạ có năng lượng cao để tiêu diệt tế bào ung thư. Ví dụ: Sử dụng Cobalt-60 (⁶⁰Co) và Iodine-131 (¹³¹I) để điều trị ung thư.
- Liệu pháp miễn dịch sử dụng các kháng thể được đánh dấu bằng đồng vị phóng xạ để nhắm mục tiêu và tiêu diệt tế bào ung thư.
Công nghiệp
- Kiểm tra không phá hủy: Sử dụng tia gamma từ đồng vị phóng xạ như Cobalt-60 (⁶⁰Co) và Iridium-192 (¹⁹²Ir) để kiểm tra các khuyết tật trong kim loại và các vật liệu khác.
- Xác định vị trí rò rỉ: Sử dụng đồng vị phóng xạ để xác định vị trí rò rỉ trong đường ống và bể chứa.
- Khử trùng: Sử dụng tia gamma từ đồng vị phóng xạ như Cobalt-60 (⁶⁰Co) để khử trùng thực phẩm, dụng cụ y tế và các sản phẩm khác.
Nông nghiệp
- Nghiên cứu sinh trưởng thực vật: Sử dụng đồng vị phóng xạ để theo dõi sự hấp thụ chất dinh dưỡng của cây trồng và phát triển các giống cây trồng mới.
- Kiểm soát côn trùng: Sử dụng tia gamma từ đồng vị phóng xạ như Cobalt-60 (⁶⁰Co) để khử trùng côn trùng gây hại cho cây trồng.
- Bảo quản thực phẩm: Sử dụng tia gamma từ đồng vị phóng xạ như Cobalt-60 (⁶⁰Co) để bảo quản thực phẩm và kéo dài thời hạn sử dụng.
Khoa học nghiên cứu
- Xác định niên đại: Sử dụng phương pháp phân tích carbon-14 (¹⁴C) để xác định niên đại của các mẫu vật khảo cổ học và địa chất.
- Nghiên cứu môi trường: Sử dụng đồng vị phóng xạ để theo dõi sự di chuyển của các chất ô nhiễm trong môi trường.
- Phát triển vật liệu mới: Sử dụng đồng vị phóng xạ để nghiên cứu các tính chất của vật liệu mới và phát triển các ứng dụng mới.
Ảnh hưởng của đồng vị phóng xạ
Tác động tích cực
Y học:
- Chẩn đoán và điều trị bệnh ung thư hiệu quả.
- Phát triển các phương pháp y học hạt nhân mới.
- Khử trùng dụng cụ y tế và thiết bị y tế.
Công nghiệp:
- Kiểm tra chất lượng sản phẩm, phát hiện lỗi.
- Khử trùng thực phẩm và bảo quản thực phẩm.
- Phát triển các vật liệu mới với tính năng vượt trội.
Nông nghiệp:
- Nghiên cứu và cải thiện năng suất cây trồng.
- Kiểm soát dịch bệnh và sâu bệnh hại.
- Bảo quản nông sản và thực phẩm.
Khoa học nghiên cứu:
- Xác định niên đại của các hiện vật lịch sử và khảo cổ học.
- Nghiên cứu các quá trình tự nhiên và môi trường.
- Phát triển các công nghệ mới.
Tác động tiêu cực
Nguy cơ sức khỏe:
- Tiếp xúc với bức xạ ion hóa từ đồng vị phóng xạ có thể gây hại cho sức khỏe, dẫn đến các bệnh ung thư, đột biến gen, và các vấn đề sức khỏe khác.
- Tai nạn rò rỉ phóng xạ có thể gây ô nhiễm môi trường và ảnh hưởng nghiêm trọng đến sức khỏe con người.
Nguy cơ an ninh:
- Đồng vị phóng xạ có thể được sử dụng cho mục đích khủng bố hoặc chế tạo vũ khí hạt nhân.
- Việc quản lý và lưu trữ đồng vị phóng xạ không an toàn có thể dẫn đến nguy cơ mất cắp hoặc sử dụng sai mục đích.
Biện pháp an toàn khi sử dụng đồng vị phóng xạ
- Tuân thủ các quy định về an toàn phóng xạ: Các cơ quan quản lý có liên quan đã ban hành các quy định về an toàn phóng xạ nhằm đảm bảo việc sử dụng đồng vị phóng xạ an toàn và hiệu quả. Buộc phải tuân thủ nghiêm ngặt các quy định này.
- Sử dụng thiết bị bảo hộ: Khi làm việc với đồng vị phóng xạ, cần sử dụng các thiết bị bảo hộ thích hợp như găng tay, kính bảo hộ, áo khoác chì,… để bảo vệ cơ thể khỏi bị phơi nhiễm bức xạ.
- Đào tạo và nâng cao nhận thức: Cần được đào tạo bài bản về kiến thức an toàn phóng xạ và nâng cao nhận thức về các nguy cơ tiềm ẩn khi sử dụng đồng vị phóng xạ.
- Quản lý và lưu trữ an toàn: Đồng vị phóng xạ cần được quản lý và lưu trữ an toàn trong các cơ sở được cấp phép để tránh rò rỉ và thất lạc.
- Xử lý chất thải phóng xạ: Chất thải phóng xạ cần được xử lý theo quy trình an toàn để đảm bảo không gây hại cho môi trường và sức khỏe con người.
Bài tập về tính phần trăm đồng vị
Bài tập: Tính phần trăm đồng vị của Chlorine
Đề bài: Chlorine tự nhiên gồm hai đồng vị chính là \(^{35}\text{Cl}\) và \(^{37}\text{Cl}\). Khối lượng nguyên tử trung bình của chlorine là 35.453 u. Tính phần trăm số lượng của mỗi đồng vị trong chlorine tự nhiên.
Giải:
Đặt \(x\) là phần trăm số lượng của \(^{35}\text{Cl}\) và \(y\) là phần trăm số lượng của \(^{37}\text{Cl}\). Ta có phương trình:
\[x + y = 100\]
Khối lượng nguyên tử trung bình của chlorine được tính bằng công thức:
\[x \cdot 35 + y \cdot 37 = 35.453 \times 100\]
Vì \(x + y = 100\), ta có thể thay \(y = 100 – x\) vào phương trình thứ hai:
\[35x + 37(100 – x) = 3545.3\]
Giải phương trình này để tìm \(x\):
\[35x + 3700 – 37x = 3545.3\]
\[-2x = 3545.3 – 3700\]
\[-2x = -154.7\]
\[x = 77.35\]
Vậy \(x = 77.35\%\) và \(y = 100 – 77.35 = 22.65\%\).
Kết luận
Phần trăm số lượng của \(^{35}\text{Cl}\) trong chlorine tự nhiên là 77.35%, và phần trăm của \(^{37}\text{Cl}\) là 22.65%.
Thế giới đồng vị muôn màu muôn vẻ đã hé mở trước mắt bạn. Hy vọng bài viết này đã mang đến cho bạn những kiến thức bổ ích và khơi gợi niềm đam mê khám phá khoa học. Hãy tiếp tục tìm hiểu và lan tỏa tri thức về đồng vị để góp phần xây dựng một tương lai tươi sáng, nơi khoa học và công nghệ đồng hành cùng con người chinh phục mọi thử thách.







